PCR-DGGE法分析不同酒曲中细菌多样性*
姚淑敏, 刘合凤, 高 飞, 张雅倩, 孔雪玉, 杨重驿
(曲阜师范大学生命科学学院,273165,山东省曲阜市)
酒曲是酿造甜酒酿的糖化剂、发酵剂,酒曲中含有丰富的微生物和酶,因此有“曲是酒之骨”的说法.独特的酒曲微生物群系组成是影响酒类香气物质、营养成份和种类繁多的风味物质的重要原因之一[1-2],因此对酒曲中微生物多样性的研究有助于了解酒曲风味物质的形成机制.杨春敏等[3]研究海南山兰米酒中微生物多样性发现,酒曲中除含有多种真菌如根霉、曲霉、假丝酵母等外,还含有一些细菌,主要有片球菌(Pediococcus)、肠杆菌属(Enterobacter)、魏斯氏菌(Weissella)、Klebsiella等.杜丹等[4]研究陕西谢村黄酒酒曲中微生物多样性结果表明,黄酒酒曲中含有大量的细菌分属于克罗彭斯特菌属(Kroppenstedtia)、芽孢杆菌属(Bacillus)、乳杆菌属(Lactobacillus)等.袁亦舟等[5]研究青稞酒中微生物多样性发现,在青稞酒中含有的真菌主要是根霉属、曲霉属、线虫草属和酵母属的微生物,细菌主要是细菌主要有库克菌属、球菌属、芽孢杆菌属、微球菌属等.胡桂林等[6]从大曲中分离到1株细菌.李燕等[7]从羊羔美酒大曲中分离出包含魏斯氏菌属(Weissella)、乳杆菌属(Lactobacillus)、片球菌(Pediococcus)、芽孢乳杆菌(Sporolactobacillus)、葡萄球菌(Staphylococcus)、高温放线菌属(Thermoactinomyces)和4个不可培养的细菌种类的细菌.王艳萍等[8]对湖北荆州的甜酒曲中的微生物进行分离纯化,分离得到一株霉菌,一株酵母菌和两株细菌.LV X C等[9-10]从红曲中分离得到Bacillus属,Staphylococcus属,Leuconostoc属,Pediococcus属,Lactobacillus属和Lactococcus属的细菌,并且证明在红曲中的优势菌群是乳酸菌.CHAO S H等[11]对台湾米酒酒曲乳酸菌的多样性进行了研究.WANG P X等[12]对浙江绍兴酒曲中的可培养细菌进行研究,证明在绍兴酒曲中的细菌主要是乳酸菌和芽孢杆菌.由此可见酒曲中的细菌及其多样,从而说明细菌在酒曲发酵过程中以及酒的风味的形成有着及其重要的作用.以上这些方法都是建立在常规分离方法的基础上,这种平板分离培养的方法只能分析样品中1%的可培养微生物,对于绝大多数的不可培养微生物则需要利用其他方法进行研究,所以用不可培养方法研究样品中微生物多样性更加能够客观地反映样品中微生物组成.
DGGE(denaturing gradient gel electrophoresis),即变性梯度凝胶电泳,是研究微生物群落结构最重要的分子生物学方法之一,具有高效、方便、快速、直观、稳定的优点,同时可进行多样本分析,现在已广泛应用于自然界微生物及不可培养微生物的多样性研究[13].以聚合酶链式反应和变性梯度凝胶电泳(polymerase chain reaction- denatured gradient gel electrophoresis,PCR-DGGE)分析样品中微生物多样性多有报道[14-19].在分离的样品中都有不可培养微生物的类群,因此利用这种方法不仅可以了解样品中优势微生物种类,同时可以了解样品中的不可培养微生物.如研究者在研究酒曲中微生物群落结构中发现的UnculturedWeissella、Uncultured Propionibacteriaceae bacterium、Uncultured Cyanobacterium等,这说明用免培养方法可以检测到未发现的微生物,可以更加全面地了解大曲中的微生物群落.
本研究旨在通过利用PCR-DGGE方法对湖南、浙江、福建三省六地的甜米酒酒曲中细菌的多样性进行研究比较,以了解不同地区甜酒酿风味炯异的原因,近而研究不同酒曲微生物在发酵过程中的代谢作用,为甜酒酿品质的进一步提高以及甜酒酿的深加工提供理论依据.
1 材料与方法
1.1 材料与试剂
1.1.1 样品
分别选取湖南韶山、湖南湘潭、湖南祁东、福建福州、浙江丽水和浙江兰溪6个地区的酒曲,并分别用1#、2#、3#、4#、5#、6#来标记.
1.1.2 培养基
LB(Luria-Bertani)液体培养基和LB(Luria-Bertani)固体培养基,配方见参考文献[20]
1.1.3 细菌16S rRNA gene V3区扩增所用引物
F357-GC:5'-CGCCCGCCGCGCCCCGCGCCC
GGCCCGCCGCCCCCGCCCC CCTACGGGAGGC
AGCAG -3',
R518:5'-ATTACCGCGGCTGCTGG-3'
F357:CCTACGGGAGGCAGCAG;
1.1.4 试剂
50×TAE(Tris-Acetic acid-Ethylene Diamine Tetraacetic Acid)电泳Buffer,0.1 mol/L CaCl2溶液,0.1 mol/L CaCl2溶液(含有15%甘油),10 mg/mL的氨苄青霉素.
1.2 主要仪器与设备
PCR反应扩增仪(BIO-RAD),YXJ-2离心机(加拿大BBI公司),H6-1微型电泳槽(上海精益公司),凝胶成像系统(上海山富公司),变性梯度凝胶电泳(DGGE)仪(美国Bio-Rad公司).
1.3 方法
1.3.1 样品总DNA的提取
利用土壤基因组DNA快速抽提试剂盒(产品编号SK8233/SK8234)提取甜酒曲样品总DNA.
1.3.2 细菌16S rRNA 基因V3区扩增
所用引物为细菌16S rDNA V3高变区F357和R518(表1),反应体系见表2.

表1 PCR引物
取PCR产物各3 μL,1.5%琼脂糖凝胶电泳,1×TAE缓冲液,120 V稳压电泳30 min,成像仪拍照.

表2 PCR反应体系
1.3.3 变性梯度凝胶电泳(DGGE)
变形梯度凝胶电泳的具体步骤参考文献[21]中阐述的方法.
1.3.4 DGGE条带回收
选取6种样品中有代表性的条带,参照SK8131胶回收试剂盒的方法进行回收处理,回收产物放于-20 ℃备用.
1.3.5 目的片断PCR扩增和克隆
目的片断PCR扩增和克隆参考文献[22]介绍的方法进行.将测序结果在NCBI上进行Blast比对,利用MEGA5构建系统进化树,并利用Bootstrap进行1000次可信度分析.
2 结果与分析
2.1 细菌16S rRNA gene V3区PCR扩增结果
以F357-GC和R518为扩增引物,以提取的6种甜酒曲样品的总DNA为模板进行16S rRNA gene V3区扩增,片段长度大约为200 bp左右,分别取1.5 μL PCR扩增产物进行电泳分析,电泳结果如图1所示.从图1可以看出,6种酒曲中分别克隆到相应的片段,片段大小在200 bp左右,与16S rRNA gene V3区大小相近.
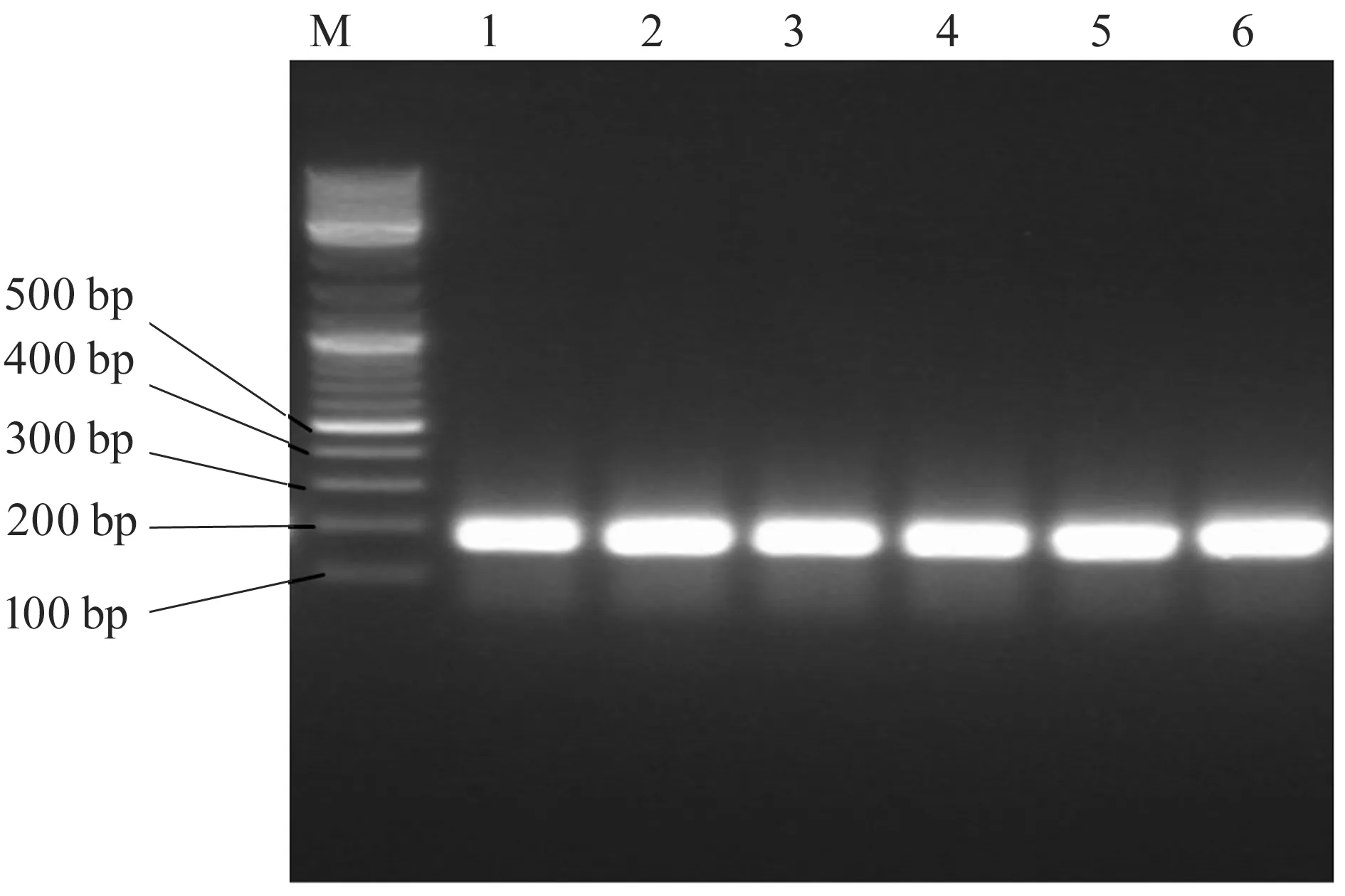
图1 细菌16S rRNA gene V3区PCR电泳结果(M:marker,1、2、3、4、5、6分别代表6种酒曲)
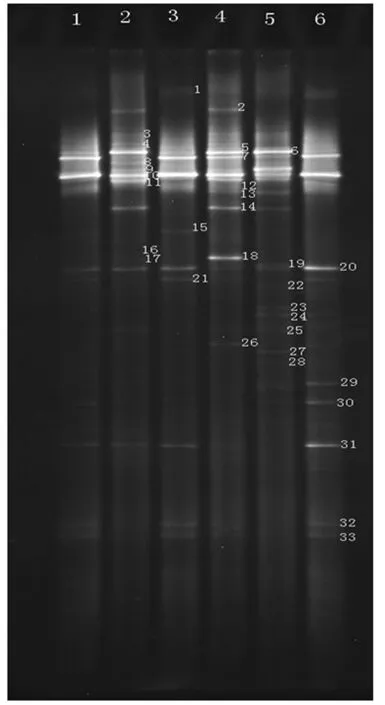
图2 细菌DGGE电泳图谱
2.2 变性梯度凝胶(DGGE)结果
取上述PCR扩增产物,分别对6组样品进行DGGE分析,电泳图谱如图3所示,选取有代表性的条带进行编号,共编号 33条条带.从图可以看出6种酒曲中分别含有不同的条带,每种酒曲中的条带编号见表3.表3表明在不同的酒曲中条带数目不等,这也可以说明,不同酒曲中可能含有的细菌种属不同.

图3 28条16S rDNA V3区PCR扩增结果
2.3 PCR扩增及测序
以回收的33条DGGE片段为模板,以F357和R518为引物进行PCR扩增,然后电泳检测,结果如图3(图中的DNA Marker同图2中Marker的分子量).共扩增出28条条带,其中编号为4、6、7、8、15没有克隆出产物,原因可能是胶回收的量不足以进行PCR扩增或是在扩增过程中操作的问题导致.因此在图3中只有28条条带的PCR结果(图中的编号与图2中编号相对应),从图3中可以看出扩增片段的长度大约200 bp左右.
将PCR产物与质粒pMD18-T Vector进行连接转化,然后提取质粒,寄上海生工生物工程有限公司进行测序,测序结果在NCBI上进行BLAST分析,结果见表3.
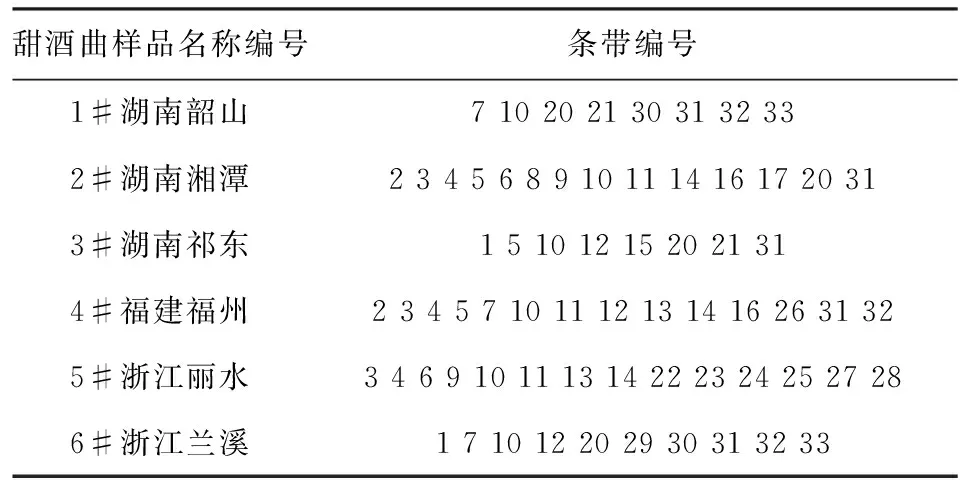
表3 甜酒曲样品中细菌条带编号

表4 条带16S V3可变区序列分析
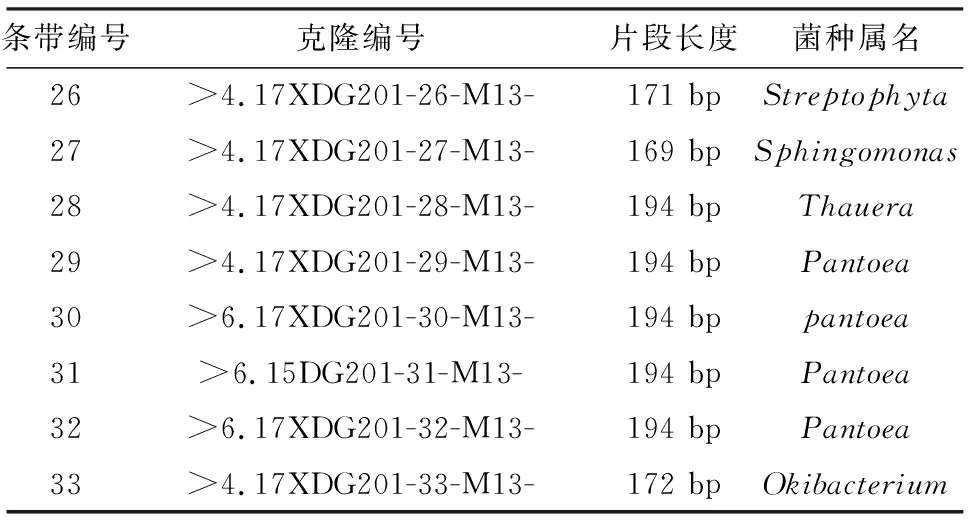
条带编号克隆编号片段长度菌种属名26>4.17XDG201-26-M13-171 bpStreptophyta27>4.17XDG201-27-M13-169 bpSphingomonas28>4.17XDG201-28-M13-194 bpThauera29>4.17XDG201-29-M13-194 bpPantoea30>6.17XDG201-30-M13-194 bppantoea31>6.15DG201-31-M13-194 bpPantoea32>6.17XDG201-32-M13-194 bpPantoea33>4.17XDG201-33-M13-172 bpOkibacterium
从表4可以看出,测序的28条条带在NCBI上进行BLAST分析,结果表明这28条条带分属于Weissella(魏斯氏菌属),Pediococcus(片球菌属),Pantoea(泛菌属),Sphingomonas(鞘氨醇单胞菌属),Lactococcus(乳球菌属),Enterobacter(肠杆菌属),Streptophyta属,Bacillus(芽孢杆菌属),Klebsiella(克雷白氏杆菌属),Rhizobium(根瘤菌属),Thauera(索氏菌属),Okibacterium属,共有12属中的细菌,选取不同属中的代表菌株,利用MEGA5.0软件的邻接法(Neighbor-Joining)构建系统进化树,结果见图4.
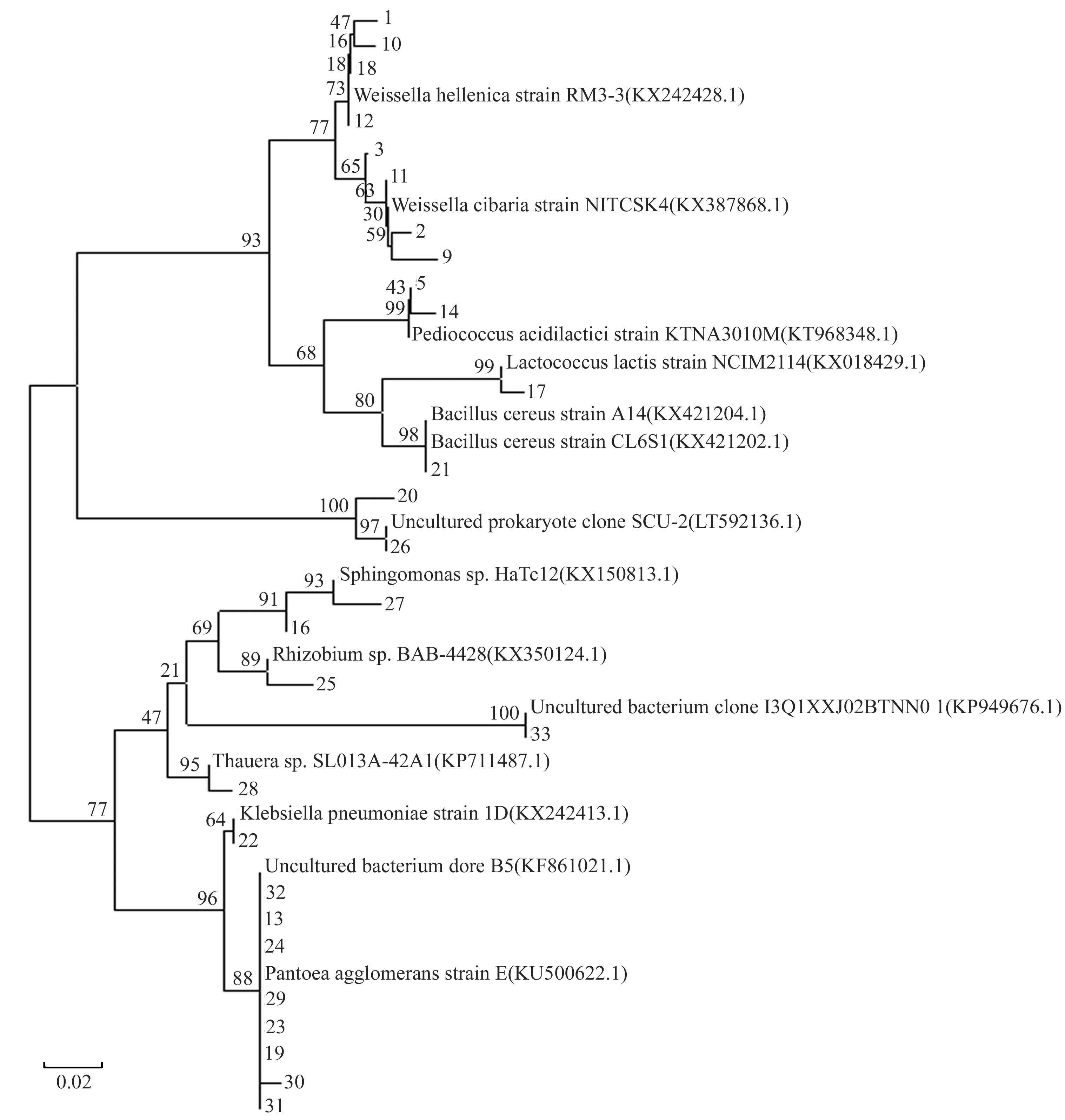
图4 基于16S rDNA V3区序列构建的系统进化树
从图4可以看出,与13、19、23、24、29、30、31、32同源性高的菌株是Pantoeaagglomeransstrain1D,相似性达到99%;2、3、9、11与WeissellaoibariastrainNITCSK4菌株相似性达到99%;1、10、12、 18与WeissellahellenicastrainRM3-3菌株相似性是99%;22与Klebsiellapneumoniawstrain1D的同源性最高;28与Theuerasp.SLA13A42A1同源性最高,达99%;25与Rhizobiumsp.BAB4428同源性最高达到98%;16、27与Sphingomonassp. HaTo12 菌株同源性最高,前者达98%,后者达99%;与33同源性最高的菌株是不可培养细菌KP949676,相似性是100%;与26、20同源性高的菌株是Unculture prokaryote clone SCU-2,前者相似性达到100%,后者相似性达到98%;21与BacilluscereusstrainA14的同源性最高,相似性达到100%;与17同源性高的菌株是LactococcuslactisstrainNCIM2114,相似性达99%;与5、14同源性高的菌株是PediococcusacldllacticlstrainKTNA3010M,前者与该菌株的相似性达100%,后者与它的相似性达99%.
表4可以看出,在不同的酒曲中含有的细菌的种类不同,湖南韶山的酒曲中主要是Weissella,Streptophyta,Bacillus,Pantoea,Okibacterium这5个属的菌株,湖南湘潭酒曲中主要含有Weissella,Pediococcus,Lactococcus,Sphingomonas,Streptophyta,Pantoea这6属的菌株,湖南祁东主要含有Weissella,Pediococcus,Bacillus,Klebsiella,Pantoea这5属的菌株,福建福州含有Weissella,Pediococcus,pantoea,Pediococcus,Sphingomonas,Enterobacter,Rhizobium,Sphingomonas,Thauera8属的菌株,浙江丽水酒曲含有Weissella,Pantoea,Pediococcus,Klebsiella,Enterobacter,Rhizobium,Sphingomonas,Thauera8属的菌株,浙江兰溪酒曲含有Weissella,Streptophyta,Pantoea3属的菌株.从6种酒曲含有的细菌类群分析,Weissella属和pantoea属的菌株存在较广,说明这两个属的菌株在酒曲中起着非常重要的作用.研究发现Weissella属的菌株不仅在酒曲中是优势菌群而且在食品、医药、发酵工业上具有极其重要的作用[16].由于酒曲中的微生物不同,将导致在发酵过程中的产物的不同,进而导致酒曲发酵后的酒酿中的营养成分的差异,这也是不同地区酒酿的风味不同的原因.在接下来的实验中我们还将对着6种酒曲中的氨基酸、有机酸、醇类、酯类等进行进一步的研究.
3 结 论
从以上结果可以看出,在这6种酒曲样品中,利用PCR-DGGE方法分离出不同的细菌.其中6种酒曲中共有的菌为Weissella属和Pantoea属的菌株,由此可以推断,Weissella和Pantoea属在酒曲中具有及其重要的作用.此外不同的酒曲中都有独特的细菌菌株湖南韶山酒曲中含有Okibacterium属的菌株,湖南湘潭和浙江兰溪酒曲中含有Streptophyta属的菌株,浙江丽水和福建福州酒曲中细菌丰富,都有8个属的细菌存在,特有的菌为Rhizobium,Thauera属的菌株,这些特有菌株的存在赋予酒曲发酵产品不同的风味及理化性质.因此利用这种非培养模式分析了不同酒曲中细菌的多样性,可以极大的丰富微生物资源,同时丰富对不可培养微生物菌群的认识.研究结果表明,在非培养方式下,利用PCR-DGGE分析方法检测到不同酒曲中细菌物种资源包括Weissella(魏斯氏菌属),Pediococcus(片球菌属),Pantoea(泛菌属),Sphingomonas(鞘氨醇单胞菌属),Lactococcus(乳球菌属),Enterobacter(肠杆菌属),Streptophyta属,Bacillus(芽孢杆菌属),Klebsiella(克雷白氏杆菌属),Rhizobium(根瘤菌属),Thauera(索氏菌属),Okibacterium属,共有12属的细菌菌群.由此可见在微生物的非培养鉴定技术的基础上,利用 PCR-DGGE 分子生物学手段,研究酒曲中细菌的多样性具有较为明显的优势,利用此方法不仅可以了解酒曲中可培养细菌的多样性,同时还可以了解不可培养细菌的多样性.本实验结果在丰富湖南、福建、浙江三地的酒曲中微生物种子资源的基础上,为三地酒曲的进一步开发利用提供理论支持,同时为进一步研究我国南方其他地区酒酿风味物质特征、营养提供理论依据,从而为改进传统的配料和酿造工艺奠定了理论基础.

