杜仲雌雄花发育与内源激素含量动态变化的关系
(1.中国林业科学研究院经济林研究开发中心,河南 郑州 450003;2.国家林业和草原局杜仲工程技术研究中心,河南 郑州 450003;3.经济林种质创新利用国家林业和草原局重点实验室,湖南 郑州 450003)
杜仲Eucommia ulmoides为杜仲科杜仲属Eucommia植物,又是我国特有的第三纪孑遗植物,具有重要的经济和生态价值[1]。杜仲为严格雌雄异株,雌雄株的分布比例近似1∶1[2]。杜仲雌花单生于苞片腋间,授粉后发育成果实,其种仁轧制的杜仲籽油含有多种代谢产物以及丰富的不饱和脂肪酸,其中α-亚麻酸含量达60%左右,可制作成杜仲亚麻酸软胶囊等产品[3];果皮是提取杜仲胶的重要原材料,在医疗工业领域应用前景广阔。杜仲雄花簇生于苞片腋间,其花粉活性成分和营养成分的含量和种类十分丰富,是一种珍贵的药用花粉资源,由雄花开发出了杜仲雄花茶、雄花酒等产品[4]。
花芽分化是植物由营养生长向生殖生长转变的重要标志之一,分化过程受植物和外界因素共同影响,分化时间、数量和质量与经济林木的早实性、丰产性、稳定性以及商品价值紧密相关。花芽分化是一个复杂的生理生化、基因调控和形态发生变化的过程,对植物花芽分化的研究包括花芽生长锥分生组织细胞的形态学观察,碳氮化合物和激素等生理生化指标变化以及开花调控相关基因的变化[5]。刘朝晖等对杜仲雌雄花芽分化进程的解剖结构进行了观察,但未对花芽外部形态和内源激素动态变化进行观察和测定[6]。不同地区的气候条件、立地条件或栽培品种存在差异,植物花芽分化时间和进程也会发生变化,因此仅根据前人研究不能准确判断其它地区的花芽具体分化进程,进而影响研究区域栽培管理和进一步试验研究[7]。花芽外部形态特征与内部解剖结构存在一定的相关性,在花芽发育过程中建立形态标记利于判断不同环境条件下花芽的分化进程,根据早实核桃Juglans regia雌花芽的大小、性状、鳞片质地和颜色判断花芽内部结构[8]。植物内源激素含量和动态变化与植物过程密切相关,如低ABA/IAA 促进油菜的成花诱导和花器官发育,但高ABA/IAA 则有利于花芽形态分化[9];银杏Ginkogo biloba花芽不同发育阶段,雌雄花芽中ABA、IAA 和ZRs 含量发生变化,且在雌雄花芽中变化趋势存在差异[10-11]。研究显示通过喷施外源激素能够影响杜仲短周期林地上部分生物量和杜仲胶产量[12]。杜仲也是雌雄异株孑遗植物,因此通过观察杜仲雌、雄花芽分化过程中内外形态结构,以期建立花芽发育形态标记;同时分析不同发育时期雌雄花芽中ABA、IAA 和ZRs含量动态变化,了解这3 种内源激素对杜仲雌、雄花芽分化的作用,为进一步杜仲花芽发育研究提供依据以及为科学指导杜仲栽培管理提供理论参考。
1 材料与方法
1.1 试验材料
试验地位于中国林业科学研究院经济林研究中心原阳试验基地(34°55′18″~34°56′27″N,113°46′14″~113°47′35″E)。材料为杜仲良种示范园栽培的7年生嫁接苗果用国审杜仲良种‘华仲6 号’(F6)和雄花用国审杜仲良种‘华仲11 号’(M11)为研究材料。分别选取3 棵生长势均匀且无病虫害的雌、雄株作为样株。从2017年4月25日—9月30日每隔4 d 采样一次,10—12月每隔9 d 采样一次,材料采集混合后,投放入FAA 固定液(70%乙醇∶冰乙酸∶38%甲醛=18∶1∶1)保存固定,后带回实验室-4℃低温保存。同时,在采集FAA 固定材料时,每样株另采集花芽30粒立即投放入液氮中,带回实验室保存在-80℃超低温冰箱,用于植物激素测定,雌、雄株各3 个生物学重复。
1.2 外部和内部结构形态观察
每取样周期分别选取10 个典型雌雄株花芽进行外部形态观测,测定指标包括花芽大小、苞片数量、苞片颜色以及质地的变化,同时数码相机拍照记录外部形态。内部结构观察按照常规石蜡切片方法进行制片[12],FAA 固定的材料逐渐酒精脱水、二甲苯透明、变温浸蜡、切片,粘片后用番红固绿双重染色、脱蜡、复水、番红-固率复染、中性树胶封片后OLYMPUS 光学显微镜下观察拍照。
1.3 内源激素测定
在花芽形态观察的基础上,选取不同发育阶段的花芽,用液氮研磨植物材料至粉末状后,称取0.1~0.2 g 样品于10 mL 离心管中,然后进行提取、提取液在过柱、洗脱、吹干、复溶、离心后上机。利用高效液相色谱-电离串联质谱法(HPLC-ESIMS/MS)测定激素含量[13]。通过AB Analyst 化学工作站进行数据的采集和获取。将混合标准品溶液逐级稀释成系列标准品溶液,以标准品浓度x(ng/mL)为横坐标,以对照品峰面积值y为纵坐标,绘制标准曲线,计算样品中目标物含量。利用T 检验分析相同发育时期的雌、雄花芽内源激素含量差异显著性,在Excel 2016 软件中绘制折线图。
2 结果与分析
2.1 杜仲雌、雄花芽分化形态结构观察
根据杜仲雌、雄花芽外部形态和内部结构观察结果,花芽分化过程可分为5 个时期:花序原基分化期(4月下旬至5月下旬)、苞片原基分化期(6月上旬至6月中上旬)、雌/雄蕊原基分化期(6月中下旬至6月下旬)、雌/雄蕊形态建成期(7月上旬至11月上旬),随后在低温影响下雌雄花芽停止生长进入休眠期(11月中下旬至次年2月中上旬),其中雌雄花芽在雌/雄蕊原基分化期生长速度较快、花芽高度和宽度发生明显变化,同时雌雄花芽高度在雌/雄蕊形态建成期差异达到显著(表1)。在花序原基分化期,花芽由营养生长转为生殖生长,雌、雄花芽形态特征比较相似,芽体幼嫩青绿色,芽顶端尖细、基部宽大、近似为三角形,表面分布着白色柔毛(图1A1、C1);内部解剖结构显示花芽顶端隆起,呈锥形,细胞质浓厚,分生能力强烈(图1B1、D1)。苞片原基分化期,花芽苞片层数增加,且最外层苞片顶端逐渐木质化,顶部颜色变为褐色,但仍分布少量柔毛(图1A2、C2);内部结构显示花芽基部至顶部分化出较多的苞片原基,且芽顶端分生组织加宽、变平(图1B2、D2)。雌/雄蕊原基分化期,外侧3~4层苞片逐渐转变为鳞片状,花芽呈褐色,内部可观察到雌花芽苞片原基腋间形成圆形小凸起即雌蕊原基,雄花芽苞片原基腋间形成数枚雄蕊原基簇生在苞片腋间,此时可根据内部结构区分雌雄花芽(图1B3、D3)。雌/雄蕊形态建成期,花芽鳞片层数增至5~7 层,闭合紧密,雌花芽顶部比雄花芽顶部偏尖(图1A4—5、C4—5);内部观察结果显示雌蕊原基逐渐伸长、发育成近羽状、顶部二裂形成柱头(图1B4—5),而雄蕊原基的花药壁逐渐发育完全,分化出表皮、药室内壁、中层和绒毡层(图1D4—5)。

表1 雌雄花芽分化过程内外部形态特征†Table 1 External morphology and internal structure of female and male floral bud development
2.2 雌雄配子体发育过程
2.2.1 杜仲雌雄花芽萌动观察
第二年2月下旬气温回升后,杜仲雌、雄花芽休眠解除。其中,当高于5.0℃的有效积温达27.5℃左右时,雄花芽苞片开始变绿,雌花芽开始萌动;有效积温达35.3℃左右时,雄花芽苞片完全变绿且形成小孢子母细胞,雌花芽进行纵向生长;有效积温达85.3℃左右时,雄花芽苞片完全张开、露出雄蕊且小孢子母细胞进行减数分裂形成四分体,雌花芽苞片变绿,不断伸长且胚珠原基开始发育、逐渐突起;有效积温达170.1℃左右时,雄配子体发育成熟,形成二细胞花粉粒,雄花开始散粉,雌花芽大孢子母细胞进行减数分裂发育为功能大孢子母细胞,雌蕊柱头开始授粉(表2)。

图1 不同分化期雌雄花芽内部解剖结构及其外部形态特征Fig.1 The external morphology structure and anatomic structure of female and male flower bud in different differentiated phases

表2 雌雄配子体发育过程内外部形态特征Table 2 External morphology and internal structure of male and female gametophytes development
2.2.2 大小孢子发生和雌雄配子体发育过程
杜仲雄花花药具有4 个花粉囊,横切面为典型的蝴蝶形结构(图2C)。在7月中旬雄蕊原基的周缘组织和造孢组织开始进行伸长生长和边缘生长产生花药原基(图2A)。花药原基的4 个角隅处细胞具有高度分裂能力,迅速分裂形成核大、质浓的孢原细胞,而最外面分化出一层表皮;孢原细胞分裂速度快,经一次平周分裂形成初生周缘细胞(外层)和初生造孢细胞;至11月上旬,初生周缘细胞经过不断分裂完成花药壁发育,由外自内分别形成表皮细胞(1 层)、药室内壁(1 层)、中层细胞(2~3 层)及绒毡层细胞(1 层)(图2B—C)。次年3月1日左右初生造孢细胞经过多次有丝分裂形发育成小孢子母细胞,3月10日左右小孢子母细胞进行减数分裂(图2E),最终形成四分体,为四面体型,一般可观察到3 个细胞(图2F)。3月中下旬花粉粒逐渐发育成熟,发育成2-核花粉粒(图2G),中层细胞和绒毡层细胞逐渐发生解离直至完全被吸收,花药壁仅剩下表皮和药室内壁,花粉粒散出(图2H)。
杜仲的大孢子发生晚于小孢子发生10 d左右,当小孢子母细胞开始减数分裂时,胚珠原基开始突起发育。杜仲雌蕊具2 心皮,子房1 室,有花柄,扁平,顶端2 裂成柱头,柱头反曲生于子房裂口内侧,无花柱;柱头由不规则的薄壁细胞组成,两柱头在子房壁中延伸一段距离后愈合(图2I)。其中胚珠原基具有强烈的分裂能力,前端发育成珠心,基部发育成珠柄(图2J)。随着胚珠原基的发育,珠心表皮下分化出核大、质浓的孢原细胞(图2K—L)。孢原细胞进行平周分裂产生周缘细胞和造孢细胞,后者直接发育成大孢子母细胞,此时大孢子母细胞体积大、核大、细胞质较浓,位于珠心表皮和周缘细胞下,因此胚珠发育属于厚珠心型(图2M)。随后大孢子母细胞进入减数分裂,经第一次减数分裂形成二分体(图2N),然后经第二次减数分裂后大孢子四分体呈线型排列(图2O)。其中四分体中位于珠孔端的3 个大孢子逐渐退化,仅合点端的1 个发育为功能大孢子(图2P)。

图2 大小孢子发生及雌雄配子体发育Fig.2 Megasporogenesis,microsporogenesis and development of female and male gametophytes
2.3 雌雄花芽不同发育时期内源激素含量变化
杜仲雌、雄花芽的ABA、IAA 和ZR 含量在不同发育时期均发生了变化,其中ABA 含量在雌雄花芽间变化趋势不一致,但IAA 和ZR 含量在雌雄花芽间变化趋势一致(图3)。雌花芽ABA含量呈“降低—升高—降低”的趋势,而雄花芽呈“升高—降低—升高—降低”的趋势,除了在雌雄蕊原基分化期(6月14日),雌花芽ABA 含量在其它发育时期均显著高于雄花芽(图2~3)。雌、雄花芽的ABA 含量均在花芽休眠期(12月10日)达到最高峰,分别为988 ng·g-1和590 ng·g-1;在大、小孢子发生期(3月1日)ABA 含量最低,雌雄花芽分别是98 ng·g-1和60 ng·g-1。雌、雄花芽IAA含量均呈“上升—下降”的趋势,且雌花芽IAA含量一直显著高于雄花芽,但雌、雄花芽IAA 含量均在大、小孢子发生期达到最高峰,分别是105 ng·g-1和82 ng·g-1;在雌、雄花芽休眠期含量最低,分别是48 ng·g-1和28 ng·g-1。雌、雄花芽ZR含量均呈“下降—上升—下降”的趋势,且雄花芽ZR 含量一直高于雌花芽,但在雌、雄蕊原基分化期的ZR 含量差异不显著,其它时期均差异显著;两者的ZR 含量均在雌/雄蕊形态建成期达到最高峰,分别是14 ng·g-1和7 ng·g-1,在雌、雄雄蕊原基分化期含量最低均为3 ng·g-1。此外,杜仲花芽在诱导花器官分化过程中(花序原基分化期至雌、雄蕊原基分化期),IAA 和ZR 含量在花芽中分别是上升和下降的,而ABA 含量在雌、雄花芽的分别是下降和上升的,说明ABA 对杜仲的雌、雄蕊分化可能分别具有抑制和促进作用。
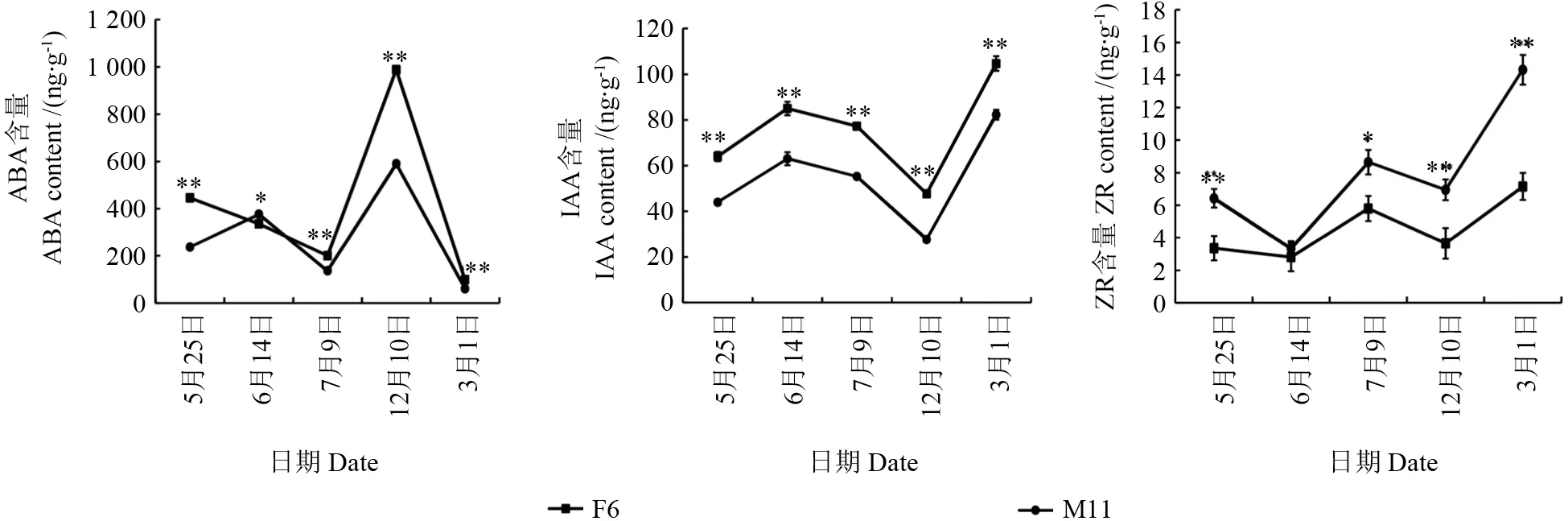
图3 雌雄花芽不同发育期激素含量变化Fig.3 Variation of endogenous hormone during different female and male floral development
3 结论与讨论
确定花芽发育进程时期,可为植物及时采取合理栽培管理措施提供参考,对实践生产和育种具有指导意义。多种植物花芽分化研究结果表明,花芽发育过程中外部形态与内部解剖结构存在着相关性,徐自龙等研究结果表明依据山鸡椒Litsea cubeba的外部形态判断花芽分化发育阶段是可行的,这为人工授粉等研究适时取材提供了依据[15]。本研究观察结果显示杜仲花芽分化过程与刘朝晖[6]观察结果一致,但是花芽分化时间早于后者,说明不同地区的气候条件影响杜仲花芽分化进程。杜仲雌、雄花芽外部形态特征与其内部解剖结构具有一定相关性,杜仲雌、雄花芽的苞片开始木质化、芽体颜色由青绿色变为灰绿色时,花芽进入雌雄蕊原基分化期,此时雌、雄蕊原基开始在苞片基部内侧产生;第二年,雌、雄蕊开始露出苞叶时,大小孢子进入减数分裂,当雌、雄蕊完全露出苞叶时,雌雄配子体发育成熟。因此,可依据杜仲雌、雄花芽的外部形态判断花芽发育阶段,在花芽发育关键时期积极采取管理措施从而促进雌雄花器官和配子体正常发育。
通过对杜仲雌雄花芽整个发育过程观察,杜仲雌、雄花芽在整个发育过程中无花被片产生,且在一个性别的花芽中观察不到另一个性别花器官原基发生的痕迹,其单性花与杨树Populus deltoides、大麻Cannabis sativa等植物的单性花产生模式一致,即单性花的性别分化发生在雄蕊和心皮发育之前[16]。杜仲雌雄花的性别不是由某一个性别花器官退化造成的,雌雄花芽虽在花芽营养阶段形态结构相似,但此时性别已产生,具有本质差异。
植物的开花过程受植物激素调控,不同内源激素对雌雄花芽的促进作用具有差异。本研究对杜仲雌、雄花芽不同发育时期花芽的ABA、IAA和ZR 含量测定结果显示,在花器官启动过程,杜仲雌雄花芽的IAA 含量均上升、ZR 含量均下降,IAA 和ZR 对雌雄花芽形态分化具有相似作用,且高含量的IAA 和低含量的ZR 可能对雌、雄蕊的形态分化可能具有促进作用;然而,此过程中雌花芽的ABA含量下降,而雄花芽的ABA含量上升、且含量显著高于雌花芽,但在其他发育时期,雄花芽的ABA 含量均显著低于雄花芽,说明ABA对雌雄花芽具有不同调控作用,可能一定含量的ABA 对杜仲雄蕊原基的分化具有促进作用,而雌蕊分化需要低水平的ABA 含量。杜仲雌雄花芽中ABA 和ZR 含量变化趋势及其含量高峰期与银杏Ginkogo biloba雌、雄花芽激素变化一致[10-11]。雌雄花芽中激素的差异变化与雌雄花比例甚至植物性别密切相关,如生长素在黄瓜Cucumis sativus、大麻、柿子Diospyros kaki等植物中促进雌蕊发育,但对啤酒花Humulus lupulus和青蒿Mercurialias annua等植物的雄蕊发育具有促进作用和提高雄花比例[17]。脱落酸对植物性器官的影响可通过抵消生长素和赤霉素在植物中雌化或雄化作用[18]。Akagi 等在猕猴桃Actinidia chinensis的Y 染色体上鉴定的性别决定基因SyGI,是一个C 类型的细胞分裂素响应基因,具有抑制雌蕊发育,使植株表现为雄性的功能[19];甚至,喷施细胞分裂素可使山葡萄Vitis amurensis雄株性别发生反转[20]。此外,乙烯、赤霉素、茉莉酸等植物激素也可影响植物的花器官分化甚至调控花性器官的性别转化,但在不同植物中激素调控花器官作用和影响程度不同[21]。同时,植物的营养供应对花芽内源激素也具有调控作用,在油茶花芽前分化期施肥可以提高花芽中的ABA 和ZR 含量,但花芽形态分化期则降低ABA 含量,促进油茶花芽生长和分化率[22]。但是本研究只是基于3 种激素进行了测定,缺乏乙烯、茉莉酸等其他植物内源激素在杜仲雌雄花芽过程中调控作用研究,同时也需要对雌雄花芽中的营养成分与内源激素的关系进行探索。虽然本研究目前还存在一定局限性,但花芽观察结果为杜仲雌雄花器官进程判断提供了外部形态依据,同时内源激素的测定结果也对生产实践中不同性别植株喷施植物调节剂提供了理论依据。

