一种四环吲哚衍生物降血糖和降血脂活性评价与作用机制
张梦迪,彭小林,吴 岩,韩开林,刘 振,孙 华
(天津科技大学生物工程学院,天津300457)
糖尿病是人类生活中最常见的代谢性疾病之一,以高血糖和高脂血症为主要特征,并伴随多种并发症,包括神经病变、肾病、心脏病、中风和血管疾病[1].2 型糖尿病约占糖尿病患病人数的90%以上,其病因是胰岛素分泌不足或胰岛素抵抗引起的血糖升高[2].目前治疗2 型糖尿病的口服药物有α–葡萄糖苷酶抑制剂、磺脲类、噻唑烷二酮类、二甲双胍和中成药等.α–葡萄糖苷酶通过水解低聚糖的1,4–α–糖苷键释放葡萄糖,是消化碳水化合物过程的最后一步.α–葡萄糖苷酶抑制剂通过抑制小肠黏膜刷状缘的α–葡萄糖苷酶活性,减缓低聚糖和二糖中葡萄糖的释放,从而降低餐后血糖水平,延缓葡萄糖吸收[3–4].磷酸腺苷活化蛋白激酶(AMPK)抑制合成代谢过程,刺激产生能量的分解代谢过程,降低血糖水平[5].AMPK活化也会抑制乙酰辅酶A 羧化酶(ACC)活性和丙二酰辅酶A 的产生,从而抑制脂肪合成和刺激脂肪酸氧化.
四环吲哚衍生物是一类代表性的生物碱,广泛存在于植物和微生物代谢产物中,具有多种生物活性[6–7].本课题组曾经报道了一系列新型四环吲哚衍生物的合成以及抑制α–葡萄糖苷酶活性的研究[8–9].其中,四环吲哚衍生物化合物7i 具有较强的α–葡萄糖苷酶抑制活性,但其作用机制以及体内是否具有降血糖和降血脂活性尚不清楚.因此,本研究旨在探讨化合物7i 能否改善糖尿病小鼠的高血糖和高血脂等症状,并进一步研究该化合物的抑制α–葡萄糖苷酶作用机制以及其他可能的作用靶点.
1 材料与方法
1.1 材料
化合物7i(图1)由天津科技大学药物设计与合成研究室合成(纯度>95%)[10].
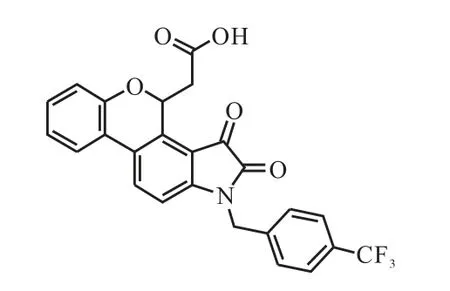
图1 化合物7i的结构Fig. 1 Structure of compound 7i
来源于酵母的α–葡萄糖苷酶(EC 3.2.1.20)、对硝基苯基–α–D–吡喃葡萄糖苷(pNGP)、4,4′–二苯胺–1,1′–联萘–5,5′–二磺酸二钾盐(Bis-ANS)、油红O溶液、3–异丁基–1–甲基黄嘌呤(IBMX)、地塞米松、油酸、棕榈酸、亚油酸、花生四烯酸、阿卡波糖,Sigma-Aldrich 公司;透析袋(MD 34-3.5-5)、DAPI 染料,北京索莱宝生物科技有限公司;人肝癌细胞HepG2、前脂肪细胞3T3-L1,中国科学院上海生物科学研究所;胰岛素,诺和诺德(中国)制药有限公司;洛伐他汀(10µmol/L),南京草本源生物科技有限公司;anti-p-AMPKα(Thr172) 、AMPKα、p-ACC(Ser79)、ACC 和β-actin 的抗体,Cell Signaling Technology 公司;5–氨基–1–[(2 R,3 R,4 S,5 R)–3,4–二羟 基–5–(羟 甲 基)恶 唑–2–基]咪 唑–4–甲 酰 胺(AICAR),安诺伦生物科技有限公司;甘油三酯(TG)、总胆固醇(TC)测试试剂盒,北京普利莱基因技术有限公司;链脲霉素(STZ),北京博爱港商贸有限公司.
1.2 体内活性评价
1.2.1 动物与饮食
体质量18~22 g 的雄性昆明小鼠购自中国农业科学院实验动物科学研究所( 许可证号为SCXK(Jun)2012–0004).该动物实验严格按照国家和当地的伦理准则执行.小鼠每笼5 只,在实验室条件下(18~23 ℃,湿度 55% ~60% ,光/暗周期为12 h/12 h)进行饲养.所有小鼠均以普通颗粒饲料喂养1 周后随机分组,正常组(10 只)的小鼠继续用普通饲料喂养,其余小鼠用高糖高脂饲料喂养(模型组和给药组).所有的小鼠均自由饮食.
1.2.2 2 型糖尿病小鼠的诱导及治疗
STZ 溶于 0.05 mol/L 枸橼酸盐缓冲液中(pH 4.5),小鼠单次腹腔注射上述STZ 溶液诱导2 型糖尿病,并连续高糖高脂饲料辅助喂养2 周,小鼠的尾静脉空腹血糖高于11.0 mmol/L,即2 型糖尿病小鼠造模成功.将造模成功的2 型糖尿病小鼠分为4 组,每组10 只.第1 组灌胃生理盐水10 mL/kg(模型组);第2 组灌胃阿卡波糖(溶解于生理盐水)55 mg/kg;第3 和4 组分别灌胃给药7i(悬浮于生理盐水中)55 mg/kg 和100 mg/kg[11].
1.2.3 血糖水平的测定
各组小鼠灌胃给药或生理盐水14 d 后,隔夜禁食,口服葡萄糖(2 g/kg),于0、30、60 和120 min 从尾静脉采集血样,血糖仪(三诺生物传感股份有限公司)测量血糖[11].
1.2.4 血脂水平的测定
在实验期结束时,眼内眦取血,1000 r/min 离心获得血清,-20 ℃储存.血清总胆固醇和甘油三酯使用试剂盒进行分析.
1.2.5 肝脏组织学评价
小鼠麻醉处死,获取胸腺、脾、胰、肝,组织用冷生理盐水冲洗,称量.肝脏用4%多聚甲醛溶液室温下过夜固定,用石蜡包埋,42 ℃干燥48 h,二甲苯脱石蜡,梯度乙醇复水,蒸馏水清洗后,用苏木精复染切片.随后用自来水、醋酸和双蒸水冲洗切片,在乙醇和甲苯中脱水并用中性胶密封.
1.3 体外活性评价
1.3.1 酶动力学
在磷酸盐缓冲液(0.05 mol/L,pH 6.8)中加入α–葡萄糖苷酶(400µL,0.01 U/mL,2 组),其中一组用7i(20µmol/L) 处理的α– 葡萄糖苷酶(400µL ,0.01 U/mL)在4 ℃下透析24 h,测定透析袋中残余酶活性,另一组α–葡萄糖苷酶经7i 处理30 min 后直接测定酶的活性[10].
1.3.2 酶内源荧光影响
α–葡萄糖苷酶(1 U)经一定浓度的 7i(0 ~500µmol/L)在37 ℃预处理30 min,用M200PRO 型荧光分光光度计(Tecan 公司)在295 nm 激发波长下测定320~400 nm 范围内的内源荧光光谱[12].
1.3.3 酶结合区域分析
α–葡萄糖苷酶(1 U)与一定浓度的 7i(0 ~50µmol/L)在37 ℃温孵30 min,添加荧光探针(Bis-ANS,30µL,100µmol/L)后,在 37 ℃下再孵育15 min,使用Synergy H1 型微板分光光度计(美国BioTek 公司)测量430~630 nm 范围内的荧光光谱(λex=400 nm)[12].
1.3.4 人肝癌细胞HepG2 培养及诱导
HepG2 细胞在含有 10% 胎牛血清(FBS)、10 U/mL 青霉素和10 mg/mL 链霉素的DMEM 培养基中置于37 ℃、5% CO2培养箱培养.将HepG2 细胞接种于6 孔板上培养24 h,正常组不加诱导剂,模型组和给药组分别加入0.75 mmol/L 的诱导剂(油酸、棕榈酸、亚油酸和花生四烯酸的体积比为29∶47∶18∶6)处理,且给药组加入不同浓度的化合物7i[13].
1.3.5 前脂肪细胞3T3-L1 培养与分化
前脂肪细胞3T3-L1 在添加10%新生小牛血清和1%青霉素–链霉素的DMEM 培养基中置于37 ℃、5% CO2培养箱培养.为了进行脂肪细胞分化,将前脂肪细胞3T3-L1 培养2 d 后,模型组和给药组加入分化培养基(含 10% 胎牛血清、0.5 mm IBMX、1µmol/L 地塞米松和10µg/mL 胰岛素),2 d 后更换含有10%胎牛血清和10µg/mL 胰岛素的DMEM 分化培养基,继续孵育2 d 后给药[14–15].
1.3.6 油红O 染色法测定脂含量
将给药处理后的人肝癌细胞HepG2 和前脂肪细胞3T3-L1 用油红O 染色,4%多聚甲醛固定30 min,1×PBS 冲洗3 次.用异丙醇提取细胞内结合的油红O,并在492 nm 处测量吸光度,计算细胞内脂含量[14].
1.3.7 尼罗红染色法分析脂含量
将尼罗红溶解在1 mg/mL 丙酮中.HepG2 细胞接种在6 孔板上,给药处理24 h 后,分别加入到终质量浓度10µg/mL 的尼罗红和1µg/mL DAPI 染料,室温黑暗条件下孵育15 min,使用倒置荧光显微镜进行拍照[14].
1.3.8 细胞内甘油三酯和总胆固醇的测定
将HepG2 和3T3-L1 细胞接种在6 孔板上,诱导分化后给药处理24 h,用1×PBS 洗3 次,离心收集细胞,用TG 和TC 试剂盒中裂解液裂解细胞,室温保存 10 min,对细胞内蛋白质进行定量分析,在70 ℃加热细胞10 min 后,2 000 r/min 离心5 min,使用试剂盒分析TG 和TC 含量[13].
1.3.9 免疫印迹分析
HepG2 和3T3-L1 细胞在60 mm 培养皿中以每孔1×105个细胞置于37 ℃、5% CO2培养箱培养24 h,正常组不加诱导剂处理,模型组和给药组加入诱导剂(油酸、棕榈酸、亚油酸和花生四烯酸的体积比为29∶47∶18∶6)处理.给药组加7i 处理24 h 加入胰蛋白酶消化收集细胞,细胞用1×PBS 洗涤3次,2 500 r/min 离心5 min,加入蛋白裂解液,在冰上裂解60 min,4 ℃、13 500 r/min 离心20 min.用BCA蛋白质分析试剂盒测定蛋白质含量,使用等量的蛋白质溶液在十二烷基硫酸钠–聚丙烯酰胺凝胶(SDSPAGE)进行电泳,电泳完成后转移到聚偏氟乙烯(PVDF)膜上.PVDF 膜在室温下用5%脱脂牛奶封闭 1 h,用不同的一抗 p-AMPK、AMPK、p-ACC、ACC 和β-actin 与PVDF 膜4 ℃孵育过夜,PVDF 膜用1×PBS 清洗3 次,与鼠抗或兔抗(1∶5 000 稀释度)在室温下孵育2 h 后,ECL-Western-Blotting 底物(Thermo-Scientific 公司)检测条带[14].
1.4 统计分析
所有数据以“均值±标准差”表示,结果采用单因素方差(ANOVA)或双向检测(two tailed independent Student’s t-tests)进行分析,显著性差异用SPSS 21.0 软件进行方差齐性检验和最小显著性差异(LSD)多重比较确定.
2 结果与讨论
2.1 化合物7i对体质量的影响
化合物7 i 对小鼠体质量的影响如图2 所示.经过1 周正常喂养,各组小鼠的初始体质量无显著性差异.高糖高脂饲料喂养3 周后,模型组的体质量显著增加.模型组单次腹腔注射STZ 后,继续喂养高糖高脂饲料喂养2 周,模型组体质量有所减轻,出现糖尿病小鼠的症状.2 型糖尿病组口服灌胃化合物7i 和阿卡波糖.给药2 周后,与2 型糖尿病模型组相比,7i 给药组体质量没有明显变化.结果表明:7i 对糖尿病小鼠体质量无明显影响,与阿卡波糖作用效果相似.
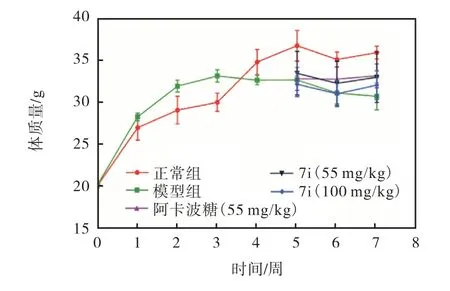
图2 化合物7i对体质量的影响Fig. 2 Effect of 7i on body weight
2.2 化合物7i对血糖和口服葡萄糖耐量的影响
化合物7i 对血糖和口服葡萄糖耐量的影响如图3 所示.以55 和100 mg/kg 剂量的7i 给药后,糖尿病小鼠的空腹血糖水平显著降低(aP<0.05、bP<0.01、cP<0.001 表示与模型组比较,dP<0.001 与正常对照组比较).为了评价化合物7i 对糖尿病小鼠的葡萄糖稳态和胰岛素敏感性的影响,进一步进行了葡萄糖耐量的测试.
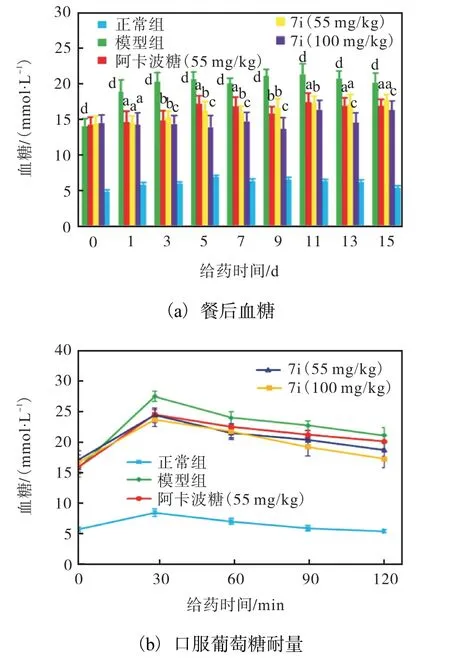
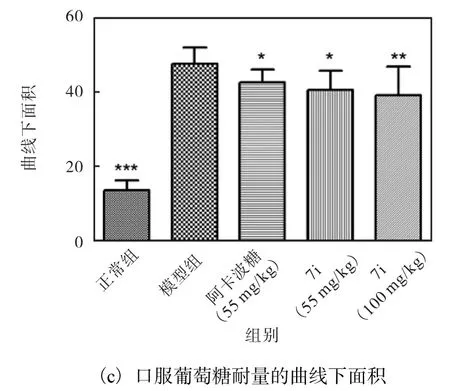
图3 化合物7i对血糖和口服葡萄糖耐量的影响Fig. 3 Effect of 7i on blood glucose and on oral glucosetolerance in diabetic mice
与模型组相比,口服葡萄糖后,7i 的55 mg/kg 剂量组在30、60、90 和120 min 的血糖浓度分别降低11.06%、10.27%、10.37%和11.08%.从曲线下面积图可以看出,与模型组相比,阿卡波糖组和化合物7i均能显著改善葡萄糖耐量(*P<0.05,**P<0.01,***P<0.001).
2.3 化合物7i对糖尿病小鼠器官的影响
分别对各组的胸腺、脾、胰、肝脏脏器指数进行分析,结果发现只有肝脏脏器指数发生显著变化.口服7i 可显著改善肝脏脏器指数的增加.进一步对肝脏进行组织学染色分析,结果如图4 所示.
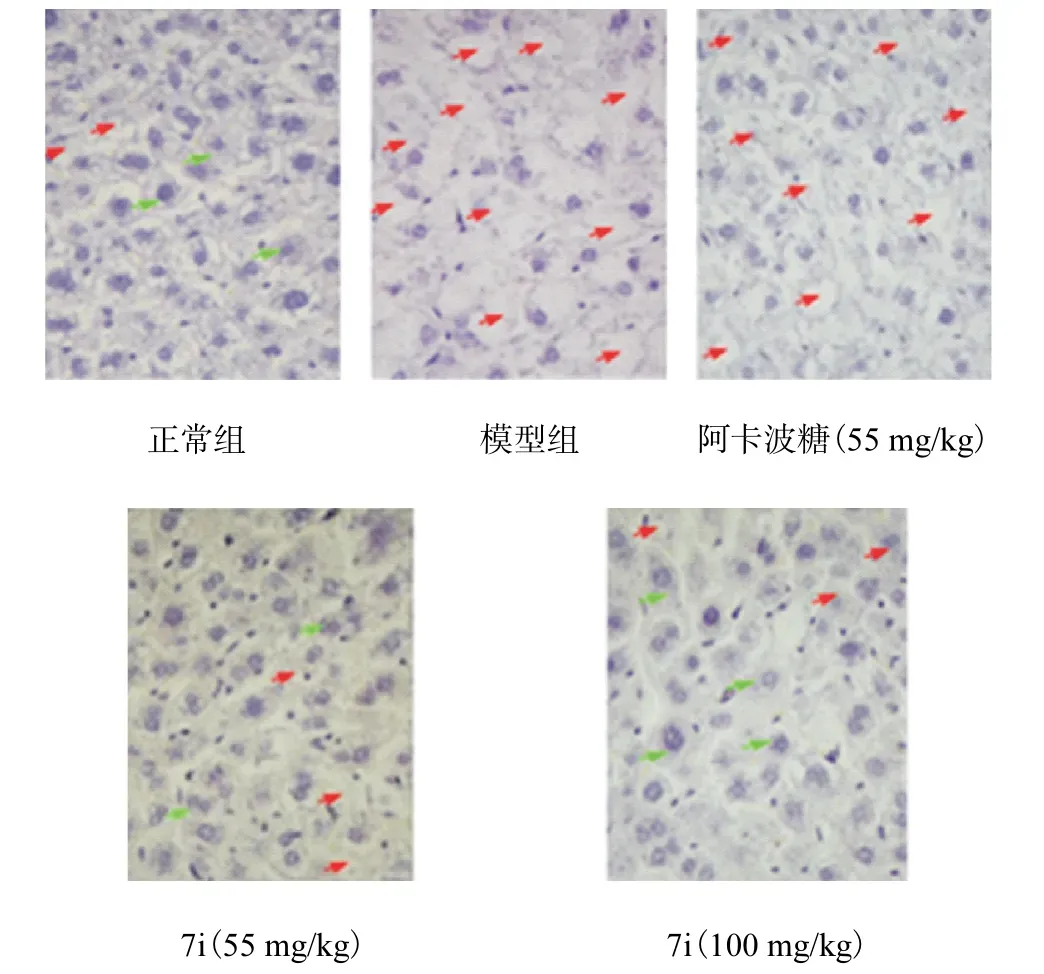
图4 不同组小鼠肝脏苏木精染色Fig. 4 Haematoxylin staining of different groups of mice liver
经苏木精染色后,发现正常组肝细胞形态正常,肝细胞索排列整齐.模型组肝细胞出现严重的病理改变,具有肝索紊乱、水肿变性和脂肪变性的特征.阿卡波糖给药组肝细胞恢复效果较差,而7i 给药组的肝细胞出现良好的恢复现象,尤其是给药100 mg/kg 剂量组,肝细胞结构与正常肝细胞结构相似,水样变性和脂肪变性得到显著恢复.因此,对于改善糖尿病小鼠的肝脏病变,相同剂量下,化合物7i治疗效果优于阿卡波糖.
2.4 化合物7i对血脂的影响
化合物7i 对血脂的影响见表1.STZ 诱导后糖尿病小鼠组血清TC 和TG 较正常组显著升高,而7i治疗的糖尿病小鼠,TC 和TG 水平显著下降.因此,化合物7i 可以显著改善糖尿病小鼠的高血脂症状.
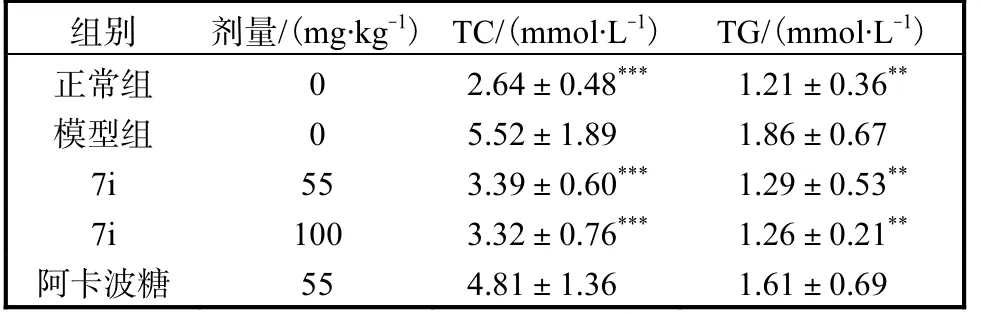
表1 甘油三酯和总胆固醇含量(n=10)Tab. 1 Levels of TC and TG in each group of mice(n=10)
2.5 α–葡萄糖苷酶的动力学性质分析
利用透析方法,对化合物7i 抑制α–葡萄糖苷酶的动力学性质进行了分析,结果如图5 所示(与酶透析组相比,**P<0.01).经化合物7i 处理的α–葡萄糖苷酶,透析后活性不能恢复,与未经透析的7i 处理的α–葡萄糖苷酶活性相似,这表明7i 对α–葡萄糖苷酶的抑制方式是不可逆的.
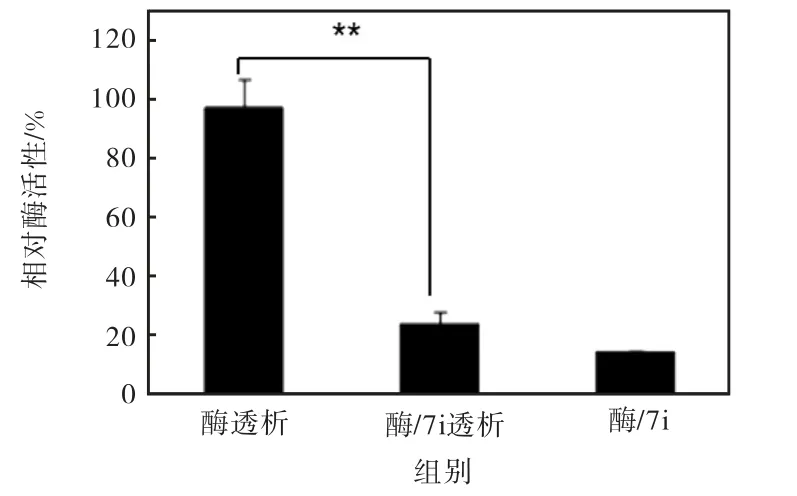
图5 化合物7i处理下透析或非透析后α-葡萄糖苷酶活性Fig. 5 α-Glucosidase activity after dialysis or non-dialysis in presence of DMSO or 7i
2.6 化合物7i猝灭α–葡萄糖苷酶的内源荧光
使用荧光猝灭实验研究了化合物7i 与α–葡萄糖苷酶的相互作用,结果如图6 所示.α–葡萄糖苷酶在295 nm 激发波长下,在336 nm 处出现内源荧光吸收峰.经不同浓度7i 处理后,α–葡萄糖苷酶的内源荧光强度随着化合物7i 浓度的增加而逐渐减弱,该结果为化合物7i 直接与α–葡萄糖苷酶结合提供了证据.这种结合可能导致α–葡萄糖苷酶中色氨酸残基的构象变化,进而影响酶活性中心与底物的结合.
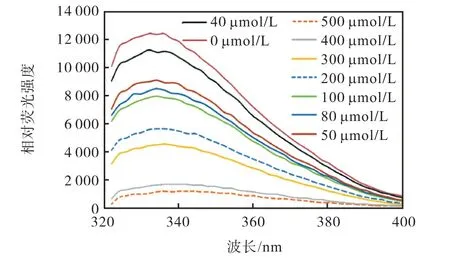
图6 不同浓度7i对α–葡萄糖苷酶内源荧光强度的影响Fig. 6 Variation of the intrinsic fluorescence intensity of α-glucosidase in the absence and presence of different concentrations of 7i
2.7 化合物7i与α–葡萄糖苷酶疏水区域的结合
利用外源荧光疏水探针bis-ANS 进一步研究化合物7i 与α–葡萄糖苷酶表面疏水性区域的结合情况.该荧光探针与α–葡萄糖苷酶共孵育时,在430~630 nm 范围内可以观察到强烈的荧光信号(图7).经不同浓度的7i 处理后,酶与荧光探针的复合物的荧光强度呈浓度依赖性明显降低.该结果说明化合物7i 可能与酶的疏水区域结合,并竞争性抑制了α–葡萄糖苷酶的表面疏水性与荧光探针的结合.
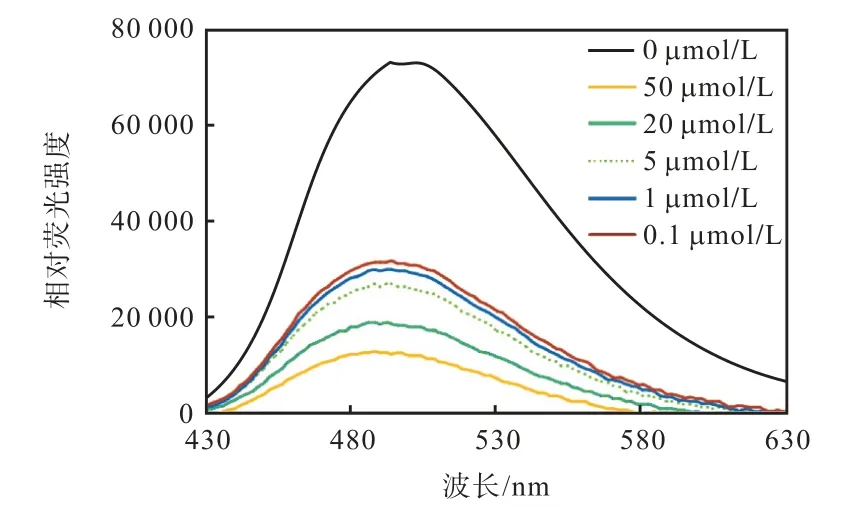
图7 不同浓度7i 对α–葡萄糖苷酶与荧光探针复合物的荧光光谱的影响Fig. 7 Fluorescence spectra of α-glucosidase-bis-ANS complex in the absence and presence of different concentrations of 7i
2.8 化合物7i抑制HepG2和3T3-L1细胞中TG和TC的积累
以HepG2 和3T3-L1 细胞为模型,进一步研究化合物7i 对脂质代谢的影响,结果如图8 所示(与模型组相比,*P<0.05,**P<0.01,***P<0.001).
诱导剂处理24 h 后细胞内TG 和TC 含量显著增加,加入不同浓度的 7i 和阳性对照洛伐他汀10µmol/L 后,HepG2 和3T3-L1 细胞中的TG 和TC水平呈剂量依赖性降低.此外,利用倒置荧光显微镜,用尼罗红和DAPI 染色也能直观地观察到HepG2的脂质含量随着7i 剂量依赖性的降低(图9).
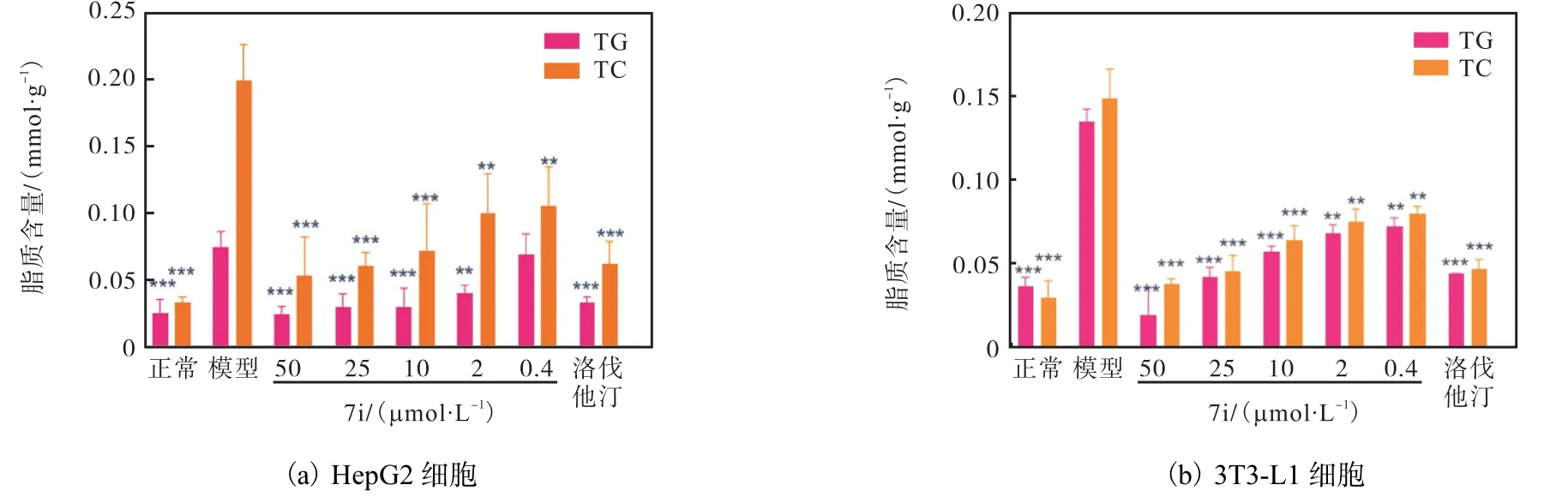
图8 化合物7i对HepG2和3T3-L1细胞的脂质代谢的影响Fig. 8 Compound 7i reduced lipid accumulation in HepG2 and 3T3-L1 cells

图9 对HepG2细胞的尼罗红和DAPI染色Fig. 9 Nile red and DAPI staining of HepG2 cells
2.9 化合物7i对AMPK通路相关蛋白的影响
由于AMPK 通路在脂质代谢过程中起着关键性作用,因此进一步测定了7i 对AMPK 通路相关蛋白表达量的影响,结果如图10 所示(与模型组相比,*P<0.05,**P<0.01,***P<0.001).以AICAR(250µmol/L)为阳性对照,实验结果表明,化合物7i 能够显著上调AMPK(Thr172)和ACC(Ser79)蛋白的磷酸化水平,与AMPK 激活剂AICAR 作用效果相似.
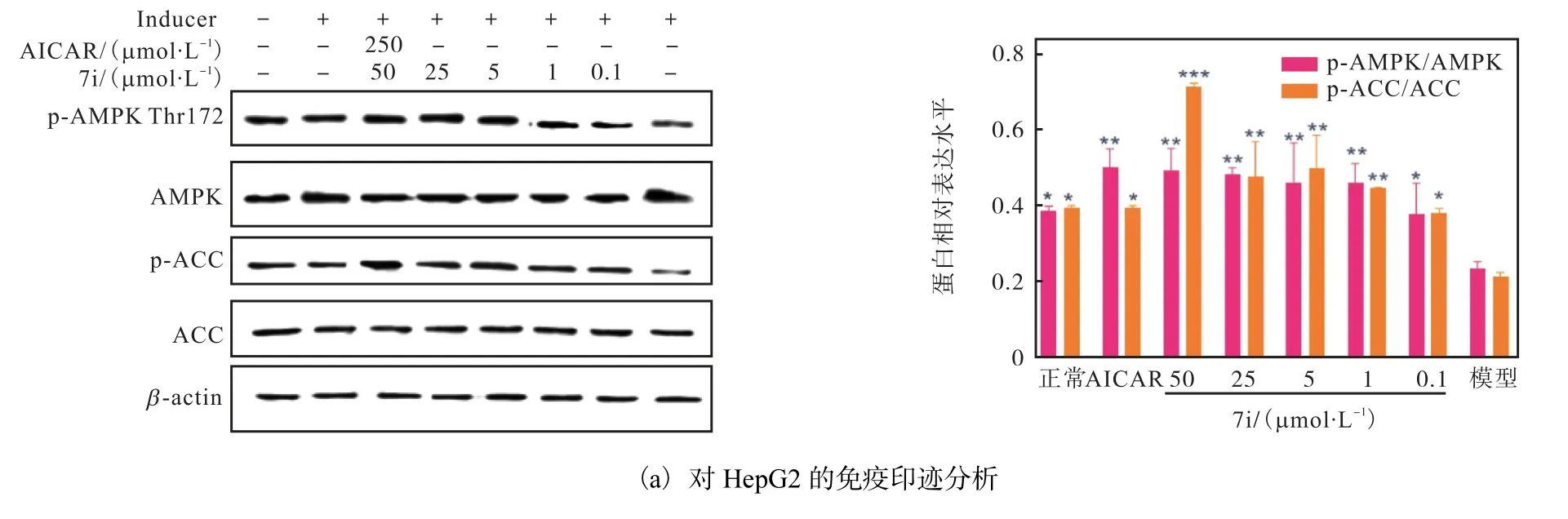
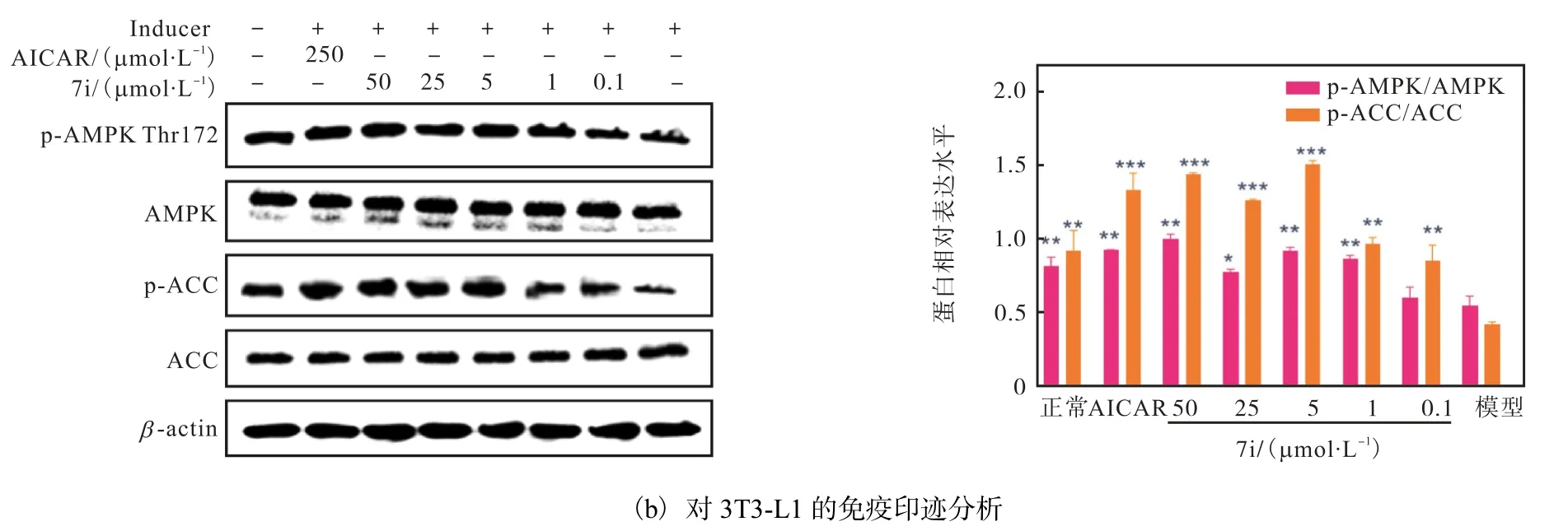
图10 化合物7i通过AMPK-ACC级联减少HepG2和3T3-L1细胞中的脂质积聚Fig. 10 Compound 7i reduces the lipid accumulation via AMPK-ACC cascade in HepG2 and 3T3-L1 cells
该结果表明,化合物7i 可能通过上调AMPK 通路中AMPK 和ACC 磷酸化而起到降脂的作用.
3 结 论
本研究评价了化合物7i 对糖尿病小鼠的体内降血糖和降血脂作用,以及体外抑制α–葡萄糖苷酶机制,细胞水平降脂活性和初步针对AMPK 通路的调节活性和机制.在糖尿病小鼠中,55 和100 mg/kg 剂量的化合物7i 显著降低餐后血糖水平,并明显改善葡萄糖耐量.化合物7i 还能明显抑制血清TC 和TG水平的升高,并改善肝脏脏器指数,使肝细胞恢复正常.化合物7i 可能与α–葡萄糖苷酶输水区域直接结合,不可逆抑制酶的活性而达到降血糖的作用.此外,7i 能够降低HepG2 和3T3-L1 细胞中TG 和TC的积累,其机制可能是通过上调AMPK 和ACC 的磷酸化水平而达到降低血脂和血糖的作用.因此,化合物7i 作为α–葡萄糖苷酶抑制剂和AMPK/ACC 信号调节剂双重调节糖脂代谢紊乱,为其发展成为新型抗糖尿病药物提供基础支持.

