PEG模拟干旱胁迫对不同抗旱性玉米品种苗期形态与生理特性的影响
杨 娟 姜阳明 周 芳 张 军 罗海登 田山君
(1贵州大学农学院,550025,贵州贵阳;2海南大学热带作物学院,570228,海南海口;3贵州医科大学药用植物功效与利用国家重点实验室,550014,贵州贵阳)
对植物而言,水是占比最大的细胞组分。水分亏缺对植物的直接影响有水势降低、叶片脱水和液压阻力等方面,并由此引发细胞膨压降低、气孔关闭、光合下降、碳分配改变、活性氧增加、膜与蛋白失稳及离子毒性积累等多种次级现象。玉米(Zea mays L.)是重要的粮饲经作物,在其生育进程中往往遭遇干旱而导致减产和降质[1-2]。为开发在干旱逆境下具有强耐受性的作物,前人对玉米响应干旱胁迫的机制进行了大量研究。如干旱胁迫会导致玉米叶片内自由基大量产生和积累,从而引发膜脂过氧化作用,细胞膜稳定性下降[3-5]。干旱也是导致植物光合能力降低的重要因素,直接影响光合机构中叶绿体的结构以及叶绿素含量,从而使光合作用减弱[6-8]。水分亏缺对细胞生长分裂和增大都有明显的抑制作用,前人研究结果表明干旱会使玉米的株高、叶面积以及干物重的增长受到显著抑制[9]。玉米响应干旱胁迫的机理之一就是迅速积累脱落酸(ABA),关闭气孔,降低蒸腾,减少或避免旱害损伤[9-10]。渗透调节是玉米适应干旱的另一种重要方式,胞内溶质主动积累,能调节并维持一定的细胞膨压,防止细胞脱水,从而保证各项生理过程能正常进行[11-13]。在干旱初期,玉米叶片的超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)活性会升高,能有效清除一定量的活性氧,避免膜脂过氧化[14]。
前人研究表明,玉米因干旱胁迫的强度不同,遭遇旱灾的生育时期不同,存在不同的响应机制。玉米苗期干旱胁迫4d后处理组的表观形态较之对照组差异显著,对胁迫3~5d的叶片进行转录组检测后发现,ZmGA2ox类基因在此期间发生显著变化[15-16]。岳桂东[17]对玉米抽雄开花期水分胁迫后第1天和第7天叶片中基因表达谱分析后发现,分别有195和1 008个基因呈现差异表达。玉米因品种特性,对干旱的响应能力也存在差异。抗旱性强的品种在水分亏缺环境中往往表现出根冠比较大、叶片保水力较强和保护酶含量较高等特性,而抗旱性弱的品种则表现出离体叶片失水速率较大、细胞膜稳定性较差和膜脂过氧化物含量较高等特点[18-21]。目前,针对玉米干旱响应机制的研究已经有不少报道,其中供试材料虽存在种间区别,但抗旱性差异却常缺乏显著性支撑;其中同一品种在不同生育阶段抵御干旱的能力也可能存在差别;且在类似研究中,缺乏对形态指标,如苗高、根长和叶面积等的逆境动态学分析[22],所以选择抗旱性有显著差异的品种,在胁迫后的多个时间点进行形态与细胞层面的关联分析,对深入探讨玉米的抗旱性机理显然更为有效。
在本试验选择的2个供试品种中,成单30在抗倒伏、抗病和产量等方面均有优良表现[23],前期针对苗期(四叶一心)的研究表明,成单30表现出强抗旱性[22]。金玉306具有高耐密植和商品性好等特点[24-25]。在种子萌发期的干旱模拟试验中,金玉306在5个胁迫强度下均表现为不抗旱,而成单30表现为强抗旱[26]。基于这些结论,本试验以成单30(强抗旱型)和金玉306(干旱敏感型)为材料,通过聚乙二醇(PEG-6000)模拟干旱逆境,分析四叶一心期水分亏缺及持续时间对玉米形态及生理特性的影响,探讨玉米苗期的抗旱机理。
1 材料与方法
1.1 试验地概况
试验地点位于贵州省贵阳市贵州大学农学院教学试验基地大棚内,地理坐标 26°25′N,106°40′E,属亚热带湿润季风气候,年平均气温15.3℃,试验时间为2017年3-4月。
1.2 试验材料
生产中大面积应用的玉米品种成单30(强抗旱型)和金玉306(干旱敏感型)。
1.3 试验方法
试验采用盆栽方式,花盆最大直径26cm,最小直径20cm,高20cm。培养基质为蛭石与珍珠岩(2∶1),每盆施复合肥10g,与基质混合均匀后装盆,基质与盆口平齐。浇透蒸馏水后播种,出苗后间苗,每盆保留健康幼苗10株,置于大棚内培养。从播种至取样期间,除处理要求外,不再进行浇灌措施,其余管理技术同普通大棚生产。本试验为三因素随机区组试验,3次重复(播种3盆)。A因素为2个品种,B因素为PEG-6000浓度,C因素为胁迫时间。设置0%(CK)、10%(T1)、20%(T2)3种PEG-6000浓度,相对应水势分别为0、–0.2和–0.6MPa[27-28],2个胁迫时间点(浇灌PEG溶液后的48和144h)。待测植株在正常浇水生长至四叶一心期后进行处理,对T1、T2处理每盆浇2L PEG-6000溶液模拟干旱胁迫,CK处理每盆浇2L蒸馏水。于浇灌溶液后的48和144h分别进行取样与测量。
1.4 取样与测定方法
每盆选取具有代表性的3株植株进行形态指标测定。用直尺测量株高;采用长宽法测定叶面积;采用排水法测定根体积。地上部干重、根重和干物重:烘箱中105℃杀青后,80℃烘干至恒重,称重;根冠比(%)=(单株根系干重/单株地上部分干重)×100。
每盆选取具有代表性的3株植株,取心叶下第一、二片叶,去除叶脉进行细胞膜稳定性(CMS)测定,CMS(%)=(1-浸泡12h后的电导率/煮沸后冷却至室温的电导率)×100。将剩余叶片及盆内剩余4株的所有叶片均去除叶脉,剪成1cm左右的叶块混匀用于其余生理指标测定。用分光光度计测定叶绿素和类胡萝卜素含量;采用硫代巴比妥酸法测定丙二醛(MDA)含量;采用蒽酮比色法测定可溶性糖含量;采用考马斯亮蓝染色法测定可溶性蛋白含量;采用磺基水杨酸法测定游离脯氨酸含量;利用索莱宝酶试剂盒测定CAT、POD和SOD活性。
1.5 数据分析
使用SPSS 25.0和Excel 2016软件分析处理数据。
2 结果与分析
2.1 不同强度干旱胁迫对玉米苗期形态指标的影响
由表1可以看出,玉米株高在10% PEG溶液胁迫时,总体呈增大的趋势;其中强抗旱品种成单30在胁迫(10% PEG)48和144h后的株高均极显著(P<0.01)高于CK,而敏感型品种金玉306在胁迫前期(48h)无显著差异,后期(144h)时显著(P<0.05)高于CK;随着PEG溶液浓度的增加,对抗性不同的2个玉米品种的株高产生不同影响,重度胁迫(20% PEG)时成单30的株高仍极显著(P<0.01)高于CK,而金玉306的株高在48h时与CK无显著差异,至144h时则显著(P<0.05)低于CK。PEG对不同玉米品种叶面积的影响存在差异,强抗旱品种成单30在不同程度胁迫(10% PEG,20% PEG)下叶面积均表现为增大趋势,其中轻度胁迫48和144h的叶面积均极显著(P<0.01)高于CK;而干旱敏感品种金玉306胁迫后的叶面积则呈现减小趋势,胁迫前期(48h)差异不显著,胁迫后期(144h)金玉306的叶面积则随干旱程度的增加而减小,与CK差异极显著(P<0.01)。10% PEG浓度促进了玉米根长增加,其中强抗旱品种成单30在胁迫前期(10% PEG,48h)的根长极显著(P<0.01)高于CK;随着PEG溶液浓度的增加,强抗旱品种成单30根长在胁迫前期(20% PEG,48h)极显著(P<0.01)高于CK,后期(20% PEG,144h)显著(P<0.05)高于CK,而干旱敏感品种金玉306的根长较CK呈现减小趋势。干旱胁迫促进强抗旱型玉米品种根体积升高,在轻度胁迫(10% PEG,48h)后,成单30根体积极显著(P<0.01)高于CK,增大胁迫强度后(20% PEG,48h),其根体积显著(P<0.05)高于CK,但随着胁迫时间的延长,根体积上升的增幅降低,胁迫144h后较CK仅增加7%。

表1 干旱胁迫下2个玉米品种的形态指标Table 1 Morphological indicators of two maize varieties under drought stress condition
综上所述,相对于地上部分而言,地下根系对干旱逆境的响应更为敏感。不同抗旱性玉米品种形态学指标适应渗透胁迫的机制存在差异,强抗旱品种在PEG胁迫下加快了营养生长进程,叶面积高于CK,而干旱敏感型品种则通过减少叶面积降低蒸腾作用,减少水分散失。对根系的研究发现,强抗旱品种在不同胁迫强度下,较CK均能保持较大的根体积;对干旱敏感品种而言,短期的干旱胁迫极显著减小了植株根体积,但随着胁迫时间的延长,处理植株的根体积逐渐恢复,甚至略高于CK,这是由于为了响应干旱逆境,对根系的同化物及能量的分配优先于地上部所造成的。
2.2 不同强度干旱胁迫对玉米苗期生物产量的影响
如表2所示,玉米经10% PEG处理后的地上部干重和干物重总体上均高于CK,其中抗旱性强的成单30轻度胁迫前期(10% PEG,48h)的地上部干重和干物重均极显著(P<0.01)高于CK,胁迫后期(10% PEG,144h)的干物重极显著(P<0.01)高于CK,地上部干重较CK增加了18%;20% PEG处理时,抗旱性强的成单30胁迫前期(48h)的地上部干重与干物重较CK分别增加了10.4%和15.7%,胁迫144h后才略微下降;而干旱敏感型品种金玉306的地上部干重在胁迫前期(20% PEG,48h)就显著(P<0.05)低于CK,干物重极显著(P<0.01)低于CK。PEG对不同玉米品种根重的影响存在差异,强抗旱品种成单30在不同程度胁迫下的根重均表现为增大趋势,其中轻度胁迫(10% PEG)48h及144h的根重均极显著(P<0.01)高于CK,重度胁迫前期(20% PEG,48h)的根重显著(P<0.05)高于CK,后期(144h)极显著(P<0.01)高于CK;而干旱敏感品种金玉306胁迫后的根重呈减小趋势,2个胁迫处理48h时均极显著(P<0.01)低于CK,直至后期(144h)才逐渐恢复,但仍低于CK。短期胁迫时,2种PEG处理的玉米植株的根冠比整体呈现增大的趋势;长期胁迫后,PEG模拟的渗透胁迫使玉米根冠比下降。

表2 干旱胁迫下2个玉米品种的单株生物产量和根冠比Table 2 Biological yields per plant of two maize varieties under drought stress condition
总体上,干旱胁迫使玉米苗期的各生物产量,地上部干重、根重、干物重及根冠比增加,随干旱程度及干旱时间的增加,各项指标在重度胁迫后期(144h)均低于CK,而在短期胁迫时,相同程度胁迫下较CK均能保持较高的根体积,说明干旱逆境在短期内对玉米生长有一定促进作用,增加了苗期植株生物量,而当根系在土壤中长期缺水时,会导致根系细胞内水分的流失,细胞质浓缩,出现空泡现象,从而造成玉米苗期在重度干旱胁迫后期生物产量下降。
2.3 不同强度干旱胁迫对玉米苗期光合色素的影响
图1A中,PEG处理后的玉米叶绿素a/b总体呈下降趋势,强抗旱品种成单30在20% PEG胁迫下表现为显著(P<0.05)下降,干旱敏感品种金玉306在48h的短期胁迫时间内,处理植株与CK无显著差异,但随胁迫时间的延长,20% PEG处理植株的叶绿素a/b同样表现为显著(P<0.05)下降。如图1B所示,PEG处理后玉米叶绿素含量总体呈现下降的趋势,成单30在20% PEG胁迫下表现为极显著(P<0.01)下降,金玉306在处理48h时,处理植株与CK无显著差异,随胁迫时间的延长,20% PEG处理植株的叶绿素含量同样表现为极显著(P<0.01)下降。经PEG处理后玉米叶片的类胡萝卜素含量呈上升趋势(图1C),其中成单30在重度胁迫前期(20% PEG,48h)时的类胡萝卜素含量显著(P<0.05)高于CK,随着胁迫时间延长,成单30在轻度(10% PEG)与重度(20% PEG)胁迫下的类胡萝卜素均显著(P<0.05)高于CK,而金玉306在胁迫前期类胡萝卜素含量的增加不显著,在胁迫后期才显著(P<0.05)高于CK。

图1 干旱胁迫下2个玉米品种的叶绿素a/b、叶绿素含量与类胡萝卜素含量Fig.1 Chlorophyll a/b, chlorophyll content and carotenoid content of two maize varieties under drought stress condition
综上所述,水分亏缺会对玉米叶片细胞内光合色素的比例及含量产生不同程度影响,总体表现为叶绿素含量下降,叶绿素a/b比值下降,类胡萝卜素含量增加。其中类胡萝卜素的显著增加是玉米适应干旱逆境的一个重要机制,类胡萝卜素对于电子解偶联等代谢失衡所产生的活性氧具有清除效应,同时某些类胡萝卜素还是ABA合成的前体,类胡萝卜素的大量合成促进ABA的迅速生成,启动了下游的信号网络以适应逆境。
2.4 不同强度干旱胁迫对玉米苗期膜脂透性的影响
如图2A中所示,不同浓度PEG处理植株在短期胁迫(48h)条件下,玉米叶片MDA含量没有出现显著变化,但随着胁迫时间的增加,不同抗性的玉米品种MDA含量的响应趋势出现了差异,强抗旱品种成单30的MDA含量与清水对照没有明显变化,但干旱敏感品种金玉306的MDA含量表现出显著性(P<0.05)增长,说明较长时间干旱胁迫后,干旱敏感品种的细胞膜过氧化程度较高。
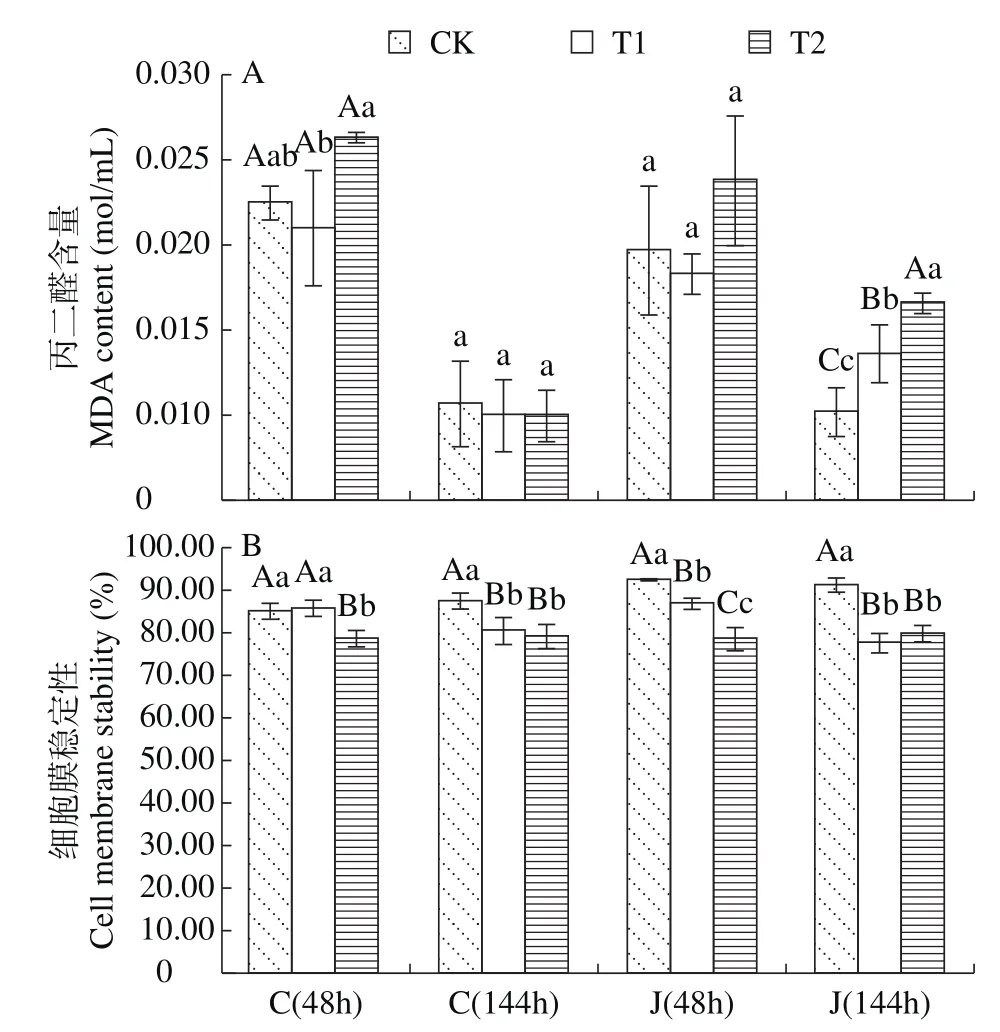
图2 干旱胁迫下2个玉米品种的MDA含量与细胞膜稳定性Fig.2 MDA content and cell membrane stability of two maize varieties under drought stress condition
干旱胁迫降低了玉米叶片细胞的稳定性(图2B)。强抗旱品种在10% PEG、48h胁迫下CMS没有明显变化,但随着胁迫浓度和时间的增长,CMS显著(P<0.05)下降。对干旱敏感品种而言,短期(48h)胁迫下,细胞膜稳定性表现出了显著(P<0.05)下降,随着胁迫时间的延长,细胞膜稳定性没有恢复,仍然表现出显著(P<0.05)下降的趋势,说明干旱胁迫对膜的伤害难以通过其余适应机制的启动而恢复,干旱逆境对细胞膜的失稳影响在一定时间内可能是不可逆的。
2.5 不同强度干旱胁迫对玉米苗期渗透调节物质的影响
如表3所示,干旱逆境下成单30的可溶性蛋白含量没有表现出显著变化,但是金玉306在遭受长期(144h)干旱胁迫后,可溶性蛋白含量出现了极显著性(P<0.01)增长。金玉306在重度胁迫(20% PEG)下,可溶性糖含量在前期(48h)显著(P<0.05)降低,在后期(144h)甚至出现极显著(P<0.01)降低的现象,但成单30的可溶性糖含量在重度胁迫(20% PEG)后较CK呈现出增长的趋势。经干旱胁迫后2个玉米品种叶片中的脯氨酸含量极显著(P<0.01)增长,且随胁迫时间的增加,较CK增加幅度逐渐增大,并且抗旱性强的成单30增加幅度大于敏感型品种金玉306。

表3 干旱胁迫下2个玉米品种可溶性蛋白含量、可溶性糖含量及脯氨酸含量Table 3 The contents of soluble protein, soluble sugar, and proline of two maize varieties under drought stress condition μg/g
综上所述,抗旱性强的玉米品种在干旱逆境中其可溶性蛋白含量变化不显著,具有较稳定的水势,而敏感型品种在长期干旱胁迫下,蛋白质不能正常降解,附着在细胞上,同时mRNA大量表达,抗逆蛋白得以大量合成以响应干旱逆境。可溶性糖的不同响应模式是造成2个品种抗旱性差异的原因之一。脯氨酸具有很强的水溶性,在干旱胁迫下作为主要渗透调节物质在细胞内大量增加,可有效清除细胞内活性氧及自由基以降低细胞渗透势。
2.6 不同强度干旱胁迫对玉米苗期保护酶类的影响
不同程度的干旱胁迫对玉米的CAT、POD和SOD保护酶活性的影响较大。如表4所示,干旱胁迫使玉米CAT、POD及SOD活性增加,其中成单30在轻度(10% PEG)及重度(20% PEG)干旱胁迫后的CAT、POD及SOD活性均极显著(P<0.01)高于CK。金玉306的POD活性在重度胁迫(20% PEG)时极显著(P<0.01)高于CK;SOD活性在重度胁迫前期(20% PEG,48h)显著(P<0.05)高于CK,随着胁迫时间延长,至144h时极显著(P<0.01)高于CK;而胁迫后的CAT活性在48h时为显著(P<0.05)增加,至144h时与CK不显著。

表4 干旱胁迫下2个玉米品种的SOD、POD及CAT活性Table 4 SOD, POD and CAT activities of two maize varieties under drought stress condition
综上所述,干旱逆境能诱导玉米体内保护酶活性提高,其中抗旱性强的品种抗氧化酶活性的增量明显高于干旱敏感型品种,使其能更有效地清除一部分活性氧,维持细胞膨压,以避免干旱胁迫对植株产生严重伤害。
3 讨论
玉米抗旱性是一个复杂的综合特性,干旱逆境下,抗旱性在不同组织和器官均有体现[29]。玉米植株的形态在生长过程中与其自身对水分的吸收和散失是密切相关的[5],其中根系作为植物直接吸收土壤水分及营养物质的重要器官,其发达程度影响着地上部的各种代谢作用及生物量的形成[30],而干旱胁迫使植株水分供应不足,致使其形态发生一定的变化。在本研究中,不同抗旱性玉米品种在苗期遭受干旱胁迫后的形态存在差异,干旱促进了抗旱性强的成单30苗期株高、叶面积、根长、根体积及其生物产量的增加,这与前人[23,31-32]研究结果一致。强抗旱品种在短期水分亏缺环境中株高、叶面积与干物重呈现上升趋势,可能是强抗旱品种具有较强的干旱防御能力,在较轻的胁迫条件下(体现为干旱胁迫持续的时间较短或强度较弱)仍能保持一定的生长势,轻度逆境引导苗期植株锻炼,促使植株生长健壮。而干旱敏感型的金玉306在逆境中的叶面积及根重均比清水对照组小,其根长、根体积、地上部干重及干物重在胁迫前期均受到抑制,随着胁迫时间的延长才逐渐恢复。说明不同抗旱性玉米品种在应对干旱胁迫时存在不同的生长响应,干旱加快了强抗旱品种的营养生长进程,使其叶面积和株高增加,根系更健壮,这种现象也被称作“干旱逃避”[33-34]。而干旱敏感型品种在株高增加的同时,通过减少叶面积以降低蒸腾面积,维持叶片水势,在干旱前期根系生长受到抑制,这期间可能是土壤缺水以及地上部分所生产的同化物及能量不能及时并足量供应地下部分所造成,而后经过一段适应时期其根系才逐渐恢复以响应干旱逆境。
干旱对玉米生长与代谢产生影响的首要环节便是光合作用,叶绿体又是吸收、传递和转换光能的主要场所,干旱胁迫会直接影响叶片中叶绿体含量,致使光合性能降低,影响植株生长发育以及产量的形成[35-37]。本研究中玉米叶片中的叶绿体a/b值随干旱胁迫程度增加而逐渐下降,这与赵小强等[38]的研究结果中有相同部分。在自然环境中干旱常伴随强光高温等因子一起出现,干旱逆境中玉米受光抑制程度随干旱程度逐渐增加而增强。类胡萝卜素作为光合作用的辅助色素,能保护叶绿素免受强光破坏的同时具有抗氧化作用[39-40]。本试验中发现干旱胁迫后玉米叶片的类胡萝卜素含量显著增加,这一结果有别于其他研究,可能是一种干旱适应机制[41]。
渗透调节是植株抵抗逆境的一种重要方式,植物通过渗透调节作用得以适应干旱逆境,可溶性糖、可溶性蛋白和脯氨酸作为重要的渗透调节物质,会在水分亏缺时主动积累以适应干旱逆境[42]。本研究中干旱胁迫后玉米叶片的脯氨酸含量均呈极显著增加,其中抗旱性强的品种的增量明显高于干旱敏感型品种。具有强水合能力且对其他细胞器不会造成伤害的脯氨酸大量增加,可能是在渗透调节中为避免高浓度无机离子进入细胞后造成的离子毒害及代谢紊乱,从而有效实现渗透调节,维持细胞正常功能。另外,本研究发现干旱逆境中不同抗性玉米品种叶片内的可溶性糖与可溶性蛋白含量的变化略有不同。干旱对抗旱性强的成单30叶片中的可溶性糖与可溶性蛋白含量的影响均不显著,而敏感型品种金玉306的可溶性糖含量在重度干旱时显著下降,可溶性蛋白含量则在干旱后显著增加。说明抗旱性强的品种在遭遇逆境时,细胞内的溶质能主动积累,参与降低植物体渗透势,利于植物体在干旱逆境下维持正常生长所需水分,而敏感型品种主要是通过合成功能性抗逆蛋白以响应干旱逆境。
干旱胁迫时植物体内会积累活性氧,植物本身对活性氧的伤害拥有完整的防御体系,SOD、POD和CAT便是其中重要的保护酶,可有效清除活性氧,以减轻水分胁迫诱导的氧化伤害[13]。本研究中,干旱胁迫后玉米叶片中的CAT、POD及SOD活性均显著增加,且抗旱性强的品种增量要大于敏感型品种,表明抗旱性强的品种在干旱胁迫下,其叶片的抗氧化能力较强,遭受活性氧的伤害较轻。并且抗旱性强的品种叶片内膜脂过氧化的最终产物MDA含量在长时间干旱胁迫后显著低于干旱敏感型品种。
当干旱程度严重时,活性氧大量积累,引发细胞膜脂过氧化,从而使细胞膜受到伤害,导致细胞膜稳定性下降及MDA含量上升[7,14]。在本研究中,玉米苗期干旱导致了干旱敏感型品种叶片中的MDA含量显著增加,而强抗旱品种增加不显著,2个品种的细胞膜稳定性随干旱程度及干旱时间的增加逐渐下降,其中抗旱性强的品种的变化幅度要小于敏感型品种,覃永媛等[12]和郭艳阳等[43]均得出相同结果。鉴于干旱逆境对细胞膜所造成的失稳影响在一定时间内可能是不可逆的,因此可以考虑将玉米叶片细胞膜稳定性对于渗透胁迫的高敏感度作为一个抗旱性的快速评价指标。
4 结论
玉米根系相较于地上部分,对干旱逆境的响应更为敏感,不同抗性的玉米品种其形态学指标适应渗透胁迫的机制存在差异,强抗旱品种在干旱逆境中加快了营养生长进程,而敏感型品种通过减少叶面积以降低蒸腾作用;与对照相比,胁迫前期玉米苗期的各生物量均增加,随胁迫程度及时间增加逐渐低于对照,说明短期干旱胁迫有利于玉米苗期生物量的增加;水分亏缺导致玉米叶片的叶绿素a/b值逐渐下降,说明干旱逆境中玉米受光抑制程度随干旱程度逐渐增加而增强;干旱逆境导致玉米叶片CMS逐渐降低,MDA含量持续增加,说明干旱造成的细胞膜失稳在一定时间内是不可逆的;强抗旱品种遭遇干旱后的渗透调节物质含量显著高于敏感型品种,说明强抗旱品种的渗透调节能力更强;其中强抗旱品种的可溶性蛋白含量随胁迫时间呈先增后减变化,而敏感型品种胁迫后显著增加,说明敏感型品种主要以合成抗逆蛋白响应干旱胁迫;干旱胁迫后玉米叶片中的抗氧化酶活性均显著升高,且强抗旱品种增量要大于敏感型品种,说明抗旱性强的品种在干旱逆境中的抗氧化能力较强,遭受活性氧的伤害较轻。

