多孔石墨相氮化碳的制备及对U(Ⅵ)的吸附机理研究
葛玉杰,吴 姣,王国华,2,周 帅,2,刘金香,2,*
(1.南华大学 土木工程学院,湖南 衡阳 421001; 2.南华大学 污染控制与资源化技术湖南省重点实验室,湖南 衡阳 421001)
近年来,随着工业的快速发展,核能作为一种清洁能源得到广泛应用。而铀矿开采以及冶炼过程中产生的一部分含铀废水不可避免地进入到环境中,铀作为一种具有放射性、毒性的核素,释放到环境中会严重威胁人类健康与生态安全[1-3]。在众多含铀废水处理方法中,吸附法[4]被认为是操作简单、经济有效的方法之一。国内外研究者对吸附材料进行了大量研究。石墨烯、金属有机骨架、有机凝胶等已被证明对铀具有较好的吸附效果,但存在材料制备繁琐、价格昂贵、性能不稳定等缺点[5-7],因此,寻找一种廉价、高效的吸附材料是含铀废水处理过程中面临的巨大挑战。
石墨相氮化碳(g-C3N4)是由含N、C两种元素的廉价前驱体热聚合而得[8],其独特的三嗪、七嗪结构使得g-C3N4具有较高的化学稳定性与热稳定性[9],另外g-C3N4含有的氨基、吡啶基团对铀的吸附去除具有重要作用,但二维层状堆叠结构使g-C3N4比表面积较小,限制了其在环境污染物吸附领域的应用[10-11]。本课题组曾采用强酸对g-C3N4进行刻蚀,增加表面的吸附位点,显著提高了g-C3N4对铀的吸附效果[12]。目前,模板法广泛用于增加g-C3N4的比表面积,如Chen等[13]利用介孔二氧化硅为模板辅助合成了介孔氮化碳,并将其用于吸附水溶液中的Cr(Ⅵ)。结果表明,介孔氮化碳的最大吸附量为48.31 mg/g,远高于活性炭和介孔炭。考虑到常用的介孔硅基模板不仅价格昂贵,而且去除模板所用的氢氟酸对环境危害较大,而碳酸钙价格低且稀盐酸无环境危害,因此,本研究拟以碳酸钙为模板剂、稀盐酸为模板去除剂,对g-C3N4进行改性,制备多孔石墨相氮化碳(PCN)材料,并考察PCN吸附U(Ⅵ)的影响因素,进而探讨其吸附机理,为含铀废水的处理提供一定的理论基础。
1 材料与方法
1.1 材料与仪器
三聚氰胺、碳酸钙、碳酸钠、硝酸钠,分析纯,国药集团化学试剂有限公司;GBW04201 U3O8标准品,国家标准物质中心,使用前将其溶解配置成1 g/L的铀溶液,其他浓度的铀溶液均由该铀溶液稀释得到;实验用水均为去离子水。
Nicolet-iS10傅里叶红外光谱(FT-IR)仪、Escalab-250Xi X射线光电子能谱(XPS)仪,美国赛默飞公司;JSM-7500F扫描电镜(SEM),JEOL公司;TristarⅡ比表面积(BET)测定仪,美国麦克公司。
1.2 PCN合成
1) g-C3N4制备
参照文献[12]采用热聚合法制备g-C3N4:取5 g 三聚氰胺置于坩埚内,并在马弗炉内550 ℃条件下煅烧3 h,所得淡黄色固体即为g-C3N4。
2) g-C3N4改性
将质量比为1∶2的碳酸钙与三聚氰胺充分混合于去离子水中,80 ℃下加热搅拌蒸干水分,将得到的固体粉末置于马弗炉内,550 ℃条件下煅烧3 h,将固体研磨并用过量的HCl溶液浸泡8 h去除CaCO3模板,即得PCN,将其离心过滤,用去离子水与无水乙醇交替洗涤至溶液呈中性,60 ℃下真空干燥10 h。
1.3 PCN对U(Ⅵ)的吸附
取50 mL所需浓度的铀溶液置于150 mL锥形瓶中,并用0.1 mol/L HNO3或NaOH溶液调节pH值,加入一定量的PCN粉末,置于恒温振荡器中在150 r/min下反应2 h,之后以7 000 r/min对反应液进行离心过滤。取10 mL上清液,采用5-二乙氨基苯酚(5-Br-PADAP)分光光度法,在波长578 nm处测定U(Ⅵ)浓度[14]。铀吸附率P(%)和平衡吸附量qe(mg/g)按下式计算:
P=(c0-ct)/c0×100%
(1)
qe=(c0-ct)V/m
(2)
式中:c0为初始U(Ⅵ)浓度,mg/L;ct为吸附时间t时的U(Ⅵ)浓度,mg/L;V为溶液体积,L;m为吸附剂用量,g。
1.4 表征
采用SEM分析样品的表观形貌;采用N2吸附-脱附法分析样品的比表面积以及孔结构;采用FT-IR测定样品吸附前后的官能团;采用XPS测定样品吸附前后的元素变化。
2 结果与讨论
2.1 PCN的表征
1) SEM分析
g-C3N4和PCN的微观形貌示于图1。可见,纯g-C3N4材料呈层状堆叠结构,表面光滑(图1a);经过模板辅助法合成的PCN表面不规则孔隙增多、层状堆叠结构明显破坏、暴露出的褶皱与突起程度增加(图1b~d),其原因是碳酸钙模板经稀盐酸洗脱去除破坏了g-C3N4的层状结构,这有利于增加更多的吸附位点。
2) N2吸附-脱附分析
g-C3N4与PCN的N2吸附-脱附曲线示于图2a。由图2a可看出:其吸附曲线为典型的Ⅳ型,且具有明显的H3型迟滞回线,说明PCN的孔隙结构很不规整。根据图2a可计算得,g-C3N4和PCN的比表面积分别为14.1 m2/g和58.5 m2/g,可见经过模板辅助合成后,PCN的比表面积显著增大,约为g-C3N4的4倍,且经模板法改性后PCN的孔隙主要为介孔结构,说明多孔石墨相氮化碳合成成功。

图1 g-C3N4(a)、PCN(b、c、d)的SEM图像Fig.1 SEM image of g-C3N4(a) and PCN(b,c,d)
2.2 PCN吸附U(Ⅵ)的影响因素
1) pH值对吸附的影响
PCN用量0.2 g/L、U(Ⅵ)初始浓度10 mg/L、反应温度298 K、反应时间2 h条件下,pH值对PCN吸附U(Ⅵ)的影响示于图3。由图3可见,pH=5时,g-C3N4与PCN对U(Ⅵ)的吸附率均达到最大,PCN对U(Ⅵ)的最大吸附率(90.2%)远高于g-C3N4(65.1%)。
为进一步探究PCN对U(Ⅵ)的吸附率随pH值变化的原因,利用MINTEQ软件模拟U(Ⅵ)在不同pH值下的存在形态,结果示于图4。由图4可见,溶液pH值较低时,U(Ⅵ)

图2 g-C3N4与PCN的N2吸附-脱附曲线(a)及孔径分布(b)Fig.2 N2 adsorption-desorption isotherm (a) and distribution of pore diameter (b) of g-C3N4 and PCN

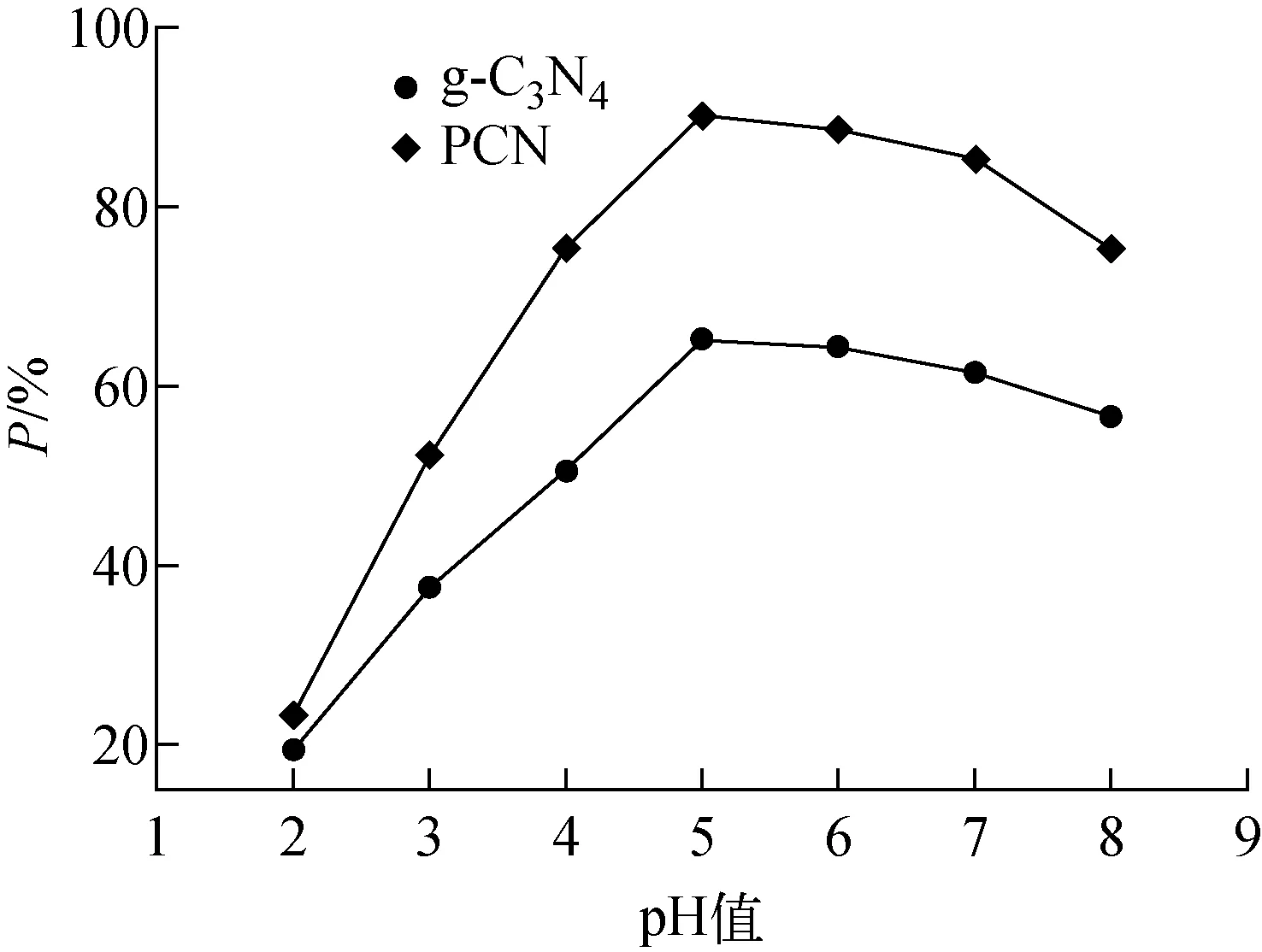
图3 初始pH值对吸附的影响Fig.3 Effect of initial pH on adsorption
2) 碳酸根与离子强度对吸附的影响


图4 不同pH值下U(Ⅵ)的形态分布Fig.4 Speciation distribution of U(Ⅵ) at different pH
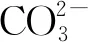
相同条件下离子强度对PCN吸附U(Ⅵ)的影响示于图6。图6表明,离子强度对PCN吸附铀的影响微弱,可认为该吸附过程属于内层表面络合,该反应方式能形成稳定的络合物,确保吸附稳定进行[15]
3) 接触时间对吸附的影响以及吸附动力学
在pH=5、PCN用量0.2 g/L、U(Ⅵ)初始浓度10 mg/L、反应温度298 K条件下,时间对吸附的影响示于图7。由图7可见,PCN对U(Ⅵ)的吸附量在前20 min内增加较快,且在20 min时达到45.35 mg/g,2 h后吸附基本平衡。原因可能是在吸附初期,PCN表面的活性位点较多,且U(Ⅵ)的浓度较高,随着吸附的进行,U(Ⅵ)的浓度逐渐降低,导致U(Ⅵ)与PCN之间的传质驱动力减小,且PCN表面活性位点逐渐减少,最终达到吸附饱和[16]。

图对PCN吸附U(Ⅵ)的影响(a)和不同pH值下与共存时U(Ⅵ)的形态分布(b)Fig.5 Effect of on U(Ⅵ) adsorption by PCN (a) and distribution of U(Ⅵ) at different pH and 0.01 mol/L (b)

图6 离子强度对吸附的影响Fig.6 Effect of ion strength on adsorption
为进一步研究PCN对铀的吸附过程,采用准一级动力学模型和准二级动力学模型对吸附过程进行拟合[17],结果示于图7,模型方程如下。

图7 时间对吸附的影响Fig.7 Effect of time on adsorption
准一级动力学模型:
qt=qe[1-exp(-k1t)]
(3)
准二级动力学模型:
qt=k2qet2/(1+k2qet)
(4)
式中:k1为准一级动力学模型速率常数,min-1;k2为准二级动力学模型速率常数,mg·min;qt为t时刻的吸附量,mg/g。
准一级动力学与准二级动力学模型的拟合参数列于表1。由表1可知,准二级动力学模型能更好地拟合PCN对U(Ⅵ)的吸附过程,且准二级动力学模型拟合得到的平衡吸附量与实际平衡吸附量更接近,说明PCN对U(Ⅵ)的吸附主要以化学吸附为主导[18]。
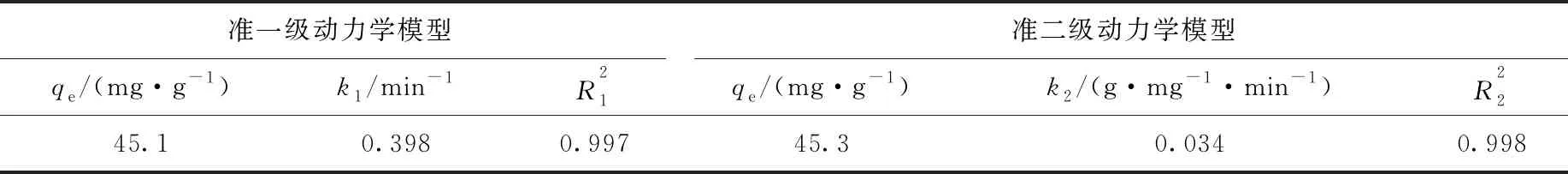
表1 PCN吸附U(Ⅵ)的动力学参数Table 1 Kinetic parameter of U(Ⅵ) adsorption by PCN
4) 等温吸附
在pH=5、PCN用量0.2 g/L、吸附时间2 h,不同温度(293、298、303 K)及不同U(Ⅵ)初始浓度(10~70 mg/L)下,PCN对U(Ⅵ)的吸附等温线示于图8。由图8可见, PCN对U(Ⅵ)的平衡吸附量随温度的升高而明显提升,说明升高温度可促进U(Ⅵ)的吸附。此外,PCN对铀的平衡吸附量先增加,后逐渐趋于平衡,这是因为PCN表面的活性位点在较高浓度的U(Ⅵ)溶液中达到了吸附饱和状态。利用Langmuir等温吸附模型和Freundlich等温吸附模型对吸附过程进行拟合,拟合方程式[19]如下:
qe=qmaxkbce/(1+kbce)
(5)
(6)
式中:qmax为最大吸附量,mg/g;ce为吸附平衡时的铀浓度;kb为Langmuir吸附常数;n为无量纲常数;kf为Freundlich吸附常数。
吸附等温线的拟合参数列于表2。由表2可见,Langmuir模型具有较高的相关系数,拟合效果优于Freundlich模型,说明PCN对U(Ⅵ)吸附过程为单层吸附[20],即该模型假设在平衡状态下,U(Ⅵ)的单分子层吸附发生在固定数量、均匀分布的PCN吸附位点上,且通过Langmuir模型拟合出的PCN对U(Ⅵ)的最大吸附量为92 mg/g;另外,kb与1/n均为评价吸附系统是否有利进行的指标,由表2可见,其值均介于0~1之间,说明PCN对U(Ⅵ)具有良好的吸附作用[21]。
2.3 吸附U(Ⅵ)后PCN的表征分析
1) SEM
PCN吸附U(Ⅵ)前后的微观形貌示于图9。从图9b可清楚观察到铀酰离子沉积在材料表面。吸附U(Ⅵ)后,PCN表面的大部分孔隙与褶皱被填满,对比图9a、b可看出,U(Ⅵ)在褶皱与突起处的吸附情况明显优于光滑表面处,这也说明表面孔隙增加、比表面积增大能增加PCN的活性吸附位点,从而增强g-C3N4对U(Ⅵ)的吸附能力。

图8 PCN对U(Ⅵ)的吸附等温线 Fig.8 Adsorption isotherm of U(Ⅵ) by PCN

表2 PCN对U(Ⅵ)的吸附等温线拟合参数Table 2 Fitting parameter of adsorption isotherm of U(Ⅵ) on PCN

图9 PCN吸附U(Ⅵ)前(a)后(b)的SEM图像Fig.9 SEM image of PCN before (a) and after (b) adsorption of U(Ⅵ)
2) FT-IR

图10 PCN吸附U(Ⅵ)前后的FT-IR谱Fig.10 FT-IR spectra of before and after adsorption of U(Ⅵ) by PCN

3) XPS


图11 PCN 吸附前后的C 1s 和N 1s的XPS谱Fig.11 XPS spectra of C 1s and N 1s before and after U(Ⅵ) adsorption by PCN
3 结论
采用模板辅助的热聚合法合成多孔石墨相氮化碳,通过研究不同条件下PCN对U(Ⅵ)的吸附,得到以下结论。
1) 在初始pH=5、PCN用量0.2 g/L、接触时间2 h、反应温度303 K条件下,PCN对U(Ⅵ)的最大吸附量为92 mg/g,且升高温度有利于吸附反应的进行。
2) 吸附动力学结果表明,准二级动力学模型能更好地拟合整个吸附过程,说明吸附过程为化学吸附;吸附热力学结果表明,Langmuir等温吸附模型能更好地拟合PCN吸附U(Ⅵ)的过程,说明吸附是在PCN表面的单分子层吸附。
3) SEM、FT-IR、XPS分析结果表明,U(Ⅵ)被成功地吸附在PCN上,其吸附机理主要包括氨基、吡啶等含氮基团与U(Ⅵ)之间的络合作用及静电吸附。

