部分弧形调强伴SIB治疗肝细胞性肝癌的安全性及其疗效影响因素研究*
郑振华,吕元博,翁裕杰,黄咏宁,张皓然,王笑良△
(1.厦门长庚医院放射治疗科,福建 厦门 361026;2.厦门长庚医院消化科,福建 厦门 361026)
肝细胞性肝癌是常见消化道恶性肿瘤,在全球恶性肿瘤发病率中排名第6,全球恶性肿瘤致死率中排名第4[1]。全球肝癌的长期生存率偏低,为4.7%~32.8%[2];手术为早期肝癌首选治疗方式,但因肝癌起病隐匿,70%~80%的患者确诊时已经为中晚期,失去了手术机会。2020年美国国立综合癌症网络(NNCCN)指南指出,对于不可手术切除或无法耐受手术的肝癌患者,可将射频消融(RFA)/肝癌动脉灌注化疗栓塞治疗(TACE)作为首选治疗,推荐放疗作为治疗手段之一。本研究分析厦门长庚医院利用部分弧形调强伴局部同期推量(SIB)技术的安全性及其疗效影响因素,现报道如下。
1 资料与方法
1.1一般资料 选取厦门长庚医院2011-2020年利用部分弧形调强伴SIB技术治疗的肝癌患者共44例,共50个病灶(部分患者多次治疗)。所有患者均明确诊断为肝细胞性肝癌:病理活检明确,或治疗前甲胎蛋白(AFP)升高超过400 U/L以上和(或)至少2项影像学检查支持肝癌的临床诊断。纳入患者中,男39例,女5例;年龄31~86岁,平均年龄54.5岁;治疗前美国东部肿瘤协作组(ECOG)评分;8例为1分,35例为2分,1例为3分;治疗前巴塞罗那分期(BCLC);8例为B期,29例为C期,7例为D期;治疗前Child-Pugh评分;15例为A级,28例为B级,1例为C级;治疗前出现门静脉侵犯21例,无门静脉侵犯23例;治疗病灶体积为2.1~4 714.9 cm3。放射治疗前后1个月内接受其他治疗手段;18例为TACE(同一部位),7例为肝动脉灌注化疗(HAIC),1例为全身化疗,8例为靶向药物治疗(索拉菲尼)。见表1。
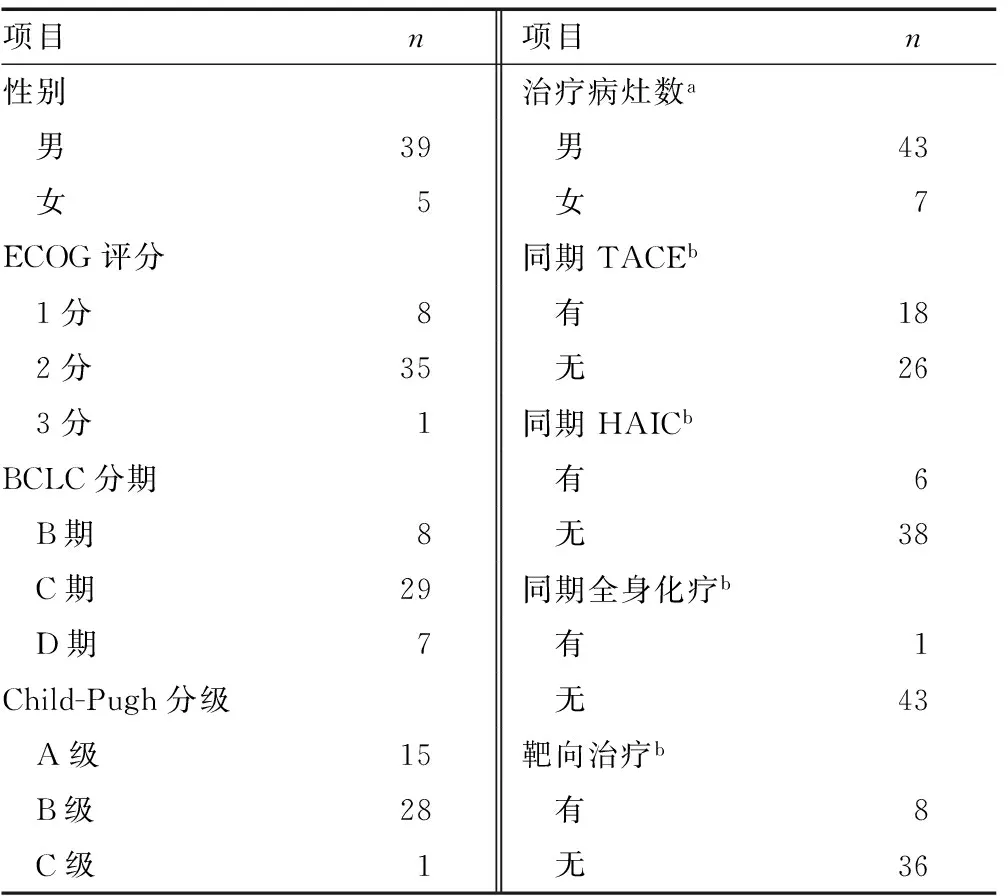
表1 患者一般资料
1.2方法
1.2.1放疗方法 所有患者均采用VARIAN CLINAC IX型号直线加速器,射线采用6 MVe射线;均采用部分弧形旋转调强方式进行治疗。其中,部分弧形调强放射治疗是弧形调强/容积调强技术的一种应用,进行计划设计时,根据肿瘤大小、位置情况调整加速器球管出数的起始角度及终止角度,尽量使放疗剂量局限于肿瘤区域,正常肝区域无剂量或较少剂量,进而降低常规弧形调强所致的正常肝低剂量区。所有治疗患者均行增强计算机断层扫描(CT)扫描定位,初次治疗采用锥型束CT(CBCT)对位,后续每天行OBI对位;靶区勾画由1~2名主治医师勾画,并由1~2名主任医师审核。靶区勾画原则为:肿瘤靶区(GTV)为影像可见肿瘤,包括肝癌病灶和(或)门静脉癌栓,计划靶区(PTV)为GTV外扩5 mm,无临床靶区(CTV)。行SIB并定义推量总剂量为GTV-SIB,推量原则为通过GTV外径内缩大于或等于5 mm距离,且预估正常肝受量和其他邻近危及器官在可耐受情况下确定SIB治疗靶区,再通过模拟计划评估正常肝受量后确定推量区域。所有患者可测量治疗病灶最大径线为1.3~18.6 cm,平均6.8 cm;治疗病灶体积为9.4~3 075.9 cm3。分割剂量为2.0~8.0 Gy,分割次数为6~30 fx,GTV剂量为24~64 Gy;推量单次分割剂量为2.75~12.00 Gy,推量分割次数与处方分割次数一致(同步SIB),GTV-SIB为35~72 Gy。正常肝组织限量条件为:至少600 cm3的正常肝脏受量小于15 Gy,全部正常肝组织平均受量小于30 Gy。根据L-Q模式公式,生物等效剂量(BED)=推量区域总剂量×[1+分割剂量/(肝癌细胞α/β)],其中肝癌细胞α/β取值11.2 Gy。见表2。
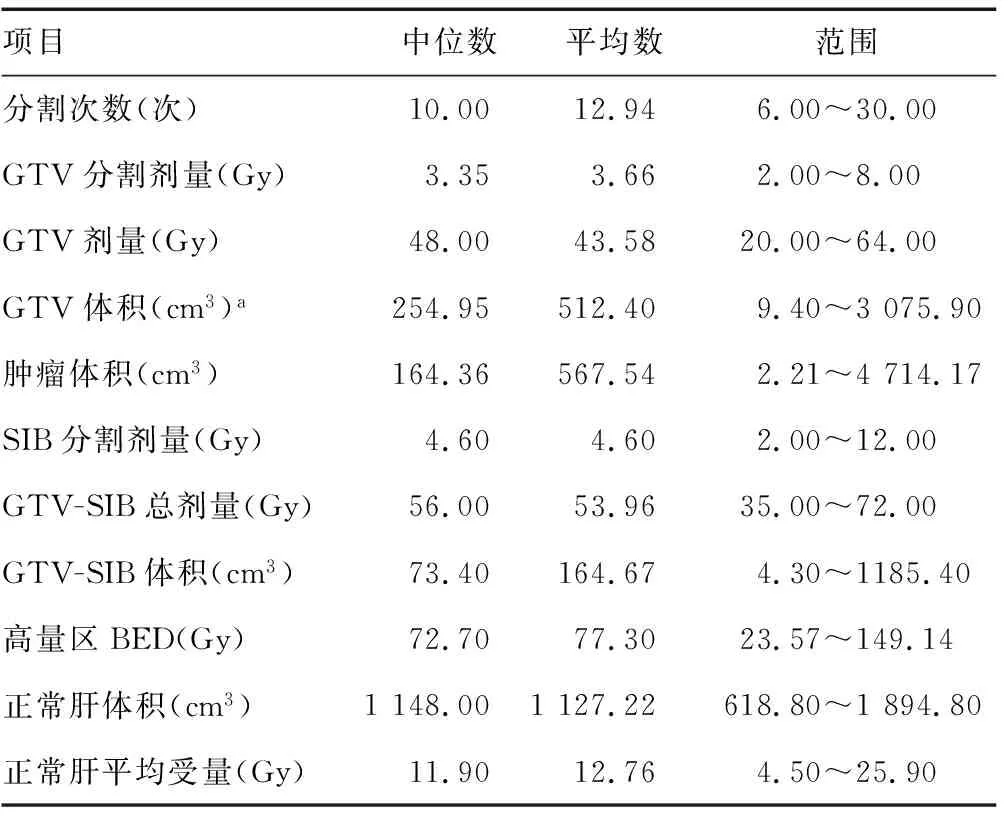
表2 放疗基本资料
1.2.2疗效评价 根据实体肿瘤近期疗效评价标准(RECIST1.1版)评价治疗病灶:完全缓解(CR):肿瘤完全消失并维持4周;部分缓解(PR):肿瘤瘤体缩小达30%并维持4周;进展(PD):增加20%或病灶增加前非CR、PR、稳定(SD);SD:非PR/PD[3]。肿瘤缩小或无增大则评定为无PD,增大则评估为PD。
1.2.3放射不良反应评估 根据皮肤/黏膜急性放射损伤分级标准(RTOG/EORTC)评价放疗毒性反应。放疗前后行CT或磁共振成像(MRI)评估病灶状态及大小;治疗前,治疗中,治疗后1、2、4、8、12周检测肝功能、胆红素、AFP等指标;根据急性放射性肝损伤(RILD)评价标准评估是否出现RILD。
2 结 果
2.1治疗状况 44例病例全部完成治疗;随访时间为1~33个月,平均随访时间13.24个月,中位随访时间12个月。
2.2放疗不良反应评估 放疗后部分患者出现恶心、呕吐、腹胀等不适;有部分患者放疗前已经出现肝功能异常,但治疗后未出现新增腹腔积液或肝功能指标升高超过治疗前2倍的患者;未出现放疗后因放疗不良反应而二次住院的患者。见表3。
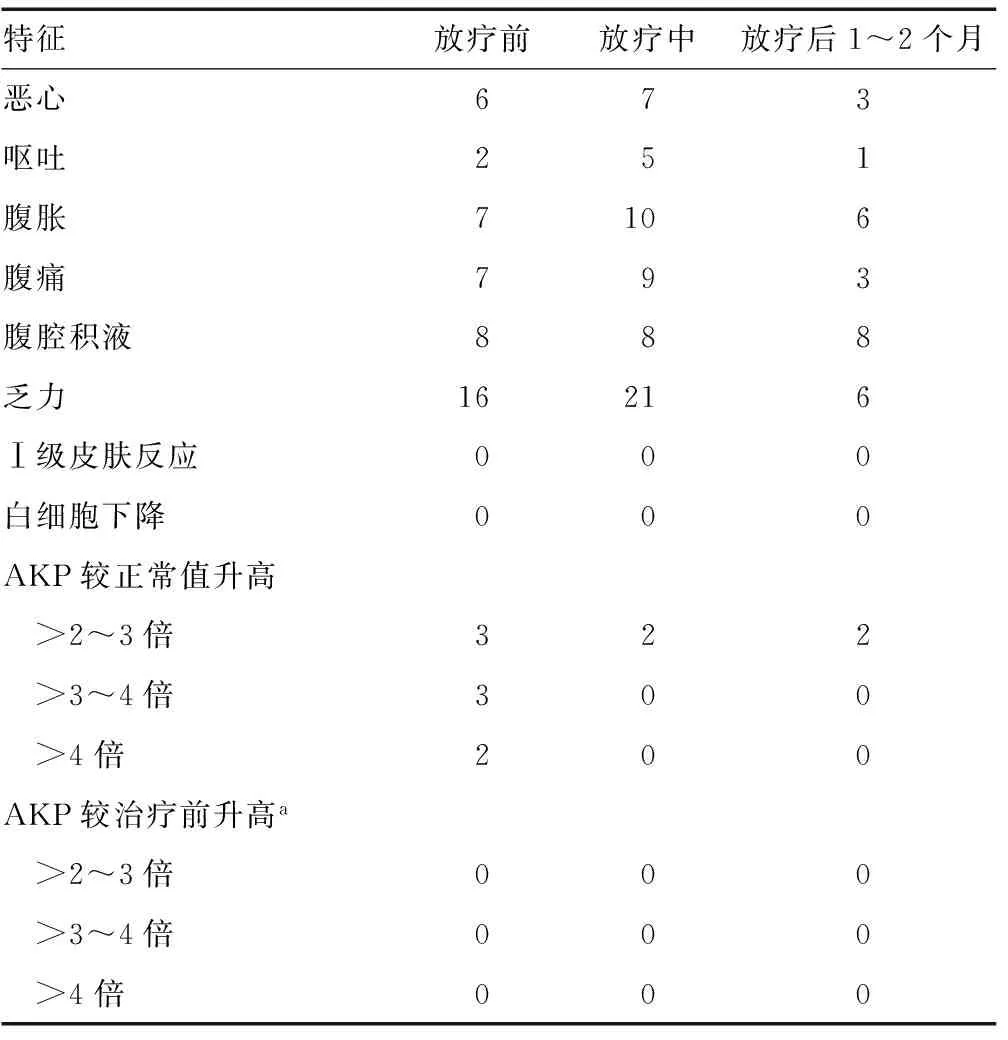
表3 放疗不良反应情况(n)
2.3总体局部控制率 总共评价治疗病灶50个,放疗开始时间至影像学提示治疗病灶PD,随访终点设置为死亡或者肿瘤PD时间。总体局部控制率:6个月为82.8%,1年为74.9%,2年为66.6%,3年为55.5%。见图1。

图1 总体局部控制率
2.4总体生存率 所有治疗病例均完成治疗。随访时间为1~38个月,平均随访时间10.54个月,中位随访时间6个月。至随访终点,生存19例,死亡20例,失联5例(失联视作死亡)。总体生存率:6个月为67.1%,1年为43.6%,2年为30.0%。见图2。

图2 总生存率
2.5不同BED临床资料比较 将靶区内高剂量区BED作为连续变量,评估其对预后的影响,根据中位BED将患者分为2组,分离患者基本信息及接受其他治疗情况,2组患者的基础数据比较差异均无统计学意义(P>0.05)。见表4。根据生物等效剂量的中位数BED(72.7 Gy)进行分组,较高剂量组为BED≥72.7 Gy,较低剂量组为BED<72.7 Gy,较高剂量组局部控制率优于较低剂量组[2年局部控制率:88.4%vs.47.1%,置信区间(CI)为20.663~31.607,P=0.02];总体生存率优于较低剂量组(1年总体生存率:74.4%vs.39.1%,2年总体生存率:49.6%vs.11.2%,CI为11.284~19.569,P=0.01)。
表4 不同BED临床资料比较
3 讨 论
放射治疗是恶性肿瘤局部治疗的一个重要手段,在肝癌治疗中的主要限制因素为放疗后可能导致的RILD。因此,放疗后RILD发生率成为评估放疗安全性的重要指标。
RILD是由放射治疗导致的一种临床亚急性、慢性肝脏损伤,有典型与非典型2种[4-6]。典型RILD患者可出现非癌性腹腔积液、肝脏肿大和AKP超过正常或治疗前2倍,其他肝酶不成比例升高等症状;非典型RILD患者可表现为黄疸、血清转氨酶至少超过正常或治疗前5倍,且影像学上提示肿瘤无PD。
RILD的发生与治疗前患者的Child-Pugh评分、肝功能状况及残留正常肝组织受量、体积相关,其中放疗前Child-Pugh评分是RILD的独立影响因素,Child-Pugh B级患者相对于Child-Pugh A级患者更容易出现RILD[7-10]。因此,对于放疗前肝功能状况较差的患者,制定放疗计划时需要更加谨慎,马虹等[11]建议,Child-Pugh A级患者肝脏平均耐受量23 Gy,V30<28%,V40<20%,而Child-Pugh B级的患者肝脏平均耐受量为6 Gy。DAWSON等[12]对203例肝适形放疗并肝动脉化疗的患者进行了前瞻性随访,发现正常肝体积及受量会影响RILD发生率,正常肝脏耐受平均剂量低于31 Gy时,未发现RILD病例;全肝照射下,TD50=43 Gy;TD5=31 Gy。于金明等[13]研究结果显示,常规剂量分割全肝照射剂量小于35 Gy者,未发生放射性肝炎;剂量大于或等于35 Gy者,放射性肝炎发生率急剧上升,达40%以上。我国肝癌患者因其起病隐匿,发病时往往为巨块型肝癌,Child-Pugh分期以B期及以上多见,因此,限制患者残余正常肝组织受量对控制RILD的发生有极其重要的意义。本研究结果表明,患者正常肝组织限量要求为:至少600 cm3的正常肝脏受量小于15 Gy,全部正常肝组织平均受量小于30 Gy。实际所有治疗病例正常肝脏受量为4.5~25.9 Gy,平均受量11.9 Gy;实际受量情况低于一般文献所述的危险阈值,理论上在此限量要求下RILD发生率较低。
本研究收集了所有治疗患者的治疗前,治疗中,治疗后1、2、4、8、12周的肝功能指标(谷丙转氨酶、谷草转氨酶、γ-谷氨酰转肽酶、AKP、血清总胆红素、血清直接胆红素)以评估RILD发生状况;部分患者治疗前已经出现转氨酶升高或者黄疸等肝功能损伤表现,治疗前AKP升高超过正常值2倍为3例,超过正常值3倍为2例,超过正常值5倍为2例,治疗后未出现患者AKP继续升高情况;治疗8周后,2例患者较治疗前降低,但仍高于正常值2倍。治疗后未新增转氨酶较治疗前升高且超过治疗前2倍患者,未出现新增黄疸患者,未出现新发肿瘤性腹腔积液患者。综合临床资料,评估未出现RILD。部分患者治疗期间有新增恶心、呕吐、腹胀、腹痛等消化道反应,通过常规对症处理,可改善上述症状。未见明显的放射性皮炎发生,未见Ⅲ度以上骨髓抑制出现。因此,在上述正常肝限量要求下,进行部分弧形调强伴SIB的肝癌放射治疗是安全的,而部分弧形调强伴SIB方式有利于实现上述正常肝限量要求。
肝癌放射治疗效果与放射治疗剂量明确相关,但是关于肝细胞性肝癌放疗的最佳剂量和分割方式目前尚无定论。XI等[14]通过回顾性研究发现,无论采用何种方式进行放疗,治疗的总剂量与预后呈正相关。JANG等[15]发现,利用立体定向放疗(SBRT)治疗肝细胞性肝癌,提高放疗剂量可以使局部控制率与总体生存率升高。韩国1项多中心试验结果显示,BED>53.1 Gy是局部控制率及预后的重要影响因素[16],提高肝癌放疗靶区内的剂量及BED对于提高局部控制率及生存率有正向意义。但是,临床实践中肝癌起病隐匿,患者发现时往往肿块巨大,残存正常肝组织较少,大体积的高剂量照射容易导致RILD出现。本研究设想利用部分弧形调强伴SIB,减少残余正常肝组织受量,并采用单次剂量提高,缩减分割次数方式,以有效提高靶区推量区域内的BED,进而提高疗效。国际上也有类似的研究结果,TAO等[17]利用靶区内SIB方式治疗肝胆管细胞癌,结果显示接受BED>80.5 Gy(高剂量组)患者3年总体生存率为73%,而接受BED≤80.5 Gy(低剂量组)患者3年总体生存率为38%,2组比较差异有统计学意义(P=0.017);高剂量组患者3年局部控制率明显高于低剂量组,差异有统计学意义(P=0.04);作为连续变量的BED明显影响局部控制率(P=0.009)和总体生存率(P=0.004);没有治疗相关毒性。本研究以中位BED(72.7 Gy)进行分组,并将2组患者的一般状况及其他治疗方式进行对照,2组患者一般资料比较差异均无统计学意义,但较高剂量组(BED≥72.7 Gy)的局部控制率及总体生存率优于较低剂量组(BED<72.7 Gy),差异均有统计学意义(P<0.05),提示进行SIB来提高推量靶区内的BED,有利于提高局部控制率及总体生存率,对于制定巨块型肝癌的放疗策略有一定的积极参考意义。
综上所述,部分弧形调强伴SIB治疗肝细胞性肝癌的安全条件为“至少600 cm3的正常肝脏受量小于15 Gy,全部正常肝组织平均受量小于30 Gy”;所有病例均未出现RILD,未出现Ⅲ度以上放疗急性反应;放疗靶区内BED提高,可改善局部控制率及总体生存率。基于样本量限制,本研究无法进一步评估推量靶区外围较低剂量区是否容易导致肿瘤边缘残留,进而影响到局部控制率及总体生存率。因此,作者会在后续的前瞻性研究中固定部分弧形调强伴SIB的分割方式及缩野范围,并综合其他治疗手段,以进一步评估更佳的治疗策略。

