氯乙烯单体合成催化剂研究进展
鲍玉香,马宏飞,脱永笑,祁艳颖,冯翔,杨朝合,陈德,
(1 中国石油大学(华东)化学工程学院,山东青岛266580;2 Department of Chemical Engineering,Norwegian University of Science and Technology,Trondheim 7491,Norway)
聚氯乙烯(PVC)的需求量快速增长导致其氯乙烯单体(VCM)成为重要化学品,在化工、建筑、日常生活等方面具有广泛的应用[1-3]。2019年,全球VCM产能约为4900万吨,预计2026年将增至超过5600万吨[4]。目前,VCM的工业合成工艺主要包括乙烯法和乙炔法。其中,西方国家富油贫煤的国情和先进成熟的轻油裂解工艺使其拥有充足的乙烯资源,决定了其主要依赖于乙烯法生产VCM,即以乙烯(C2H4)、O2、Cl2为原料生产VCM。在催化剂的作用下,C2H4通过直接氯化或氧氯化反应得到1,2-二氯乙烷(EDC),然后EDC 通过热裂解作用(裂解温度约500℃)脱去HCl 以制备VCM。更重要的是,脱去的HCl可以继续参与前一步乙烯氧氯化反应,组成“平衡氧氯化工艺”。目前由于全球90%以上的VCM 生产工厂都在使用平衡氧氯化VCM 工艺,因此,乙烯路线在这些技术中占主导地位并受到广泛关注[5-6]。在各类催化剂中,CuCl2催化活性和选择性较高,成为工业上乙烯氧氯化工艺制VCM 普遍使用的催化剂。然而,随着反应的进行,Cu粒子的严重聚集将导致催化剂逐渐失活,同时,EDC 裂解所需要的高温造成严重的能耗问题。近年来,为了改善催化剂的活性,降低EDC裂解温度,科研工作者提出了一系列策略,比如采取金属掺杂、开发碳基非金属催化剂、开发双功能催化剂等。
在中国,富煤贫油的国情、充足的电石资源以及传统的煤化工技术路线决定了我国主要采用乙炔法制备VCM,即以乙炔(C2H2)和HCl为原料,在HgCl2催化剂作用下,经过亲电加成反应得到VCM[7-11]。目前,该反应广泛使用活性炭负载氯化汞(HgCl2/AC)催化剂,而有毒有害的HgCl2在工业固定床反应器中由于热点(>200℃)而导致活性组分的升华和损失。2013 年,联合国环境署(UNEP)表决通过了旨在控制和减少全球汞排放的《水俣公约》,到2020 年,每单位生产的汞使用量应比2010年减少50%[12]。因此,对含汞催化剂的依赖一直是制约乙炔法制PVC 工业发展的瓶颈,用无汞催化剂替代HgCl2催化剂可以有效解决绿色化学瓶颈。经过科研工作者数年的努力,无汞催化剂虽然还未被大规模商业化应用,但从贵金属催化剂到非贵金属催化剂和碳基非金属的开发也取得了一定的进展。本文重点综述了国内外关于贵金属催化剂、非贵金属催化剂和碳基非金属催化剂在基于乙烯法、乙炔法的VCM合成方面的最新研究进展。
1 乙烯法制VCM
1.1 平衡法制VCM
目前,工业上主要采用平衡法,包括三个过程制取VCM:首先,EDC 可以由C2H4与Cl2反应生成[式(1)];其次,EDC 可以由C2H4与HCl和O2反应生成[式(2)];最后,EDC 热裂解(热解温度450~550℃)得到VCM 和HCl [式(3)],该HCl 将循环用于乙烯的氧氯化反应[式(2)]。最终,整个工艺过程既不产生HCl 也不消耗HCl,有效解决了HCl 的利用问题[式(4)]。

1971 年美国专利首次报道,负载在γ-Al2O3上的CuCl2催化剂(CuCl2/γ-Al2O3)在乙烯氧氯化反应过程中,乙烯的转化率高达98.8%,EDC的选择性高达97.0%,表现了出色的催化性能[13]。随着有关乙烯氧氯化反应高效催化剂研究的不断深入,科研工作者开发了多种催化剂,例如RuO2、镧系金属氯化物及镧系金属氧氯化物等[14-16]。在各种催化剂中,负载在γ-Al2O3上的氯化铜(CuCl2/γ-Al2O3)因活性高、选择性好而被认为是乙烯氧氯化反应的优良催化剂,并且已在工业合成上得到大规模使用[17-18]。在此过程中,CuCl2经历了还原、氧化和氢氯化再生的氧化还原循环,在反应体系中Cu 可以氯化亚铜(CuCl)的形式存在。由于CuCl 易挥发的特性及氧氯化反应的高放热性,催化剂活性组分严重流失、颗粒黏性增加,进一步导致催化剂的失活[19]。因此,进一步了解氧化还原反应的表面反应机理、氧化还原反应动力学、活性位点、载体和促进剂的作用,并提高催化活性、选择性,尤其是稳定性,已成为国内外研究的热点。研究者们通过加入碱金属(Li、Na、K)、碱土金属(Mg、Ca)和稀土金属(La、Ce)等添加剂,有效优化了催化剂的稳定性,但CuCl2仍易出现挥发和颗粒团聚的现象[17-18,20-22]。因此,解决Cu 催化剂稳定性差的问题是VCM合成的关键。
近期,本文作者研究团队采用原位紫外-可见-近红外反射光谱(UV-vis-NIR)耦合在线质谱(MS)分析对乙烯氧氯化氧化还原循环进行了系统地研究,揭示了CuCl2/γ-Al2O3中单助剂[23-24]和双助剂[25]对乙烯氧氯化反应的影响。在氧化还原过程中,利用UV-vis-NIR 可以得到CuCl2催化剂中Cu2+的活性位点浓度随时间的动态变化关系,Cu2+的浓度取决于还原和氧化过程的相对速率。将CuCl2的还原反应速度、CuCl 的氧化反应速度同CuCl2的浓度进行作图(如图1),图中还原反应和氧化反应曲线的交叉点代表两者反应速度相同,即稳态反应速度下Cu2+的浓度。图1 中(a)是Cu5.0的氧化和还原反应速率随浓度的变化关系,以及代表理想催化剂的理论氧化速率随浓度的变化关系;(b)、(c)分别是添加了K 和Ce 作为助剂的催化剂的氧化还原反应速率示意图。通过对比交点处所对应的Cu2+的浓度,Cu5.0中Cu2+的浓度约为0.56mol/molCu,添加K 和Ce 的Cu2+的 浓 度 分 别 为0.93mol/molCu和0.68mol/molCu。因此,添加K 可以大大提高CuCl 氧化的反应速率,降低CuCl2的还原速率,也说明该反应的决速步骤由CuCl的氧化反应转变为CuCl2的还原反应。利用此方法可以通过调整还原、氧化反应的相对速度来改变稳态反应状态下的反应速率和催化剂活性组分的含量,进而对催化剂进行合理设计[26]。
考虑到EDC高温热裂解带来的严重能耗问题,近年来,科研工作者开发了碳基非金属催化剂,并实现远低于气相裂解温度下催化裂解EDC制VCM。众所周知,氮掺杂碳材料是能源储存、催化、生物医药等领域的研究热点[27-29],但作为催化剂应用于乙烯法制VCM 的研究相对较少,因此,碳基非金属催化剂催化制备VCM 具有重要的研究价值。例如,张涛院士等[30]合成了一种氮掺杂有序介孔碳材料(N-OMCs),用于催化EDC 的脱HCl 制VCM。催化活性测试表明,制备的N-OMCs 对EDC 的催化脱HCl反应在72h内表现出优异的催化性能和良好的稳定性。天津大学李教授[31]通过三聚氰胺处理载体制备了氮掺杂碳材料,在250℃条件下反应180h后EDC转化率可以保持在85.1%。这些已报道的结果表明,采用氮掺杂碳催化剂可以大大降低EDC脱HCl反应的反应温度,但积炭的生成易导致催化剂失活[32-33]。因此,在EDC 脱HCl 反应过程中,开发一种有效的工艺提高催化剂的抗积炭能力显得尤为重要。

图1 助剂对Cu5.0催化剂性能的影响[26]
1.2 一步法制VCM
在工业生产中,VCM 合成工艺的最大局限性在于Cu 催化剂的低稳定性、单程转化率有限和热裂解的高能量需求等。尽管可以通过加入碱(Na、K)金属、碱土(Mg、Ca)金属等添加剂来优化催化剂的稳定性,但CuCl2仍然会出现易挥发和颗粒团聚的问题。将乙烯氧氯化和脱氢氯化反应集成为一步反应,可以提高VCM 的收率,这需要开发一种新型多功能催化剂,即在同一催化剂表面上,兼具催化乙烯氧氯化生成EDC 的氧化还原位点和催化EDC 脱HCl 生成VCM 的酸位点,提高C2H4转化率,降低EDC裂解所需要的能耗。
目前,一步法制备VCM 的挑战主要是EDC 的裂解反应需要高温高压的反应条件,而第一步的乙烯氧氯化常采用低温低压。多步反应整合到一起需要考虑以下几点:①高温条件下乙烯氧氯化催化剂的稳定性;②低温条件下裂解反应速率;③在较低温度下热力学控制的EDC 的裂解反应的转化率。针对上述问题,研究者们取得了一定的研究结果。
1.2.1 Ce基催化剂
如上所述,随着工业生产反应温度的升高,Cu 基催化剂的活性组分逐渐流失,导致催化剂稳定性逐渐降低,利用金属掺杂虽然在一定程度上提高了Cu基催化剂的稳定性,但仍不明显。近年来,将乙烯氧氯化反应和脱HCl 反应集成为一步过程,既可以提高乙烯转化率,又能够催化两步反应[34]。例如,Pérez-Ramírez课题组[14]开发了双功能二氧化铈(CeO2)催化剂,如图2所示。CeO2的双功能化特性体现在,一是本身的氧化还原中心可以催化乙烯氧氯化生成EDC,二是在氧氯化条件下CeO2表面可以在原位生成的强酸位点上发生EDC脱HCl生成VCM。催化活性测试表明,CeO2催化乙烯氧氯化反应一步制VCM 的收率高达25%。CeO2的使用优化了目前VCM生产中的两步工艺,包括CuCl2催化的氧氯化和EDC 裂解。此外,等温和温度循环实验证明了CeO2具有良好的稳定性,测试过程中既没有出现活性损失,也没有出现材料降解。与典型的CuCl2催化剂相比,Ce基催化剂具有稳定性优势。然而,值得注意的是,在CeO2催化EDC 裂解过程中,温度达到400℃时才会产生VCM,仍然存在能耗问题。因此,开发Ce 基催化剂面临的主要挑战是进一步降低EDC裂解温度[16,35]。
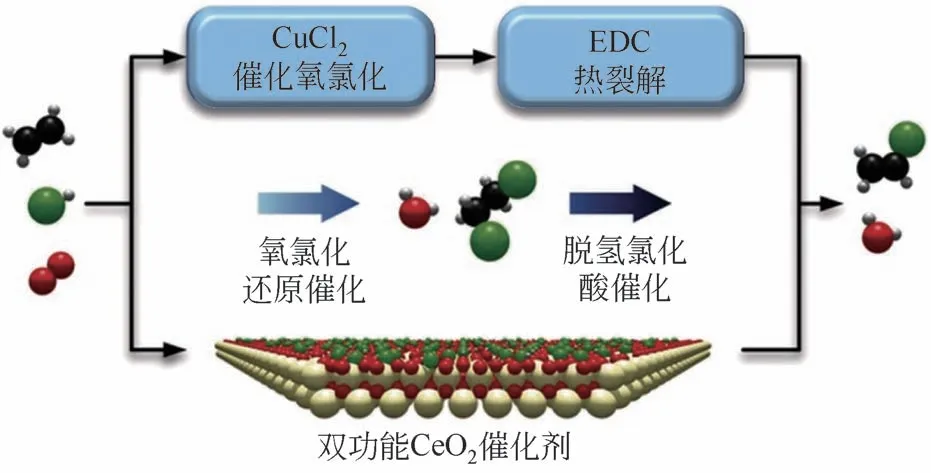
图2 CuCl2催化剂和双功能CeO2催化剂催化C2H4氧氯化和EDC热裂解生成VCM示意图
1.2.2 Eu基催化剂
一直以来,镧系化合物被广泛用作CuCl2/γ-Al2O3催化剂的掺杂剂或者载体[36-40],但它们作为C2H4转化为VCM 的主要活性相从未被系统地研究过。2016 年,Pérez-Ramírez 课题组[16]将氧氯化铕(EuOCl)对VCM的优异选择性与CeO2对EDC的高活性相结合,合成了复合铕铈氧化物(EuOCl-CeO2)催化剂用于乙烯氧氯化一步法合成VCM。在报道的催化剂中,CeO2的活性最高,但仍会生成COx等副产物,而EuOCl的VCM选择性较好,在C2H4转换反应100h 以上时选择性依然高达96%。H2程序温度还原(H2-TPR)、NH3程序温度脱附(NH3-TPD)和氧化测试(C2H4,CO 和HCl 氧化)证明:与CeO2相比,EuOCl独特温和的氧化还原平衡能够抑制过度氧化。同时,EuOCl另一个关键优势在于具有高浓度的酸位点,这明显促进了EDC脱HCl 产生VCM。除此之外,研究者还提出双层催化剂策略,即首先整合一个CeO2催化剂层用来生产EDC,随后利用EuOCl 催化剂层催化EDC 生成VCM,总收率高达30%。上述研究预计比目前的两步工艺更经济,因为可以减少单元操作,无需中间EDC提纯和随后的裂解步骤。见图3。

图3 单金属镧系催化剂催化乙烯氧氯化反应的产物收率
1.2.3 氮掺杂碳催化剂
鉴于氮掺杂碳材料在非均相催化反应体系中具有出色的催化作用,近期,本文作者研究团队[41]制备了氮掺杂的介孔碳材料,并将其运用在乙烯氧氯化反应体系中。结果显示,在250℃反应温度下,VCM 可以直接经由乙烯氧氯化反应得到,其中涉及的EDC裂解反应中释放的HCl可以被乙烯氧氯化利用起来,这样的氮掺杂碳催化剂表现出乙烯氧氯化以及EDC裂解双重功能特性。在该研究工作中,使用氮掺杂的碳催化剂可以得到可观的VCM 选择性(约50%)以及C2H4转化率,这是第一次报道使用不含金属催化剂在温和反应条件下制备VCM 和EDC,其反应机理如图4所示。通过采用程序升温表面反应(TPSR)等方法对反应机理进行了研究,发现氮掺杂碳材料形成了N—C—O复合活性中心,具有活化C2H4、HCl 及O2的功能。氧分子辅助HCl分解,同时在相同活性位上发生乙烯表面氯加成及EDC 脱HCl 反应,形成了一个高效的表面Cl*化学循环,打破了EDC脱HCl的热力学平衡限制,达到了低温且高选择性乙烯氧氯化制VCM 的目的。此外,该反应存在一个较大挑战,HCl在活性位上的强吸附对EDC脱HCl有抑制作用。基于此,本文作者团队还尝试将CuCl2/γ-Al2O3催化剂和氮掺杂碳催化剂组合进行串联反应。物理混合的结果显示,主要产物依旧是EDC,只有少许VCM 生成,这主要由于气相中HCl的分压较高,因此抑制了EDC的裂解反应。而将其组合成双层催化剂的结果却明显不同,即VCM是主要产物。同时,COx的生成也可被有效抑制,最终可以达到甚至高于目前工业上两步法的VCM 收率(单程转化),且反应条件温和得多,这是由于原料HCl 可以在第一层的CuCl2/γ-Al2O3催化剂中被消耗掉大部分。因此,氮掺杂碳催化剂暴露在气相中的HCl的分压相对很低,极大促进了裂解反应。同时,氮掺杂碳催化剂本身具有氧氯化和EDC 裂解双功能,可以将裂解原位产生的HCl用于氧氯化反应,再次促进了EDC裂解反应。与此同时,对反应的停留时间进行相应调整,VCM的收率可以继续提高。
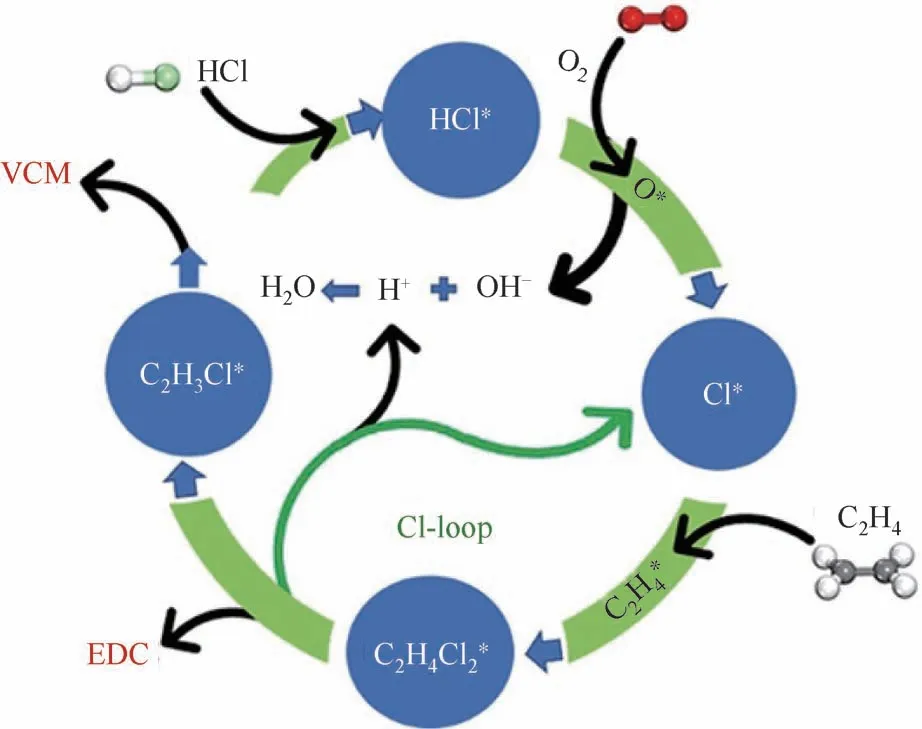
图4 一步法制备VCM机理示意图[41]
2 乙炔法制VCM
2.1 贵金属催化剂
2.1.1 Au基催化剂
在20 世纪80 年代,Hutchings 等[42]首先将负载型金属氯化物催化剂的催化活性与金属标准电极电位进行关联,而不是与先前报道的金属阳离子的电子亲和度进行关联,预测并验证了电极电位高于汞(Ⅱ)(0.851V)的Au(Ⅲ)(1.42V)阳离子在乙炔氢氯化反应中具有优异的催化活性。随后,该团队围绕Au 基催化剂的催化活性位点、失活原因、提高催化活性等方面展开了一系列工作[43-45]。比如,2017 年,Hutchings 等[8]在乙炔氢氯化反应条件下,对Au/C 催化剂进行了原位X 射线吸收精细结构(EXAFS)研究,结果表明,催化剂活性与Au(Ⅰ)∶Au(Ⅲ)的比值有关,如图5 所示。图5 显示了每个能量极小值的结合能和每个Au 的赫希菲尔德电荷以及AuCl 在碳载体上对C2H2和HCl 上的最优几何构型[8]。该反应可以假设为AuCl 氧化加成HCl,然后加入C2H2,通过Au(Ⅰ)-Au(Ⅲ)氧化还原对VCM进行还原消除。这种机制通常被忽略了,因为它需要Au(Ⅰ)而不是更经常被观察到的Au(Ⅲ)。结合理论计算以及原位条件下观察到的活性位点,出现了Au(Ⅰ)和Au(Ⅲ)的催化循环。这一研究验证了他们前期工作中关于Au 是乙炔氢氯化反应的最佳催化剂的预测。

图5 AuCl向AuCl2H的转化及AuCl的再生机制
近年来,科研工作者在不断提高Au 基催化剂催化活性的同时,通过掺杂非贵金属、促进活性组分分散与再生、载体改性等策略以降低Au负载量,进一步降低生产成本。张金利教授等[3]制备了Au、Au-La(Ⅲ)、Au-Co(Ⅱ)和Au-Co(Ⅲ)等几种负载型Au 催化剂用于乙炔氢氯化反应,通过优化物料比例,得到的Au1Co(Ⅲ)3/SAC 催化剂具有最佳的催化性能,在150℃、气时空速(GHSV)=360h-1条件下转化率为92%,对VCM的选择性为99.9%。分析结果表明,Co(Ⅲ)、Co(Ⅱ)和La(Ⅲ)的添加不仅有利于稳定具有催化活性的Au+,在制备Au/SAC 催化剂过程中还可以抑制Au3+被还原为Au0,这些非贵金属的添加可以极大地抑制催化剂表面积炭的生成,从而提高Au 基催化剂的活性和长期稳定性。袁友珠教授等[46]讨论了一种合理的再分散机制并验证了再分散工艺的高效性,将烧结后的大粒度Au 颗粒经碘烃处理后再分散成分布均匀、粒度可控的高分散纳米颗粒,在温和条件、有碘烃存在时,其再分散表现为反向团聚过程,这种行为与Au 粒子上的C—I 键离解能(BDE)和碘离子的吸附有关。以CHI3为例,如图6所示,Au纳米团簇再分散过程包括四个步骤,即化学吸附、解离、再分散和粒度控制。第一步,由于金属裸露表面易于吸附外来的有机材料,因此,碘烃在大颗粒金表面的快速化学吸附和相互作用开始出现;第二步,Au 表面上C—I键的快速均裂离解,随后Au 粒子的缓慢解体和扩散,形成Au—I物种,同时,在扩散过程中,中间物AuxIy的还原电位与碳的富氧功能表面的氧化电位的差异可能是Au在碳表面沉积的驱动力。因此,可以合理地推断,纳米Au 在碳载体上的自发沉积是由于碳和AuxIy中间物发生了氧化还原反应,类似于Pt 纳米粒子与单壁碳纳米管或氧化石墨烯的反应机理;第三步,碘物种与Au 粒子持续的相互作用导致Au大粒子进一步被破坏;最后,大的Au颗粒的奥斯特瓦尔德反向成熟、Au—I在活性炭上的吸附以及Au—I 团聚形成小Au 颗粒的过程都达到了平衡。另外,碘烃的C—I 离解能与再分散率的相关性表明,最小的BDE(CHI3)具有最佳的再分散效率。碘烃用于可控再分散烧结的Au 纳米粒子被认为是催化剂再生的一种可行方法。
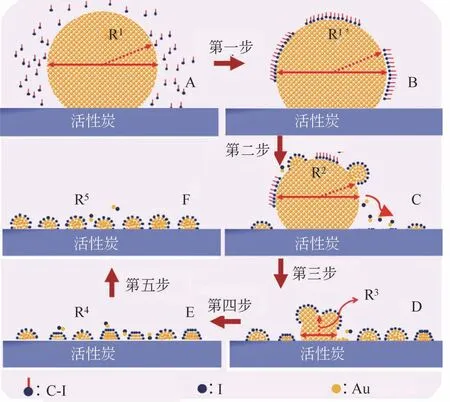
图6 Au纳米团簇在再分散不同阶段的基本步骤[46]
李小年教授等[47]利用离子液体([Emim][SCN])对载体活性炭(AC)改性,合成了载体表面富集氮和硫的Au 基催化剂(Au/N,S-AC-700),实现了电子由N 向Au 的转移,改变Au3+的电子环境,进一步抑制了Au3+的还原,提高了催化剂的寿命。在180℃、740h-1的条件下,对VCM 的选择性高于99%,另外,在催化剂负载量为0.1%、运行300h后,其催化活性仍能维持98.2%。以往文献报道分析表明,吡啶氮与吡咯氮相比,前者更加稳定,是催化剂反应活性位点,但由于载体表面存在硫物种与吡啶氮的竞争,抑制了吡啶氮的形成,吡咯氮上的π电子增加了Au3+的电子密度,有利于对HCl的吸附,抑制活性物种Au3+被C2H2还原,从而使Au/N和S-AC-700具有优异的活性和稳定性。
另外,魏飞教授[48]提出了一种负载在碳上的新颖硫氰酸盐(—SCN)络合Au 的催化剂(Au 负载量为0.25%),这种配合物显著降低了Au3+的电极电位,即由0.926V 降至0.662V,进而降低了其被C2H2还原的概率。密度泛函理论(DFT)研究表明,—SCN 与Au 的络合作用增加了Au3+与C2H2反应的能垒,阻止了Au 催化剂的快速失活,有效地提高了催化剂的活性和稳定性。测试结果表明,失活是一个线性过程,主要原因是Au3+的损失,而不是积炭的形成。同时,该催化剂的TOF值高达5.9s-1,3000h的测试表现出良好的反应活性(>95%)、高选择性(>99%)和低失活率(0.014%/min)。此外,从成本角度考虑,Au-SCN 络合物与HgCl2相持平,从环保角度考虑,对环境更加友好,因此具有广阔的商业化应用前景。
李瑛教授等[49]报道了在乙炔氢氯化反应中,Au纳米颗粒(Au NPs)可以动态生成Au 单原子(Au SAs),并初步推测了自发分散过程的机理,如图7。如图7(c)所示,第一步,HCl在Au NPs表面快速地进行化学吸附和相互作用;第二步,H—Cl 键在Au NPs 表面上迅速断裂,单原子Au-Cl 物种从Au NPs 表面缓慢分解并扩散到邻近的碳表面,在碳表面无序运动和剧烈碰撞后,Au-Cl物种通过与碳缺陷碰撞而被捕获。同时,在整个自发扩散过程中,由于Au—Au 键的聚集能,Au-Cl 聚集形成新的Au 簇/NPs,单一的Au-Cl 的团聚与Au NPs 的原子化之间存在竞争,Au NPs 的原子化和Au-Cl 的团聚速率达到平衡状态,以得到催化剂的稳定状态。活性测试表明,得益于富含缺陷的碳载体和Au NPs 在反应过程中Au SAs 的原位自发分散,在GHSV=50h-1时,0.1%的Au/AC-D 催化剂的C2H2转化率为80%,对VCM 的选择性高于99%,在反应500h 时,C2H2转化率略有下降。虽然新制备的催化剂中含有较大的Au NPs,但在测试条件下,由于Au NPs 的自发分散,0.1%Au/AC-D 催化剂可以达到稳定状态。
2.1.2 Ru基催化剂
目前,虽然Au 基催化剂的开发取得了一定的进展,但昂贵的价格促使科研工作者也关注于其他贵金属,比如Pt、Ru、Pd、Cu 等。Ru(Ⅲ)的标准电极电势(0.455V)与Hg(Ⅱ)(0.851)相近,可能具有较高的催化活性,因而受到广泛关注[50-51]。
2013年,代斌教授等[52]通过DFT计算得出,催化剂的激活势垒的顺序为HgCl2>AuCl3>RuCl3,所以RuCl3成为乙加氢氯化反应的良好催化剂候选之一,Ru 基催化剂应用于乙炔的氢氯化反应被大量报道。另外,由于在载体表面存在大量的Ru物种,比如Ru0簇、RuO2粒子和阳离子Ru3+物种,所以已报道的数据对碳负载Ru 基催化剂的反应活性中心存在争议。

图7 Au纳米颗粒的催化性能[49]
众所周知,乙炔氢氯化反应是路易斯酸催化的典型反应,然而,催化剂表面的强酸性位点会导致积炭,特别是在乙炔和烯烃的反应中。RuCl3的路易斯酸性比AuCl3和HgCl2强得多,Ru 基催化剂的积炭现象比Au和Hg更为严重。2018年,李瑛教授等[56]研究了Ru 催化剂表面酸性与稳定性之间的关系,制备了经过浓氨水处理的Ru 基催化剂(RuCl3-A/AC),提高了Ru 催化剂的稳定性。通过对比RuCl3-A/AC 和RuCl3/AC(未经浓氨水处理)的催化活性,RuCl3-A/AC 和RuCl3/AC 的失活率分别为0.14% h-1和1.64% h-1,这表明对RuCl3/AC 催化剂进行氨预处理可以大大提高催化剂的稳定性。同时,为了避免活性组分的聚集,提高催化剂在载体上的分散性,李瑛教授等[57]制备了氮掺杂的钌-碳催化剂(Ru-N-OMC),将尺寸分布1.5~2.5nm范围内的Ru颗粒均匀地半嵌入碳基体中,未出现聚集和孔堵塞现象。分析结果表明,N和Ru均是活性位点,但Ru-N-OMC的催化性能明显优于Ru-OMC(未掺杂N),并阐明不同N位点和金属Ru颗粒在乙炔氢氯化反应中的催化作用。在以上研究的基础上,由于乙炔和HCl的共活化作用,RuCl2N被认为是乙炔氢氯化反应有效活性位。李小年教授等[58]设计并成功引入含氮配体(形成Ru-N物种),制备了负载型单原子催化剂(Ru-N SAC),促进了HCl的活化,该催化剂转化频率(TOF)值高达5263h-1,是Ru-N SAC的近两倍,这为合理设计高活性、高稳定性的单原子催化剂提供了指导,对Ru 基催化剂在工业上的大规模应用具有重要意义。
张金利教授等[59]以杂原子与金属离子的配位相互作用为基础,利用含磷离子液体制备了碳负载Ru嵌在离子液体中的催化剂(Ru-ILx/AC)。如图8所示,通过优化离子液体种类及物料配比,得到最优的催化剂(1Ru-5IL5/AC)在180℃、180h-1的测试条件下,C2H2转化率最高可达99.51%,200h 测试中活性几乎没有明显下降。CO-TPD,透射电镜(TEM)、X 射线电子能谱(XPS) 和热重分析(TGA)等表征手段表明,P 与Ru 之间具有很强的配位作用,有利于稳定高价Ru。此外,含磷离子液体的引入抑制了活性组分的团聚和积炭的沉积。
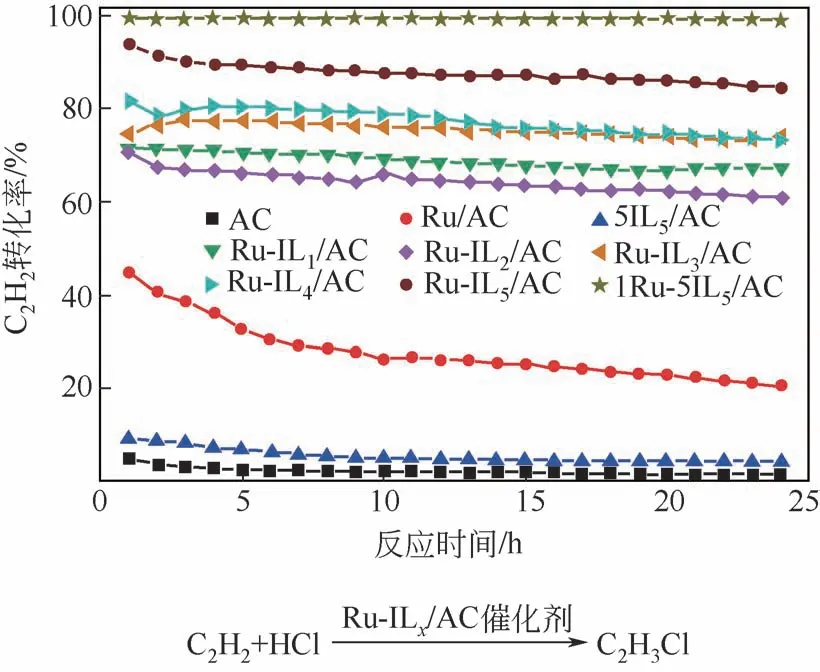
图8 Au基催化剂的C2H2转化率[59]
2.1.3 Pt-基催化剂
从经济角度考虑,Pt 与Au 价格相当,这使它从工业角度来看很有吸引力[60]。然而,到目前为止,关于乙炔氢氯化反应的Pt 基催化剂方面的研究较少,这可能是由于Au 基催化剂的催化活性比Pt基催化剂高约7倍,这阻碍了对Pt基催化剂的进一步深入研究。纳米结构活性位点的构建已被证明是Au和Ru基催化剂成功的关键,因此,纳米Pt在乙炔氢氯化反应中可能具有相当大的潜力。
2020 年,Pérez-Ramírez 教授[61]合成了Pt/ACa-Tact、Pt/AC-w-Tact和Pt/NC-w-Tact三系列Pt基催化剂,碳载流子上的Pt 单原子比其Au 载流子上的Pt单原子稳定得多(最高800℃),并可以通过简单的温度控制来精确调整其环境,这使得制备更容易。在所有三种低温Pt 催化剂(Tact=200℃)中,金属原子高度分散,与Au 原子分散所需的苛刻反应条件(王水浸渍溶剂)相比,获得Pt 单原子的合成简易性是一个明显的优势。此外,Pt单原子表现出优越的热稳定性,在800℃,Pt 原子在活性炭上可以达到高度分散,而Au单原子在200℃以上很容易团聚结块。同时,结合动力学分析和密度泛函理论,评估了Pt 种类如何决定催化性能,从而确定Pt(Ⅱ)-Cl 为活性位点,其活性比Pt 纳米粒子高三倍,证明了Pt 单原子在乙炔氢氯化反应中表现出优异的稳定性。在线测试25h 后,其时空产量(STY)超过了Au类似物(如图9所示),使其成为VCM 生产的候选催化剂之一。值得注意的是,碳载体的选择(AC 或氮掺杂碳)对Pt 位点的催化反应没有显著影响,但对乙炔氢氯化反应的稳定性有显著影响。具体地说,在氮掺杂碳上,积炭被认为是催化剂失活的主要原因,这可能是由于吡啶氮缺陷通过高度放热插入乙炔形成七元环而引起的,DFT 辅助确定了吡啶氮位点导致生成积炭的机理。除了乙炔氢氯化之外,控制Pt 原子反应性的方法一般也适用于其他领域,为金属种类的可调性提供了广阔的应用前景。

图9 Pt、Ru和Au基催化剂的比较[61]
据报道,用王水(HNO3∶HCl 体积比为1∶3)作为溶剂制备的Au 单位点催化剂(SSCs)缺乏稳定性。2020 年,Hutchings 课题组[62]研究了在没有强氧化酸性溶剂的情况下,通过低沸点、低极性溶剂(如丙酮)的浸渍,制备了高分散的贵金属单位点催化剂(1.0% Pd/C、Pt/C、Ru/C 和Au/C),以Au/C 催化剂为例,金属以混合阳离子的形式存在[23%Au(Ⅲ)和77%Au(Ⅰ)],用该方法制备的Au 催化剂在乙炔氢氯化反应中表现出与用酸性和氧化性溶剂制备的催化剂相当的活性。由于所使用的溶剂不是强酸性或氧化性的,因此,其高活性的原因可能是:①溶剂的亲水/疏水性质,增加了碳载体的润湿性,从而导致更高的分散性;②降低干燥温度,防止Au 结块;③催化剂制备中完全无水;④在无水条件下Au 在高氧化状态下更加稳定。通过对比Au/C-丙酮催化剂、Au/C-王水催化剂和高极性Au/C-H2O 催化剂的催化活性,Au/C-丙酮催化剂在反应条件下具有较高的稳定性,这表明碳载体的不同功能在决定这些催化剂的诱导期方面起着关键作用。因此,采用这种方法可以方便地制备金属单位点催化剂,且具有相对较高的金属负载量。同时,在催化剂制备过程中不需要处理高酸性废物,从而有希望在不需要水溶性金属盐的情况下生产催化剂。
2.2 非贵金属催化剂
除了上述研究较多的Au、Ru、Pt 等贵金属基催化剂外,诸如Cu、Bi、Sn 等非贵金属基催化剂也被大量报道,虽然其催化活性不及贵金属基催化剂,但其拥有优异的VCM 选择性,且生产成本较低,也成为乙炔氢氯化反应催化剂的候选之一。据报道,SnCl2和BiCl3均具有高挥发性和低沸点的特点,很难满足催化活性和稳定性的双重要求[63]。Cu作为一种稳定、廉价的金属,可以广泛应用于乙炔氢氯化反应。
近年来,采用离子液体(ILs)对Cu基催化剂进行修饰来促进乙炔氢氯化反应的方法得到科研工作者的青睐。在乙炔氢氯化反应工艺中,由于ILs可以有效避免热点和积炭引起的失活,受到了广泛的关注[64-67]。张旭斌副教授等[68]合成了一系列高效、稳定的氯铜酸盐催化剂,得到的[Hnmpo]Cl-0.60CuCl IL 具有优异的催化活性,在180℃和50h-1的条件下,运行150h 后乙炔转化率为86%。红外热重分析(TGA-DSC-FTIR)、电感耦合等离子体发射光谱(ICP-OES)、XPS、紫外可见光光谱(UV-vis)、电喷雾电离源质谱(ESI-MS)和拉曼光谱(Raman)等表征证实了Cu(Ⅰ)是主要活性成分,且在上述反应条件下极其稳定。结合实验结果和理论计算,提出了反应机理,并发现氯铜酸盐的催化性能与对HCl 的吸附呈正相关,[Hnmpo]Cl-0.60CuCl IL与HCl的强相互作用使其具有优良的催化性能。
张金利教授等[70]采用湿浸渍法合成了几种含磷酰胺配体的负载型Cu 基催化剂,在180℃、GHSV(C2H2)=180h-1的测试条件下,使用15%Cu10%HMPA/SAC 催化剂可获得优异的催化活性,乙炔转化率为87.25%。X 射线衍射(XRD)、TEM、TGA、ICP、H2-TPR、XPS 等 分 析 表 明,HMPA(六甲基磷酰胺)配体可以改善Cu 物种分散,抑制积炭与Cu的流失,稳定活性Cu物种的价态。同时,FT-IR、Raman、O1s XPS光谱和DFT进一步证明,基于电子传递机制,Cu和HMPA之间稳定的配位结构使得Cu基催化剂性能进一步提升。
2.3 碳基非金属催化剂
与传统的金属或金属氧化物相比,碳材料具有比表面积大、耐酸耐碱、表面易功能化等优点,因此,在催化领域碳基非金属催化剂受到普遍关注。杂原子掺杂的碳催化剂具有丰富的缺陷,研究表明,杂原子掺杂的碳材料在乙炔氢氯化反应中表现出良好的活性。包信和院士[71]报道了一种由碳化硅衍生的氮掺杂碳纳米复合材料,在没有额外金属的情况下直接激活乙炔进行氢氯化反应,如图10 所示,吡咯氮(结构5)和吡啶氮(结构2)在碳位上诱导出低于费米能级的定域电子,这对于吸附C2H2是至关重要的。测试表明,该催化剂(SiC@N-C)在200℃的条件下,C2H2转化率达到80%,VCM 选择性超过98%,在150h 的测试中表现出优异稳定性。实验研究和理论模拟表明,与吡咯氮原子结合的碳原子是催化剂的活性位点,强调了氮掺杂对实现乙炔高效氢氯化的重要性。此外,这一发现也为其他炔的碳基活化催化剂的设计提供了指导。
Pérez-Ramírez教授等[10]制备了聚苯胺衍生的氮掺杂碳材料(PANI-C)并用于乙炔氢氯化反应,通过CO2-TPD、XPS、交叉极化魔角自旋核磁共振(CP/MAS NMR)等一系列的表征,揭示了这一反应中PANI-C 材料的优异催化性能归属于以下两点:①高含量的吡咯氮促进了对反应物的吸附;②良好的导电性可能会影响吸附物的表面扩散。由于提高电导率会导致氮含量的降低,因此必须控制这两种性质之间的相互作用,以最大限度地提高催化性能。因此,在乙炔氢氯化反应中,PANI-C 可与Au基催化剂相媲美。
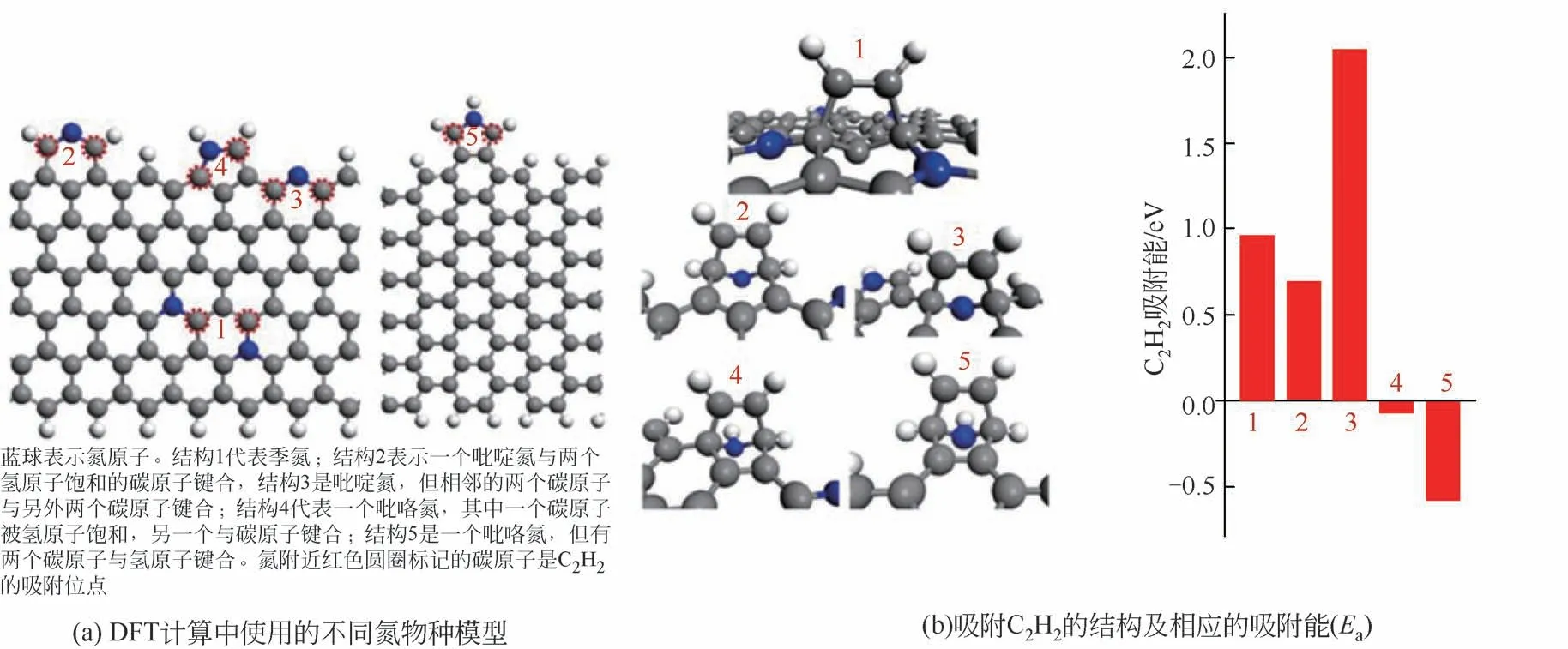
图10 DFT计算反应机理[71]
韩优教授等[72]将椰壳活性炭作为吸附剂,吸附废旧印染废水(中性红NR)得到的碳材料作为碳氮前体,然后将其煅烧得到氮掺杂活性炭(NR-CAC)。结合分子动力学模拟和密度泛函理论,分析了NR-CAC催化剂的结构和电子性质、氮掺杂过程以及不同氮物种对乙炔氢氯化反应的催化机理,其中,掺杂的吡啶N和吡咯N是乙炔氢氯化反应的活性位点,并指出反应能垒最低的吡啶N是最具活性的位点。同时,N2物理吸附/解吸实验和ReaxFF 分子动力学模拟结果表明,CAC 表面生成了有利于反应气体扩散的多孔碳材料。作为碳基非金属催化剂用于乙炔氢氯化反应,最优的3NR/4CAC催化剂在220℃、GHSV=30h-1的条件下,乙炔转化率高达97.9%,VCM选择性大于99%,并在反应运行200h后具有良好的稳定性。利用废旧印染废水吸附剂制备N 掺杂CAC 催化剂的简便方法,为工业废物的资源化利用和PVC 工业的可持续发展提供了一个可行的途径。
南开大学李伟教授等[73]利用硬模板(SBA-15)成功合成了一种具有介孔结构的硫、氮共掺杂碳材料(NS-C-NH3),并将其应用于乙炔的氢氯化反应。测试表明,在220℃、GHSV=5.2mL/(g·min)的条件下,乙炔的转化率超过80%。同时,XPS、C2H2-TPD 等表征表明氮是乙炔氢氯化反应的活性位点,硫的掺杂增加了吡啶氮的比例,提高了共掺杂催化剂的催化活性,SBA-15 产生的高比表面积的介孔结构和氨气中的氮有助于提高催化剂的稳定性,使得NS-C-NH3在100h 的测试中具有良好的C2H2转化率。因此,硫、氮共掺杂碳材料可能是未来VCM可持续生产的催化剂。

通常,引入缺陷位点的目的是调整碳原子的杂化状态,从而改变电子构型,产生化学反应的活性位点。李瑛教授[75]等研究了sp2:sp3杂化率与催化性能之间的关系,发现它可以定量描述碳催化剂对乙炔氢氯化反应催化性能,并确定了乙炔氢氯化碳催化剂中的黄金分割点。纳米金刚石取向(ND)和石墨取向两种碳催化剂的表面sp2∶sp3均与乙炔氢氯化反应的催化性能呈火山型关系,而且最优的比例都在32%~35%区间。sp2和sp3复合结构对乙炔氢氯化反应的催化活性优于简单的sp2(石墨烯)或sp3(纳米金刚石)碳材料,在ND 表面引入sp2杂化结构作为缺陷位,可以打破sp3碳原有的电子构型,缺陷的引入促进电子局域化,提高了电子密度,从而增加了活性位的数量。这项工作提出了乙炔氢氯化反应中表面杂化结构与活性之间的直接关系,为建立碳基非金属催化剂的通用设计原则奠定了基础。
总之,杂原子掺杂碳催化剂在乙炔氢氯化反应中表现出良好的活性,但一直未见工业化报道。姜标、钟劲光等[76]与山东德州实华集团合作,开发了氮掺杂活性炭催化剂(N@AC),催化C2H2与EDC偶联反应合成VCM,如图11 所示。催化反应耦合技术是一个有吸引力的前景,虽然这方面的研究相对较少,催化偶联反应有以下几个优点:①反应产物的副产物可以就地利用,大大提高了主要产物的收率;②通过安全减少或消除副产品污染,提高生产经济水平;③减少极端反应(如强放热反应和吸热反应),便于操作。基于上述催化反应耦合技术的优势,在热裂解的基础上,从EDC中消除HCl是一个温度在480~550℃之间的强吸热过程,转化率为50%,而向乙炔中加入HCl 是一个强放热反应,在同一反应器中,吸热反应和放热反应之间的反应热达到了化学能内部平衡。该催化剂性能稳定,EDC 转化率达到95%以上,乙炔转化率达到90%以上,在260℃下对VCM 的选择性达到98%以上,反应效率高、能耗低,是一个具备经济效益的绿色化学新方法。
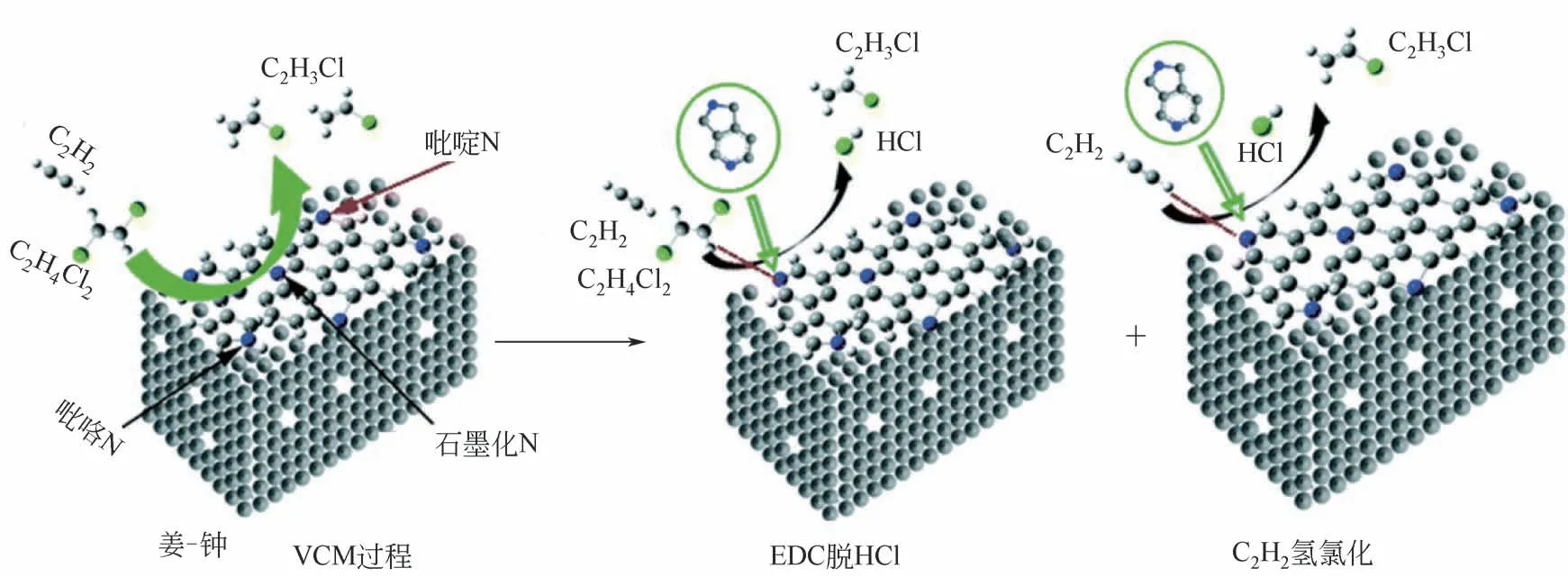
图11 VCM生成机理图[76]
3 结语及展望
以煤及石灰为原料的电石乙炔法生产VCM 具有工艺简单和投资小的优点,而被国内企业广泛应用,大规模替代环境污染的工业汞基催化剂成为该技术目前最大的挑战。负载型金催化剂已经显示出良好的性能,有望替代汞基催化剂,同时碳基非金属催化剂也具有广阔的发展前景,尤其是经过杂原子修饰的碳材料,在通过条件优化后可以得到与贵金属催化剂相媲美的催化效果。单原子金属催化剂具有优异的性能和较大的潜力,成为新一代的乙炔氢氯化催化剂。通过调变单原子金属催化剂的配位结构,可以大幅改善乙炔氢氯化的催化性能并降低催化剂的成本。另外,乙炔法制VCM 工艺面临巨大的环保压力,制备得到的VCM 质量亟需大幅提升,以期拓展PVC的高端使用。
乙烯法生产的VCM 通常比乙炔法具有更优异的品质,适合于高端PVC 的应用,国内乙烯法工艺在氯乙烯生产中的比重将会逐步提高。乙烯原料轻质化(以乙烷为生要原料)及煤制烯烃的大规模产业化降低了乙烯的价格、拓展了乙烯的原料,降低了对石油的依赖,提高了乙烯法的吸引力。平衡乙烯法制VCM 工艺预计在较长时间内仍是乙烯法的主要工艺路线,开发新型具备可控氧化态的铜基催化剂可以改善催化剂的选择性及稳定性,提高乙烯法的竞争力。
除了乙烯及乙炔法外,以乙烷作为廉价的氧氯化反应原料已受到越来越多的关注[77]。页岩油气革命带来了丰富的乙烷资源,将强化乙烷氧氯化制VCM 的需求,尽管乙烷氧氯化目前没有工业化,仍有很多问题需要解决,但它将有可能成为乙烯平衡法生产VCM技术后的一个重大突破。总而言之,氯乙烯生产将朝高氢碳比原料及过程低碳化方向发展。
氯乙烯的生产除了大力发展新的VCM 合成化学外,过程的强化及新过程的开发将是技术产业化的关键。乙烯平衡法就是一个成功的例子,它结合了乙烯氯化及氧氯化制EDC,后者消耗了EDC 裂解产生的HCl。乙炔与EDC无汞催化剂耦合法强化了氯乙烯生产。相对于传统乙烯平衡法,开发乙烯氧氯化法一步制取VCM 可大幅简化工艺、降低成本,进一步提高乙烯法的竞争力。例如,利用多功能催化剂(如CeO2催化剂、EuOCl催化剂及氮掺杂碳材料催化剂)可同时催化乙烯氧氯化及EDC 脱HCl 反应,实现HCl 的在线利用,平衡乙烯、氧、HCl 的吸附和活化,以期提高VCM 的收率,目前该技术仍处于实验室阶段,但预期催化剂及过程开发将有重大突破。

