miR-206靶向Cx43调控ERK1/2通路在兔激素性股骨头坏死中的作用
席源,罗高斌,魏桂清,覃文涛,薄占东
1.广西医科大学第一附属医院骨关节外科,南宁 530021;2.中国人民解放军南部战区总医院骨科医院,广州 510010
股骨头坏死是临床常见的难治性疾病,后期可导致股骨头塌陷并继发严重的功能障碍,致残率极高,多数患者最终需选择关节置换等外科治疗。近年来由于激素的广泛运用,糖皮质激素已成为非创伤性股骨头坏死的重要致病因素[1,2],且口服皮质类固醇对股骨头缺血性坏死的病理发展有持续性影响[3]。但其确切机制尚不明确,多种治疗方法的疗效不尽人意。探索激素性股骨头坏死(steroid-induced avascular necrosis of the femoral head,SANFH)发病机理,对SANFH 的诊治有重要意义。本组前期研究证实,SANFH 患者股骨头内微小RNA(MicroRNA,miR)-206 表达上调,同时缝隙连接蛋白(connexin,Cx)43 表达下调,提示Cx43/miR-206 参与SANFH 的发生发展[4]。据载,Cx43高表达可激活细胞外信号调节蛋白激酶(ERK)1/2 信号通路,进而促进成骨分化[5]。本研究检测兔SANFH 模型中miR-206、Cx43、ERK1/2 及Runx2表达变化,探讨Cx43/miRNA-206 及其下游ERK1/2 通路在SANFH 中的作用,初步阐明其机制,期为SANFH 诊治提供新的理论支持。
1 资料与方法
1.1 材料
1.1.1 实验动物 健康新西兰大白兔(广西医科大学实验动物中心提供并代为饲养,实验动物使用许可证号:SYXK 桂2014-0003),质量(2.5±0.3)kg。
1.1.2 主要试剂及仪器 注射用甲泼尼龙琥珀酸钠(辉瑞制药,比利时),大肠杆菌内毒素(sigma,美国);miRNA 原位杂交试剂盒(EXIQON,丹麦);鼠抗-Cx43(Santa,美国)、兔抗-ERK1/2、兔抗-P-ERK1/2、鼠抗-βtubulin(CST,美国),鼠抗-Runx2(Abnova,中国台湾);IRDye 800CW goat anti-mouse IgG(H+L)、IRDye 800CW goat anti-rabbit IgG(H+L)二抗(Licor,美国);磷酸酶抑制剂PhosSTOP(Roche,瑞士),RIPA 裂解液(强)、Bradford 蛋白浓度测定试剂盒(生工生物,中国),免疫组织化学试剂盒(博士德,中国);总RNA 小量制备试剂盒(Corning,美国)、PrimeScript ™RT reagent Kit 和TB Green®Premix Ex Taq™II(Takara,日本)。TDH-500 原位杂交仪(奥盛,中国),Mini-PROTEAN3 电泳槽和Mini Trans-Blot 转印槽(Bio-Rad,美国),ABI 7500 Fast 荧光定量PCR 仪(Applied Biosystems,美国);Gyroscan T5-NT 磁共振成像仪(Philips,荷兰)。
1.2 方法
1.2.1 激素性股骨头坏死模型构建与分组 成年新西兰大白兔60 只,均分为实验组和对照组;替补实验动物数只。实验组兔耳缘静脉注射内毒素(10 mg/kg),24 h 后重复1 次,随即臀肌注射甲强龙(20 mg/kg),共4 次,每次间隔24 h;注射内毒素前1 d 肌注青霉素钠(8×104U)+兰索拉唑(10 mg),1 次/d,共7 次。对照组兔注射等量生理盐水。注射后第2 周、8 周和16 周,行核磁共振(MRI)检查。检查后随机取实验组和对照组各10 只动物予以空气栓塞处死,取出双侧股骨头,按冠状面切为薄片,PBS 溶液冲洗,一半置于4%多聚甲醛溶液固定,10%乙二胺四乙酸(EDTA)溶液脱钙,梯度酒精脱水,石蜡包埋,5 mm 切片,HE 染色,应用Image-Pro-Plus 软件计数空骨陷窝,计算各组空骨陷窝率。T1 加权像表现为点状、细线状、片状低信号或T2 加权像表现为点状、细线状、片状高信号;骨小梁排列紊乱、变细或断裂,骨小梁内出现弥漫性空骨陷窝或核皱缩,伴周围骨髓细胞坏死诊断为股骨头坏死。
1.2.2 免疫组织化学检测 按上述方法制备组织切片,60 ℃烘烤30 min,常规脱蜡至水,10%H2O2溶液处理以灭活内源性酶,0.01 mol/L 枸橼酸盐缓冲液(pH 6.0)高压修复抗原,滴加5% BSA 室温封闭20 min。滴加羊抗-Cx43 一抗4 ℃过夜,PBS(pH 7.2~7.6)洗2 min×3 次,滴加聚合HRP 标记抗羊IgG,37 ℃孵育30 min,DAB 显色,镜检。每张切片选取3 个高倍视野,应用Image-Pro-plus 软件测量积分光密度值(IOD),并行统计学分析。
1.2.3 miRNA-206 原位杂交 组织切片脱蜡、水化,滴加蛋白酶K 孵育10 min,PBS 洗2 次,梯度酒精脱水;滴加25 ml 杂交混合液于50~60 ℃杂交1 h,1%山羊血清封闭15 min,再加入DIG-AP 抗体(10:800)室温孵育1 h;PBST 洗3 次,加入AP 底物,30 ℃避光孵育2 h,水洗2 次;细胞核染液复染,镜下观察。
1.2.4 荧光定量PCR 检测(1)按试剂盒说明书提取样本总RNA。琼脂糖凝胶电泳鉴定RNA 质量,紫外分光光度计计算RNA 浓度。(2)按PrimeScript™RT reagent Kit 说明书进行逆转录。(3)实时荧光定量:对逆转录产物进行qPCR 扩增。通过计算2-△△Ct值统计各组目的基因表达的差异。各基因引物见表1。1.2.5 Western blot 检测 用RIPA+PMSF+磷酸酶抑制剂(体积比100:1:1)提取总蛋白。蛋白定量后,取30 mg 蛋白质行SDS-PAGE 凝胶电泳。电泳后转至NC 膜,5%BSA 室温封闭1 h,一抗4 ℃孵育过夜(工作浓度Cx43 为1:5000,ERK1/2 为1:1000,P-ERK1/2为1:2000,Runx2 为1:2000,β-Tubulin 为1:10000)。二抗室温孵育1 h(工作浓度为1:10000),Odyssey 成像系统拍照,IPP 软件测定条带灰度值,采用目的条带与β-Tubulin 条带的灰度比值表示目的蛋白相对表达水平(其中P-ERK1/2 条带与ERK1/2 条带相对比)。

表1 荧光定量PCR 引物序列Tab.1 qPCR-specific primer sequence
1.3 统计学分析
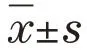
2 结果
2.1 激素性股骨头坏死模型制作结果
在建模过程中,2 周和8 周实验组兔分别死亡3只和2 只,16 周无死亡,死亡兔予以补足。对照组无死亡。MRI 检查:对照组兔股骨头为正常信号影;实验组兔股骨头T1 加权像显示股骨头斑块状中度信号影,T2 加权像表现为不均匀高信号影,伴随关节积液(图1)。HE 染色:对照组骨小梁完整,空骨陷窝少见(图2A);实验组骨小梁变细、断裂,骨小梁内空骨陷窝增多,髓腔组织中脂肪细胞直径增大(图2B~D)。股骨头内空骨陷窝率(%):2 周实验组(13.91±2.20)、8周实验组(16.98±1.73)和16 周实验组(20.74±1.92)明显高于同期对照组(7.83±1.25)、(8.71±1.63)和(8.98±1.72),差异均有统计学意义(t=7.599,P=0.000;t=11.002,P=0.000;t=14.427,P=0.000)。
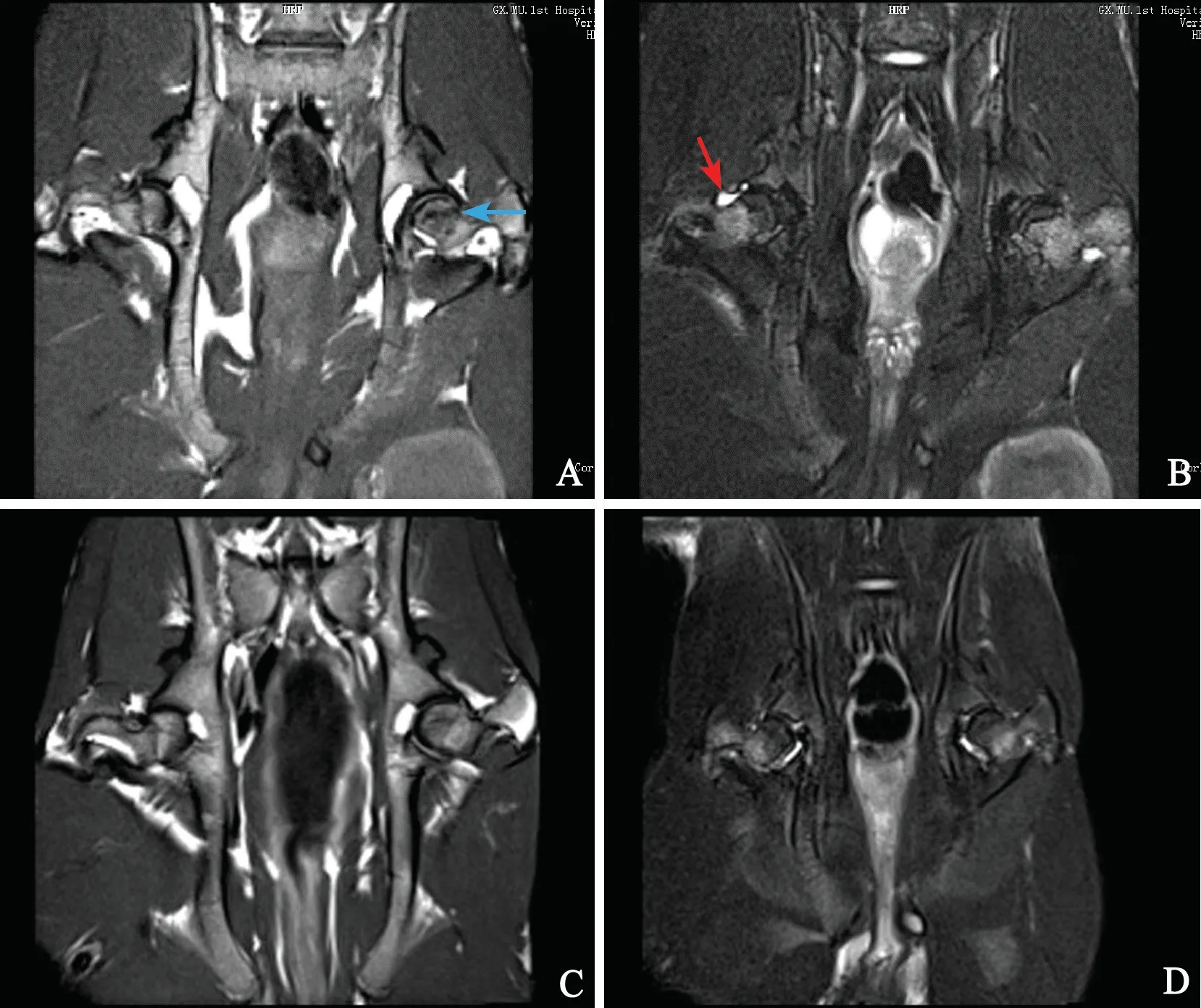
图1 股骨头MRI 检查结果A:实验组T1 加权像 B:实验组T2 加权像 C:对照组T1 加权像 D:对照组T2 加权像蓝色箭头指斑块状信号影 红色箭头指关节积液Fig.1 MRI imaging of bilateral femoral headsA:T1WI coronal scan of rabbits in the model group; B:T2WI coronal scan of rabbits in the model group; C:T1WI coronal scan of rabbits in the control group; D:T2WI coronal scan of rabbits in the control groupBlue arrow:plaque signal shadow;Red arrow:joint effusion
经MRI 检查和HE 染色筛选,2 周和8 周实验组分别有3 只和1 只动物股骨头未出现典型坏死而被剔除。模型成功率为70%。
2.2 免疫组织化学染色检测Cx43 表达
免疫组织化学染色阳性为棕黄色,正常情况下Cx43 阳性表达于成骨细胞、骨细胞及髓腔中。检测发现,对照组股骨头强阳性表达Cx43,2 周、8 周和16周实验组较对照组染色明显减弱。IOD 结果显示:2周实验组IOD(39.43±4.47)较2 周对照组(59.23±7.90)降低,差异有统计学意义(t=6.898,P=0.000);8 周实验组IOD(32.34±4.52)较8 周对照组(61.53±5.65)明显降低,差异有统计学意义(t=12.757,P=0.000);16 周实验组IOD(27.14±6.50)较16周对照组(60.77±6.36)明显降低,差异有统计学意义(t=11.694,P=0.000),见图3。
2.3 原位杂交检测结果
原位杂交检测,紫蓝色为阳性MiR-206,核为粉红色。实验组miR-206 强阳性表达于髓腔、成骨细胞和少量骨细胞内,对照组miR-206 仅少量表达于髓腔和成骨细胞内(图4)。
2.4 qPCR 检测结果
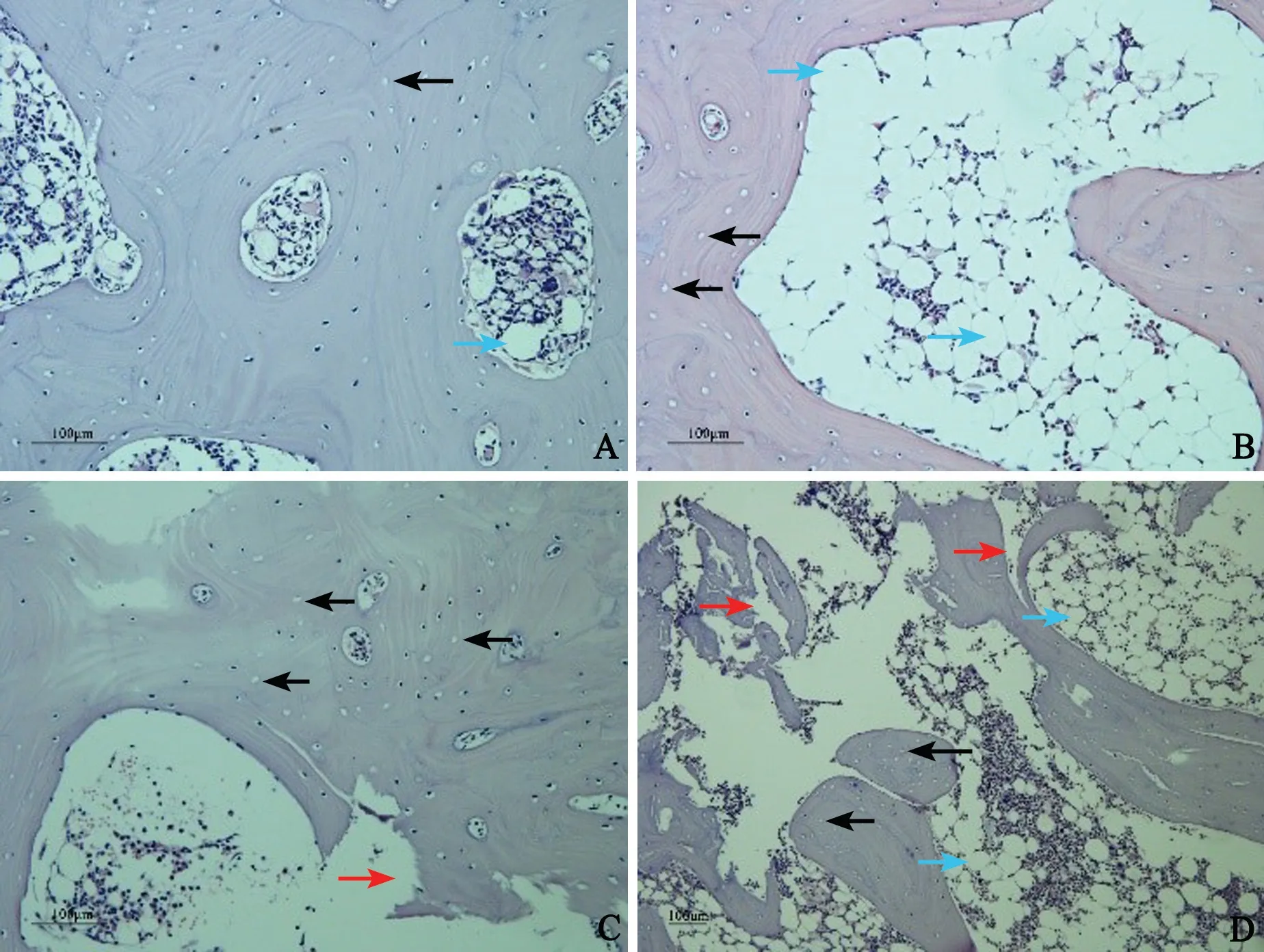
图2 股骨头组织病理检查结果(HE 染色)A:对照组 B:2 周实验组 C:8 周实验组 D:16 周实验组蓝色箭头指脂肪细胞 黑色箭头指空骨陷窝 红色箭头指断裂的骨小梁Fig.2 HE staining of the femoral heads in the two groupsA: control group; B:model group of 2 weeks; C:model group of 8 weeks; D:model group of 16 weeks; Blue arrow: fat cells;Black arrow:empty lacuna; Red arrow:fractured trabecular bone
图3 免疫组织化学染色检测Cx43A:对照组股骨头Cx43 强阳性表达于骨小梁边缘成骨细胞,骨细胞和髓腔内 B:2 周实验组股骨头Cx43 阳性表达于成骨细胞和髓腔内 C:8 周实验组股骨头内Cx43 弱阳性表达于成骨细胞和髓腔内 D:16 周实验组股骨头内Cx43 弱阳性表达于成骨细胞和髓腔内 E:Cx43 免疫组织化学染色IOD 比较*与同期对照组比较,P<0.01Fig.3 Cx43 ISH stainingA:Cx43 of the femoral head of the control group was positively expressed on the trabecular bone marginal osteoblasts,osteocytes and intramedullary cavity;B: Cx43 of the 2 weeks model group was positively expressed on osteoblasts and intramedullary cavity; C: Cx43 of the 8 weeks model group was weak expressed on osteoblasts and intramedullary cavity; D:Cx43 of the 16 weeks model group was weak expressed on osteoblasts and intramedullary cavity; E:IOD comparison of Cx43 ISH staining;*Compared with the control group at corresponding time points,P <0.01
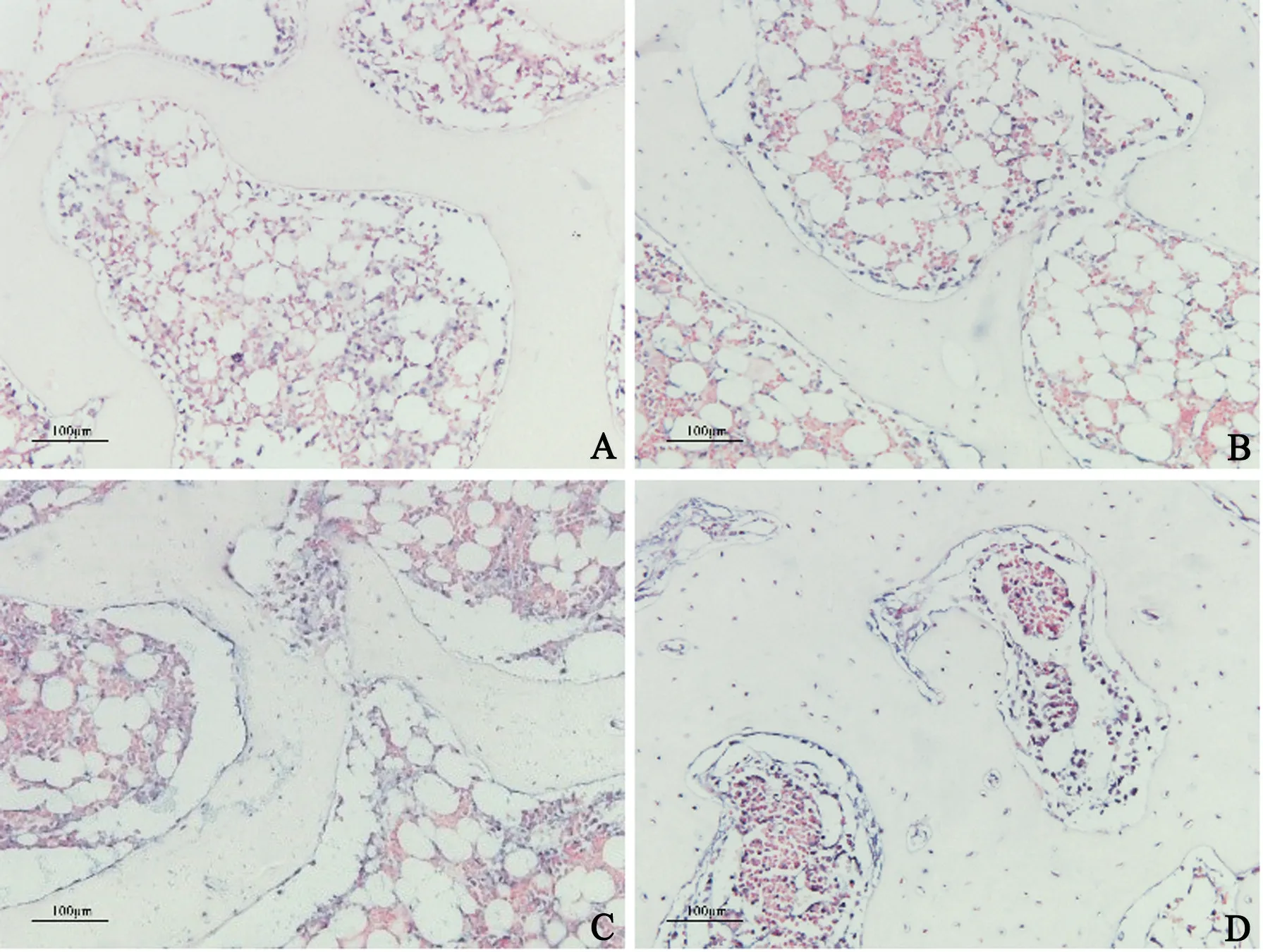
图4 原位杂交检测miR-206对照组(A)股骨头内仅少量miR-206 表达于髓腔和成骨细胞内,2周(B)、8 周(C)和16 周(D)实验组股骨头内见大量miR-206 表达于成骨细胞、骨细胞及髓腔Fig.4 ISH of miR-206A: Only a small amount of miR-206 expression was in the medullary cavity and osteoblasts in the femoral head of the control group; B,C and D:A large amount of miR-206 expression was in osteoblasts,osteocytes and medullary cavity in the femoral head of model group at 2、8 and 16 weeks
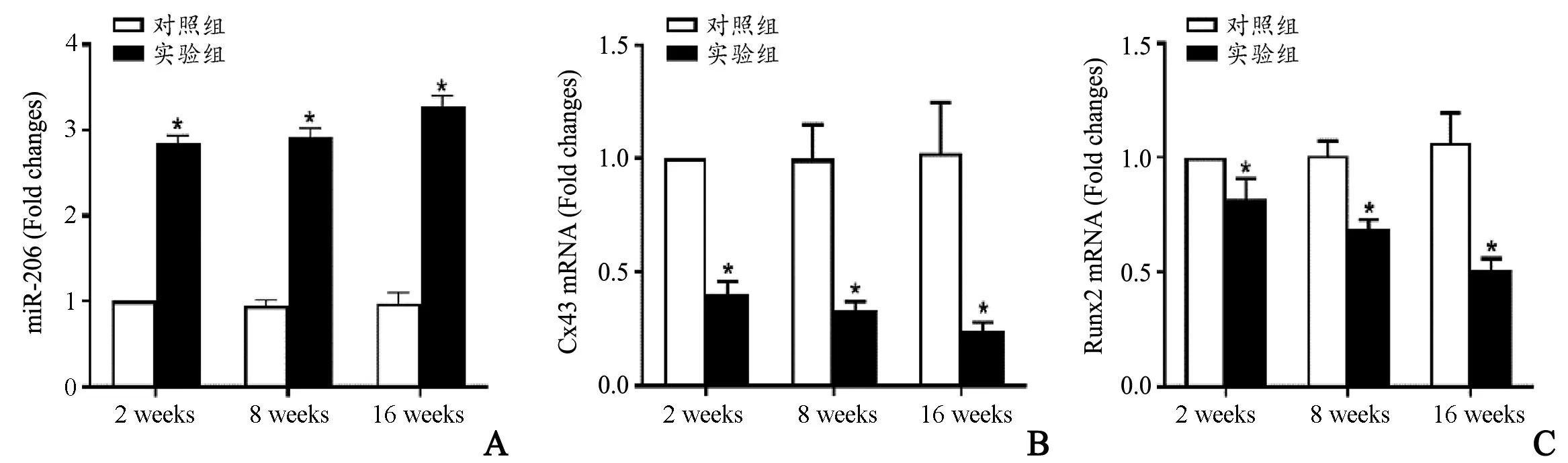
图5 qPCR 检测2 周、8 周、16 周实验组和对照组miR-206(A)、Cx43(B)和Runx2(C)相对表达量统计图*与对照组比较,P<0.05Fig.5 qPCR of miR-206(A)、Cx43(B)and Runx2(C)in model group and control group at different times*Compared with the control group,P<0.05
qPCR 检测显示,miR-206 在实验组股骨头内表达较对照组上调,造模后第2 周、8 周和16 周,实验组股骨头内miR-206 表达量与对照组股骨头内miR-206 表达量的比值即2-△△ct为(2.85±0.09)、(2.91±0.11)和(3.28±0.12),差异有统计学意义(t=45.961,P=0.000;t=38.825,P=0.000 和t=42.484,P=0.000);Cx43、Runx2 mRNA 在实验组股骨头内表达较对照组均减少,造模后第2 周、8 周和16 周,实验组股骨头内Cx43 表达量与对照组股骨头内Cx43 表达量的比值即2-△△ct为(0.40±0.06)、(0.33±0.04)和(0.24±0.04),差异有统计学意义(t=-18.424,P=0.000;t=-37.442,P=0.000 和t=-42.472,P=0.000);实验组股骨头内Runx2 表达量与对照组股骨头内Runx2 表达量的比值即2-△△ct为(0.82±0.09)、(0.69±0.04)和(0.51±0.05),差异有统计学意义(t=-4.472,P=0.002;t=-17.324,P=0.000和t=-21.909,P=0.000),见图5。
2.5 Western blot 检测
造模后2 周、8 周和16 周,Western blot 分析显示,实验组股骨头内Cx43、Runx2 蛋白相对表达量均低于对照组股骨头,组间差异有统计学意义(P<0.05);造模后2 周实验组股骨头内磷酸化ERK1/2 表达量与对照组无统计学差异(P>0.05),造模后8 周和16 周,实验组股骨头内磷酸化ERK1/2 相对表达量均低于对照组,组间差异有统计学意义(P<0.05)(图6)。
3 讨论
3.1 成骨分化与SANFH
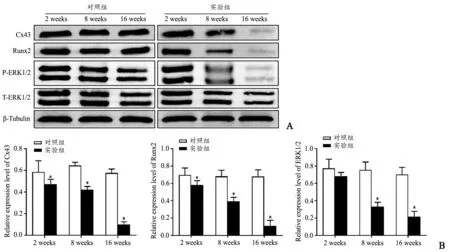
图6 免疫印迹检测2 周、8 周、16 周实验组和对照组Cx43、ERK1/2 和Runx2 相对表达量(A)及其统计图(B)*与对照组比较,P<0.05Fig.6 Immuno blotting results A:Western blot of Cx43,ERK1/2 and Runx2 in model group and control group at 2,8,16 weeks;B:Relative expression of Cx43,ERK1/2 and Runx2 in model group and control group at 2,8,16 weeks*Compared with the control group,P <0.05
骨的发育塑形由成骨细胞、骨细胞和破骨细胞协同完成,成骨细胞参与骨基质的合成、分泌及矿化等,在骨发育成熟和修复重建过程中起重要作用。研究发现,SANFH 模型中成骨细胞分化能力显著下降,成骨细胞数量减少及功能降低引起成骨分化不足,引发早期股骨头坏死修复障碍[6]。激素可上调成脂相关基因(如PPAR-γ),同时下调成骨相关基因(如Runx2/Cbfa1),导致间充质干细胞成脂分化增加而成骨分化减少,成骨细胞生成减少[7,8]。自体成骨细胞移植可有效改善股骨头坏死后的修复[9]。Runx2 属于runt 结构域基因家族,能够激活并启动MSCs 向成骨细胞系分化。应用地塞米松诱导大鼠SANFH 模型研究发现,模型鼠股骨头内Runx2 和osterix 基因表达、蛋白合成均较对照组减少[10]。本实验应用内毒素联合激素诱导兔SANFH 模型发现,实验组兔股骨头内Runx2 基因及蛋白表达均低于对照组,且随时间推移有下降趋势。以上结果表明,成骨分化在早期SANFH 中发挥重要作用,激素可能通过抑制成骨分化影响正常骨代谢,参与SANFH 的发生发展及修复过程。
3.2 miR-206 及其靶蛋白Cx43 在SANFH 中的作用
MicroRNA 是动植物中广泛存在的一类分编码单链小分子RNA,在调节正常细胞增殖、分化及凋亡方面发挥重要作用,与骨的正常发育、塑形和维持密切相关[11]。早期研究认为miR-206 特异性表达于骨骼肌[12],而Inose 等[13]、Zhang 等[14]发现成骨细胞同样表达miR-206。在C2C12 细胞成骨分化过程中,miR-206 下调,而过表达miR-206 则可抑制成骨细胞分化。在人骨髓间充质干细胞成骨诱导的第7 d 和第14 d,miR-206表达显著下调,miR-206 过度表达的BMSCs 碱性磷酸酶(ALP)活性减弱,成骨标志物Runx2 和骨桥蛋白(OPN)的mRNA 水平显著下调[15]。进一步研究表明,骨组织中一个重要的缝隙连接蛋白Cx43 是miR-206的靶蛋白,Anderson 等[16]研究表明,Cx43 基因的3,非翻译区有两个可以与miRNA-206 完全互补的序列,从而抑制Cx43 mRNA 的翻译,减少Cx43 表达,以减少正在生成的肌纤维间的通讯,进而促进肌肉细胞分化。Inose 等[13]研究显示在成骨细胞转染miR-206 后,Cx43 蛋白表达减少,成骨细胞分化能力减弱,而转染anti-miR-206 后,Cx43 蛋白的表达增加,促进成骨细胞分化。
Cx43 可通过调控骨细胞和成骨细胞功能参与骨的发生与塑形。在MC3T3-E1 成骨细胞中,过表达Cx43 会加强Runx2 的依赖性转录活性;反之,以siRNA 干扰Cx43 表达,Runx2 则受到抑制[17]。骨髓基质细胞成骨分化过程中Cx43 表达明显增加,慢病毒介导的Cx43 表达下调后,成骨分化被抑制[18]。本研究显示,miR-206 表达定位于股骨头骨小梁周边的骨细胞、成骨细胞及髓腔内,且实验组股骨头内表达较对照组增多;Cx43 及其mRNA 在实验组股骨头内表达均低于正常组。推测miR-206 可能通过下调Cx43导致了SANFH 的进展。值得一提的是,本研究观察到实验组股骨头Cx43 mRNA 水平也降低,此结果和Inonse 等[13]研究结论有所出入,推测可能存在其他miRNA 或信号通路在SANFH 病程中对Cx43 基因转录具有调节作用,这需进一步研究。
3.3 ERK1/2 信号通路在SANFH 中的作用
本研究结果显示,各时期实验组兔股骨头内ERK1/2 蛋白磷酸化水平均低于对照组,说明ERK1/2信号通路在SANFH 中被抑制。ERK1/2 通路是丝裂原活化蛋白激酶(MAPKs)系统中最为重要的通路之一,MAPKs 是细胞内执行信号级联放大的一种蛋白,可将信号从细胞表面传导至细胞核的重要介质,参与细胞生长发育、分裂活化和凋亡等多个生理过程。而ERK1/2 通路与成骨细胞增殖和分化密切相关[19,20]。细胞外信号如生长因子,与细胞膜上相应受体结合促进ERK 磷酸化,促进成骨转录因子Runx2 和osterix 表达,进而促进成骨细胞的分化和增殖[21]。Cx43 半通道开放可借助激活ERK1/2 信号通路,抑制促凋亡蛋白Bad,激活CAAT/增强子结合蛋白β(C/EBP β)的抗凋亡作用,从而抑制细胞凋亡,促进成骨细胞和骨细胞存活[22]。Cx43 高表达还可激活ERK1/2 信号通路,促进成骨相关转录因子Runx2 表达[4]。本研究发现实验组兔股骨头内Cx43、Runx2 基因表达下调,Cx43、ERK1/2、Runx2 蛋白表达也下调,表明SANFH 兔模型Cx43 下调,抑制了ERK1/2 信号通路,导致成骨分化障碍和骨细胞凋亡增加,参与SANFH 的发生发展。
据此推测,miR-206 可通过调低Cx43 水平,导致骨细胞间通讯“故障”,进而成骨障碍,最终引发SANFH;更进一步,Cx43 低表达可影响其下游ERK1/2 通路,引起成骨细胞分化障碍,参与SANFH 的发展过程。miR-206 和其目的蛋白Cx43、ERK1/2 或许是SANFH 诊疗新的切入点,miR-206 抑制剂可能对SANFH 的防治有正面效果。

