TTLL12过表达对口腔鳞癌SCC-25细胞株生物学特性的影响
曾 艳,薛伶俐,方 川,程 维,李雅冬
(重庆医科大学附属第一医院颌面外科 400016)
口腔鳞癌是头颈部肿瘤中最常见的恶性肿瘤之一[1]。虽然目前临床治疗口腔鳞癌的方法较多,但由于其易复发和转移[2-3],在过去的几十年中,存活率仍没有得到明显的提高,且发病率还在逐年升高[4]。伴随着肿瘤发展并对邻近组织的侵袭,会严重影响患者的言语、进食、吞咽、呼吸等功能,从而大大降低患者的生存质量[5]。因此,临床迫切需要找到新的有效的治疗方法。
众所周知,癌症的生物学基础是抑癌基因的失活或原癌基因的激活,从而导致细胞不受控制的增殖和异常的凋亡,因此,癌症的发生和发展与原癌基因密切有关[6]。本课题组曾经报道,在头颈肿瘤中发现微管蛋白酪氨酸连接酶类似物12(tubulin tyrosine ligase like 12,TTLL12)可通过阻碍硝基化酪氨酸与微管蛋白的结合,而促进头颈鳞癌的生长,具有潜在原癌基因的作用[7]。但目前,对于TTLL12在细胞内的分布尚不清楚,这为进一步深入研究TTLL12的作用机制造成了不小的障碍,本文将主要阐述近期本课题组的研究成果,以期为口腔鳞癌的治疗提供理论基础。
1 材料与方法
1.1 材料
人舌磷癌SCC-25细胞株由重庆医科大学中心实验室提供,培养液成分:伊格尔培养基、10%小牛血清、1 mmol/L丙酮酸钠、40 μg/mL庆大霉素(美国Sigma公司)。激光共聚焦扫描显微镜(德国 Leica),CF15型低温离心机(德国Heraeus公司)。四甲基偶氮唑蓝(MTT)、Boyden 小室、siRNA及脂质体LipofectamineTM2000(Sigma公司),内参TATA结合蛋白(TATA-binding protein,TBP)抗体、TTLL12抗体、β微管蛋白(β-tubulin)抗体(美国Sigma公司),Na+/K+-ATPase α1抗体(美国Proteintech公司),YG-875型超净工作台、CO2孵箱(美国Bio-Rad公司)。
1.2 方法
1.2.1建立TTLL12过表达的SCC-25细胞株
利用慢病毒将TTLL12 cDNAs转染入SCC-25细胞,筛选稳定高表达TTLL12的细胞株(过表达组),同时利用空白质粒转染入SCC-25细胞,建立空白对照组。
1.2.2Western blot
收集细胞,PBS清洗2遍,加入细胞裂解液,收集裂解产物,煮沸变性,行蛋白电泳,转硝酸纤维素膜,5%的牛奶封闭1 h,依次加入一抗,4 ℃孵育过夜,加二抗(辣根过氧化物酶标记鼠抗兔IgG抗体,1∶1 000稀释),室温下孵育2 h,TBST洗涤3次,每次10 min后,利用DAB显色试剂盒进行化学发光反应并拍照。用美国BioRad公司Quantity One系统进行灰度分析,以目的蛋白条带与内参蛋白条带的灰度值比值为目的蛋白相对表达水平。
1.2.3间接免疫荧光法检测
待过表达组和空白对照组SCC-25细胞爬满玻片后,弃去培养液,用100%乙醇固定细胞,然后依次与一抗和二抗孵育60 min。 取出玻璃片,用滤纸吸去多余水分,滴加一滴甘油缓冲液(甘油和pH7.4 PBS液以9∶1体积混合而成),再覆以盖玻片。荧光显微镜高倍视野下观察,判定结果。
1.2.4TTLL12在SCC-25细胞内的分布检测
取稳定过表达TTLL12的SCC-25细胞株,PBS清洗两遍,分别提取总细胞蛋白、细胞质蛋白、细胞核蛋白和细胞膜蛋白。加入细胞裂解液裂解细胞,收集裂解后产物,得到总细胞蛋白。室温下1 000 r/min离心5 min,弃去上清夜,轻弹管底,将离心管置于冰面,加入600 μL冷bufferA,振荡15 s,置于冰面15 min,加25 μL 10% NP40,振荡 5 s,置于冰面10 min,在4 ℃下10 000×g离心5 min,轻轻吸取上清液为细胞质蛋白,PBS清洗2遍,在4 ℃下10 000×g离心5 min,将离心管置于冰面,加100 μL冷bufferC,反复振荡,在冰面上静置40 min,在4 ℃下13 000×g离心20 min,轻轻吸取上清液为细胞核蛋白,PBS清洗2遍,获得细胞核膜蛋白。利用各组蛋白进行Western检测TTLL12的分布。
1.2.5沉默TTLL12在SCC-25细胞内的表达
将1×105/mL浓度的SCC-25细胞接种于24孔培养板中,加伊格尔培养基,于37 ℃,5% CO2培养箱内培养,待细胞长至70%时,进行siRNA转染。参照LipofectamineTM2000试剂说明操作,干扰组siTTLL12序列:5′-GGU UGU UCG UGU AUG AUG U-3′,转染空白对照序列的为对照组,转染24 h后,收集细胞,利用Western blot检测TTLL12的表达情况。
1.2.6四甲基偶氮唑蓝(MTT)法检测细胞增殖
将干扰组与对照组细胞制成单细胞悬液,接种到96孔培养板内,使每孔细胞数为2 000个,在37 ℃的CO2孵箱中孵育,每24小时检测1次,共9 d,检测前在每个孔内加入MTT(5 mg/mL)10 μL,放入CO2孵箱中孵育4 h,去上清液,每孔加入二甲基亚砜与0.04 mol/L盐酸的混合物150 μL,震荡1 h后,再利用酶标仪在570 nm波长处比色,每次检测至少6个孔,最后取其平均值。
1.2.7Boyden小室侵袭试验
将Boyden小室放入每孔加有500 μL含10%胎牛血清的6孔培养板中,Boyden小室中加入500 μL不含胎牛血清的培养基,取浓度为4×105/mL的各组细胞悬液200 μL加入Boyden小室,37 ℃孵育4 h后,取出Boyden小室,滤膜下层向上,PBS洗涤,3%戊二醛固定,苏木素染色,用棉花棒擦净小室滤膜上层未侵袭的细胞。使用倒置显微镜进行观察和拍照,计算出穿过滤膜的细胞百分比。
1.3 统计学处理
2 结 果
2.1 TTLL12在SCC-25细胞的表达分析
经Western blot检测结果显示过表达组TTLL12相对表达水平较空白对照组明显增强,证明TTLL12稳定高表达的SCC-25细胞株成功建立,见图1。间接免疫荧光试验结果显示过表达组SCC-25细胞内有亮红色荧光,分布于细胞质、细胞核和细胞核膜,而空白对照组SCC-25细胞内仅有较暗、较浅的红色荧光,见图2。间接免疫荧光试验结果还显示TTLL12与α-tubulin的分布重合,见图3。
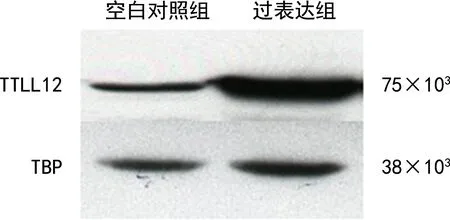
图1 Western blot检测TTLL12在SCC-25细胞的表达
2.2 TTLL12在细胞内的分布
Western blot结果显示在细胞总蛋白中,TTLL12、β-tubulin、TBP和Na+/K+-ATPase α1均有条带显示;在细胞质蛋白中,TTLL12和β-tubulin有条带显示;在细胞核蛋白中,TTLL12和TBP有条带显示;在细胞核膜蛋白中,TTLL12和Na+/K+-ATPase α1有条带显示,见图4。
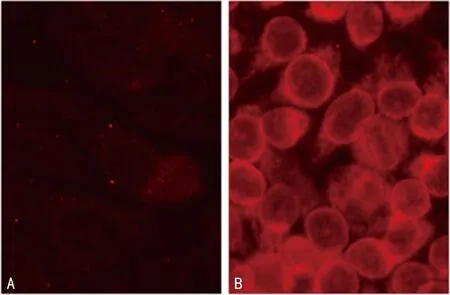
A:空白对照组;B:过表达组。
2.3 干扰TTLL12在SCC-25细胞内的表达
利用siRNA沉默TTLL12的表达,经Western blot检测结果显示干扰组TTLL12蛋白较对照组降低,见图5。
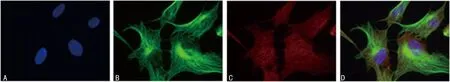
A:细胞核;B:α-tubulin;C:TTLL12;D:重合。
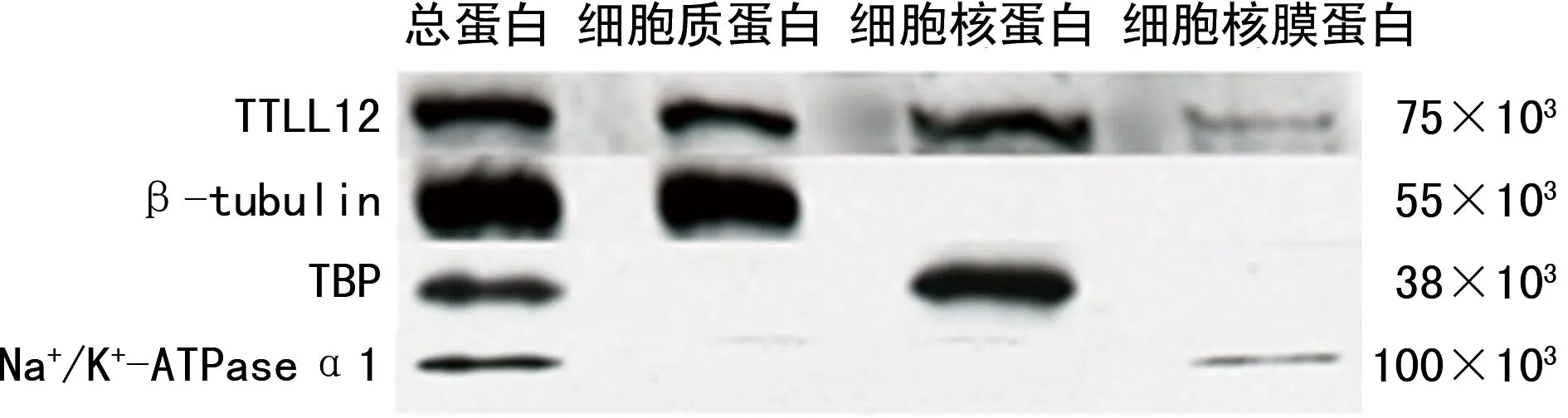
图4 Western blot检测TTLL12在SCC-25细胞中的分布
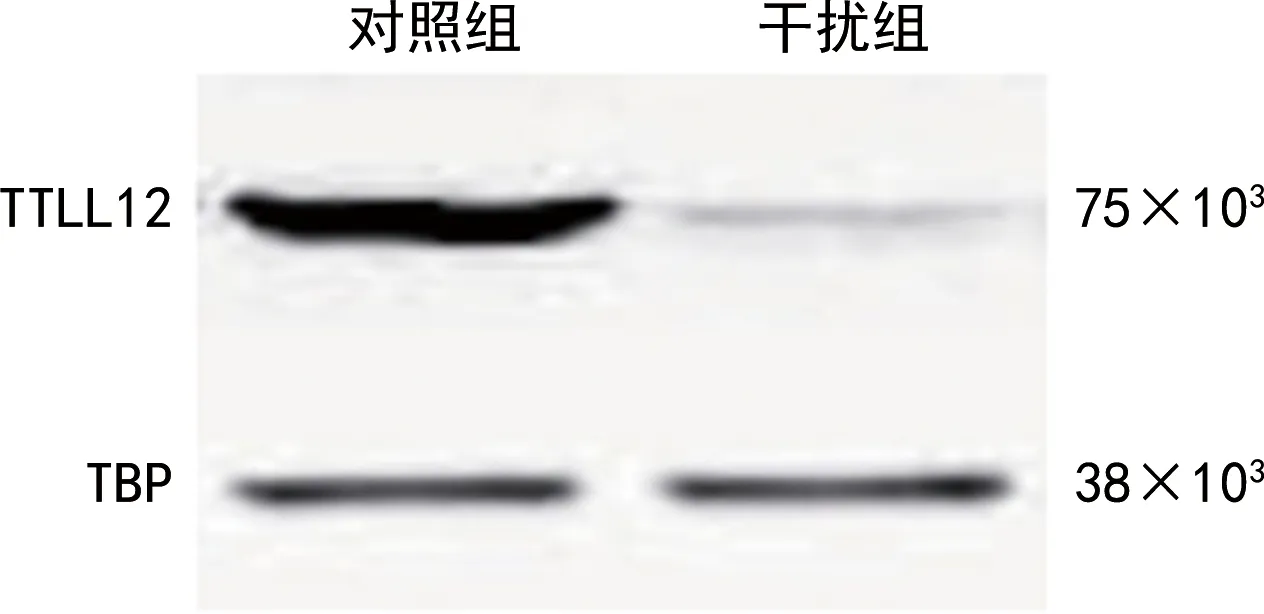
图5 干扰TTLL12在SCC-25细胞内的表达
2.4 干扰TTLL12对SCC-25细胞生长的影响
MTT法检测SCC-25细胞生长的情况,结果表明,干扰组SCC-25细胞的生长较对照组受到明显抑制(P<0.05),见图6。

图6 SCC-25生长曲线
2.5 干扰TTLL12对SCC-25细胞侵袭的影响
Boyden小室侵袭试验结果表明,干扰组穿过滤膜的细胞百分比为(31±2)%,对照组穿过滤膜的细胞百分比是(56±5)%,干扰组SCC-25细胞穿过滤膜的细胞百分比较对照组明显减少,差异有统计学意义(P<0.05),见图7。
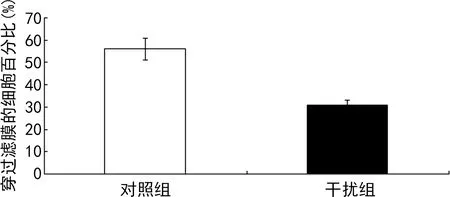
图7 Boyden小室侵袭试验
3 讨 论
口腔鳞癌的发生发展是一个逐级进行的复杂生物学过程,其中,原癌基因的过表达在肿瘤的发生发展中扮演着重要的角色[8]。笔者曾经报道在头颈鳞癌中,TTLL12具有潜在原癌基因的作用[7]。近年,有学者发现TTLL12在肺腺癌、结肠腺癌、直肠腺癌、前列腺癌和肺癌中表达明显升高,并与患者的不良预后密切相关(P<0.05)[9-12]。还有一些学者发现TTLL12与人体免疫有关,例如PENG等[13]发现,和HIV阴性的健康人比较,TTLL12在HIV阳性患者中的表达升高,表明TTLL12可能与先天免疫调节,免疫缺陷综合征的疾病进展和HIV-1复制相关。JU等[14]发现TTLL12可以抑制抗病毒的RIG-I通路活性,从而增强RNA病毒在细胞内的复制能力,LORENZ等[15]发现在发生急性闭角型青光眼后的0~12周,TTLL12在患者的血清中的表达呈线性增长趋势。
根据目前的研究成果可知,TTLL12具有SET和TTL结构域,而TTLL12的TTL结构域缺少其他家族成员所保留的7个基序中的3个。TTLL12的TTL结构域可能与TTLL12参与微管修饰功能有关[16-17]。有研究认为在真核细胞的进化过程中,TTLL12的SET结构域可能对异染色质和常染色质的形成起到非常重要的作用[18]。另外,TTLL12高表达会导致H4K20表达升高,很可能与TTLL12的SET结构域有关[17,19]。但TTLL12在细胞内的分布及生物学功能尚不清楚。
了解和掌握TTLL12在细胞中的分布,对进一步研究TTLL12的功能至关重要,因此,本研究利用间接免疫荧光法和Western blot率先证实TTLL12主要分布在细胞质、细胞核及细胞核膜,细胞质内的α-微管蛋白与TTLL12的分布一致,这一结果很好地解释了TTLL12的已知功能。笔者前期实验证实TTLL12会干扰硝基化酪氨酸与微管蛋白的结合。在真核细胞中,α-tubulin主要分布在细胞质内,参与形成细胞骨架、维持细胞形态、细胞移动、细胞内各种物质的运输及细胞的分裂等,与细胞的正常生命活动密切相关。硝基化酪氨酸与α-tubulin结合,形成硝基化酪氨酸微管蛋白,影响微管的功能,导致细胞凋亡。TTLL12可能利用TTL结构域的微管蛋白酪氨酸连接酶活性,与细胞质中的α-tubulin结合,从而阻碍了硝基化酪氨酸与α-tubulin的结合,最终促进头颈鳞癌的生长[7]。分布在细胞核和细胞核膜的TTLL12很可能与染色体数量明显增多[17],H4K20表达升高[19],HIV-1复制[13]有关,而这些功能很可能与TTLL12的SET结构域有关。由此可见,搞清楚了TTLL12的分布,可以更好地理解TTLL12的各种功能,同时也为下一步研究奠定了良好的基础。
另外,在沉默TTLL12的表达后,本研究利用MTT试验和Boyden小室侵袭试验检测细胞生长和侵袭能力的变化,结果表明沉默TTLL12会导致SCC-25细胞生长变慢,侵袭能力变弱。这说明沉默TTLL12可有效抑制SCC-25细胞的生长和侵袭,其原因可能是,沉默TTLL12后,阻断了TTLL12对微管的影响作用。微管与细胞周期和细胞移动密切相关[20-21],在细胞间期时,α-tubulin聚合形成微管,形成细胞内的网架结构,当细胞进入分裂期时,核膜分解,α-tubulin解聚,然后重新聚合形成纺锤体,并引导染色体运动,在分裂末期,纺锤体又会发生解聚,重新形成细胞质内的网架结构,核膜重新形成。当细胞移动时,会发生形状改变,伪足形成,这些都需要微管的参与[22]。在沉默TTLL12后,TTLL12对微管的作用也会消失,从而导致细胞生长变慢,侵袭能力变弱。TTLL12在核膜也有分布,这或许影响了有丝分裂时的核膜分解和形成。但其具体作用机制尚需进一步研究。
综上所述,TTLL12分布于细胞质、细胞核及细胞核膜。由于其分布较广,TTLL12很可能还有一些其他功能尚未发现,需进一步研究。沉默TTLL12会导致SCC-25细胞生长变慢,侵袭能力变弱。因此,TTLL12有望作为治疗口腔鳞癌的靶点之一。
——水芹主要害虫识别与为害症状

