套黄、白袋凯特芒果采后果实糖代谢的比较研究
吴丽娜 朱玉燕 宦 晨 徐启航 李生娥 郑小林
(1浙江工商大学食品与生物工程学院,浙江 杭州 310018;2德清秋水果汁有限公司,浙江 德清 313216)
果实在生长发育阶段实施套袋,能有效防治病虫和鸟的危害,也能防止日灼对果皮的伤害,避免风、雨、枝梢等对果实造成的机械损伤,防止果面产生锈斑,提高果面光洁度,改善外观品质,提高好果率;此外,套袋还会影响果实采后的成熟衰老和贮藏性[1-2]。目前,果实套袋已成为现代果树栽培的一项重要技术,在我国芒果、苹果、葡萄等果树栽培中得到了广泛应用。凯特芒果(Mangifera indicaL.cv. Keitt)是从美国佛罗里达州引进的优质高产、大果型迟熟品种水果,已成为我国攀枝花等芒果产区的主栽品种。当前,攀枝花地区凯特芒果栽培中果实套袋率已达99%以上,套袋材料主要为黄袋和白袋[3]。然而,近几年的生产实践发现,芒果套袋加剧了采后果实的生理病害——软鼻病发病率,甚至会导致软鼻病爆发,严重影响果实的品质和商品率,而且套不同颜色纸袋使采后果实的软鼻病发病率和贮藏性出现差异[4]。
果实的风味受多种成分的协同作用,蔗糖、果糖和葡萄糖等可溶性糖和有机酸是决定口感的重要物质基础。采后果实的糖代谢主要受蔗糖代谢相关酶活性的调控,蔗糖代谢相关酶的协同作用很大程度上决定了果实可溶性糖的组成与积累[5]。近年来,有关果实采后糖代谢及其调控已有大量的研究报道[5-8]。在贮藏过程中,凯特芒果果实有机酸含量变化不大,其糖酸比主要受可溶性糖含量的影响[4]。郑小林课题组前期研究发现采前套黄袋、采前除袋或除袋后喷施钙素等处理对凯特芒果采后果实有机物质的代谢转化,尤其是对果实蔗糖代谢具有一定的影响[9]。Shivashankar[10]对芒果生理紊乱及生理病害进行了文献综述,但关于采前套黄、白袋对芒果采后果实糖代谢和生理病害等方面的研究尚鲜见报道。因此,研究采前套袋对芒果采后果实糖代谢及相关酶变化的影响,并初步探究糖代谢与软鼻病之间的联系,对于提高芒果果实品质及商品价值具有重要意义。为此,本试验以套黄、白袋凯特芒果果实为材料,通过测定果实(好果和软鼻病发病果)可溶性总糖、葡萄糖、果糖、蔗糖及淀粉含量,淀粉酶、酸性转化酶(acid invertase,AI)、中性转化酶(neutral invertase,NI)、蔗糖磷酸合成酶(sucrose phosphate synthase,SPS) 和蔗糖合成酶(sucrose synthase,SS)活性,研究采前套黄、白袋凯特芒果采后果实软鼻病发病率、果实硬度和糖代谢之间的关联性。
1 材料与方法
1.1 材料与试剂
凯特芒果生长于四川省攀枝花市仁和区金沙镇农业农村部芒果绿色生产示范基地,在芒果谢花后约40~50 d,分别选用黄袋和白袋两种类型纸袋对果实套袋。其中,黄袋:内黑外黄的复合纸,内外层纸规格均为30.85 cm(长)×19.50 cm(宽),内外纸定量分别为30 和50 g·m-2,撕裂度分别为200 和240 kN·m-1;白袋:白色单层纸,规格为32.00 cm(长) ×21.20 cm(宽),定量为40 g·m-2,撕裂度为250 kN·m-1。当套黄袋和白袋果实发育成熟达到7.5 成熟时,除去果袋,采摘大小基本一致的果实,当天空运(常温运输,不加冰)到杭州实验室。在攀枝花地区,不套袋芒果灼伤率高,果实蝇寄生产卵十分严重,导致果实商品采收期的好果率往往低于10%;同时,不套袋芒果果实后熟软化快,无参比性,所以本试验未选择不套袋果实作为对照。
乙酸乙酯、无水乙醇、蒽酮、高氯酸(HClO4)、冰乙酸、氢氧化钠(NaOH)、Triton X-100、浓硫酸(H2SO4),均为分析纯,上海国药集团化学试剂有限公司;乙腈、果糖、蔗糖、麦芽糖(色谱纯)、柠檬酸、葡萄糖(色谱纯)、柠檬酸钠、可溶性淀粉、3,5-二硝基水杨酸(3,5-Dinitrosalicylic acid,DNS)溶液、磷酸二氢钠、磷酸氢二钠、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、 巯基乙醇、尿苷二磷酸葡萄糖(uridine diphosphate glucose,UDPG)、乙酸钠、果糖-6-磷酸、葡萄糖-6-磷酸、氯化镁(MgCl2),杭州常盛科教器具厂;SPS 测试盒和合SS 测试盒,南京建成生物工程研究所。
1.2 仪器与设备
FHM-1 硬度计,日本竹村电机制作所;AF-10 制冰机,美国SCOTSMAN 公司;Milli-Q 超纯水装置,美国MILLIPORE 公司;AB135-S 电子天平,瑞士METTLER TOLED 公司;3-30K 高速离心机,德国SIGMA 公司;FE28 pH 计,上海梅特勒-托利多仪器有限公司;HH-S数显恒温水浴锅,郑州长城科工贸公司;SHZ-D(Ⅲ)循环水真空泵,南京文科仪器科技有限公司;安捷伦1100 高效液相色谱仪,美国安捷伦公司;UV 1800 紫外分光光度计,日本岛津公司。
1.3 试验方法
1.3.1 试验预处理 将运回实验室的芒果分别以8个果为一组放入框内,框外套0.04 mm 厚的PE 薄膜袋,袋口自然合拢,置于温度25±1℃,相对湿度65%~70%条件下贮藏。于贮藏0 d(采摘当天)、3 d(果实开始变软时,根据以往研究,采后第3 天为芒果的呼吸跃变关键时间点)、10 d(果实完全变软时)分别取套黄袋和套白袋的60 个成熟度一致、外表无机械损伤的果实,用清水逐个洗净,自然风干,然后将果实分别随机分为3 组,每组20 个,沿纵轴将芒果逐个对半切开,分别统计软鼻病发病率。取样时分别取好果和软鼻病发病果赤道处果皮和果肉,分别将果皮、果肉切碎、混匀后用液氮速冻,然后保存于-80℃超低温冰箱,用于测定各指标,每个指标平行测定3 次。
1.3.2 软鼻病发病率统计 根据软鼻病发病典型症状[9]判断果实是否发病,记录发病果实数量,并计算软鼻病发病率:

1.3.3 硬度的测定 每次每组随机挑选10 个果实,削去表皮,于赤道部位选取2 个点,用硬度计(量程5 kg)进行测定,取平均值。重复3 次。
1.3.4 可溶性总糖含量的测定 参考曹建康等[11]的方法。称取0.3 g 芒果果肉置于研钵中匀浆后转入刻度试管中,加入10 mL 蒸馏水,用塑料薄膜封口,于沸水浴中煮沸提取30 min,取出待冷却后过滤,再向沉淀中加10 mL 蒸馏水煮沸提取10 min,将两次滤液转移至100 mL 容量瓶中,用蒸馏水反复漂洗试管及沉淀,过滤后全部转入容量瓶中,并定容至刻度作为提取液备用。吸取0.5 mL 样品提取液置于25 mL 刻度试管中,加1.5 mL 蒸馏水,然后向试管中先后加入0.5 mL蒽酮-乙酸乙酯和5.0 mL 浓硫酸,混匀,置于沸水浴中逐管保温1 min,在630 nm 波长处测定吸光度值,根据标准曲线计算样品可溶性总糖含量。重复3 次。
1.3.5 葡萄糖、果糖、蔗糖含量的测定 样品处理:参照林玲[12]的方法。称取1 g 速冻的果肉,在微波炉中灭活30 s 后加入5 mL 90%乙醇研磨、匀浆,10 000 r·min-1离心10 min,取上清液倒入刻度试管中,残渣再用5 mL 90%乙醇提取,按上述条件离心后合并上清液。然后于90℃水浴蒸干,加蒸溜水定容至2 mL。之后用一次性注射器抽取样液,用微孔滤膜针头过滤注入样品瓶中以分析测定。测定方法:采用高效液相色谱仪进行分析测定[色谱柱:Waters BEH Amide,2.5 μm,3.0 mm×150 mm(粒径,柱内径×柱长)]。开机脱气,洗柱子约20 min(流动相为80%乙腈+20%水+0.05%氨水),在柱温40℃条件下跑基线,基线稳定后开始进样,进样体积为5 μL,流速为0.4 mL·min-1。记录标样和样品的出峰时间和峰面积。同时,将分析纯葡萄糖、果糖、蔗糖在80℃条件下烘至恒重,精确称取配置成浓度梯度为2.00、 4.00、 6.00 和8.00 mg·mL-1的混标准溶液。用一次性注射器抽取样液,用微孔滤膜针头过滤注入样品瓶中,按上述进样步骤进行分析。
1.3.6 淀粉含量的测定 淀粉含量的测定参照曹建康等[11]的酸水解法。每个样品重复测定3 次。
1.3.7 淀粉酶活性的测定 酶液提取:取0.5 g 芒果果肉,加7 mL 去离子水研磨匀浆,在20℃条件下放置提取20 min,每隔数分钟摇动一次。8 000×g离心20 min,收集上清液定容至25 mL 容量瓶中保存备用。活性测定:淀粉酶活性的测定参考曹建康等[11]的方法。每个样品重复测定3 次。
1.3.8 AI 活性的测定 参照Nielsen 等[13]的方法。酶液提取:称取1 g 样品于预冷的研钵中,加入1 mL提取液(含5 mmol·L-1MgCl2,1 mmol·L-1EDTA,0.1%巯基乙醇和0.1% Triton X-100 的0.1 mol·L-1、pH 值7.5 的磷酸钠缓冲液),研磨匀浆后转入预冷的10 mL离心管中,用提取液冲洗研钵4 次,每次使用提取液1 mL。将匀浆液于4℃、10 000 r·min-1条件下离心15 min,收集上清液,将残渣用4 mL 提取液再离心提取一次,合并两次离心上清液,并用提取液定容至10 mL 作为酶提取液,4℃保存备用。活性测定:对照组:取酶提取液0.2 mL 于25 mL 的刻度试管中,在沸水中煮沸5 min,灭酶活,再加入0.9 mL 反应液(含1 g 蔗糖的0.1 mol·L-1、 pH 值5.5 的乙酸乙酸钠缓冲液)以及1.5 mL DNS 试剂,继续煮沸5 min,最后用蒸馏水定容至25 mL。试验组:取酶提取液0.2 mL 于25 mL 的刻度试管中,加入0.9 mL 反应液,于34℃水浴1 h,取出后煮沸5 min,灭酶活。再加入1.5 mL DNS 试剂,继续煮沸5 min,用蒸馏水定容至25 mL。于540 nm 波长处测定吸光度值。
1.3.9 NI 活性的测定 参照Nielsen 等[13]的方法。酶液提取方法同1.3.8。活性测定:对照组:取酶提取液0.2 mL 于25 mL 的刻度试管中,煮沸5 min,灭酶活,再加入0.9 mL 反应液(含1 g 蔗糖,10.17 mg MgCl2,29.2 mg EDTA 的0.1 mol·L-1、pH 值7.5 的磷酸钠缓冲液)以及1.5 mL DNS 试剂,继续煮沸5 min,最后用蒸馏水定容至25 mL。试验组:取酶提取液0.2 mL 于25 mL 的刻度试管中,加入0.9 mL 反应液,于34℃水浴1 h,取出后煮沸5 min,灭酶活。再加入1.5 mL DNS 试剂,继续煮沸5 min,用蒸馏水定容至25 mL。于540 nm 波长处测定吸光度值。以葡萄糖做标准曲线,计算样品中NI 活性。
1.3.10 SPS 和SS 活性的测定 酶液提取:准确称取1 g 芒果果肉置于预冷的研钵中,加入9 mL 测试盒中的植物酶提取液,冰浴研磨成10%的匀浆,4 000 r·min-1离心15 min,取上清。根据SPS 和SS 测试盒的说明进行测定。
1.4 数据统计与分析
采用Microsoft Office Excel 2010 绘图,采用SPSS statistics 18.0 软件进行数据统计分析,采用Duncan 多重比较法进行显著性分析,P<0.05 为显著性水平。
2 结果与分析
2.1 套黄、白袋凯特芒果采后果实软鼻病发病率的变化
由表1 可知,随着贮藏时间的延长,套黄、白袋凯特芒果采后果实软鼻病发病率逐渐增加。套白袋芒果果实的软鼻病发病率在采后贮藏第3 天超过了50%,贮藏后第10 天高达70%。套黄袋凯特芒果采后果实的软鼻病发病率显著低于套白袋果实。表明不同纸袋套袋会影响芒果采后果实的软鼻病发病率。
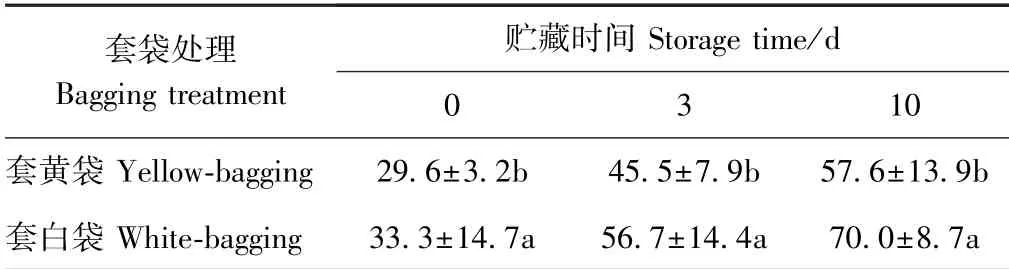
表1 套黄、白袋凯特芒果采后果实软鼻病发病率的变化Table 1 Change in the incidence of soft-nose disease in mango fruit cv. Keitt with bagging of yellow or white bags during storage /%
2.2 套黄、白袋凯特芒果采后果实硬度的变化
由图1 可知,凯特芒果果实硬度随着采后贮藏时间的延长不断下降。套黄袋芒果果实硬度在贮藏0~3 d 内下降不明显,但在贮藏3 ~10 d 内急剧下降;套白袋果实硬度在贮藏0~3 d 和贮藏3 ~10 d 期间均急剧下降。同时,在贮藏0 和3 d 时,套黄袋果实的硬度显著高于套白袋果实,且同一种套袋处理好果的硬度显著高于软鼻病病果;但贮藏第10 天,所有果实的硬度均无显著差异。表明套黄袋比套白袋更有利于减缓采后凯特芒果果实的软化速率。
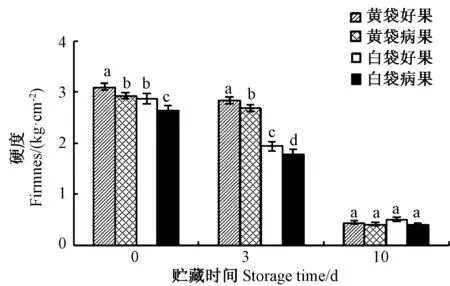
图1 套黄、白袋凯特芒果采后果实硬度的变化Fig.1 Change in firmness in mango fruit cv. Keitt with bagging of yellow or white bags during storage
2.3 套黄、白袋凯特芒果采后果实淀粉含量的变化
由图2 可知,贮藏0 d 时,套黄袋和白袋芒果果实的淀粉含量无显著差异;随着贮藏时间的延长,套黄、白袋凯特芒果好果和软鼻病病果果实的淀粉含量均呈下降趋势,其中,在贮藏3 d 时,套黄袋果实的淀粉含量显著高于套白袋果实,但在贮藏10 d 时显著低于套白袋果实。套黄、白袋果实的淀粉含量在贮藏初期急剧降低,但套白袋果实降幅大于套黄袋果实,且套白袋处理病果的降幅大于好果。说明套白袋果实及其发病果实加速了采后果实的淀粉降解。
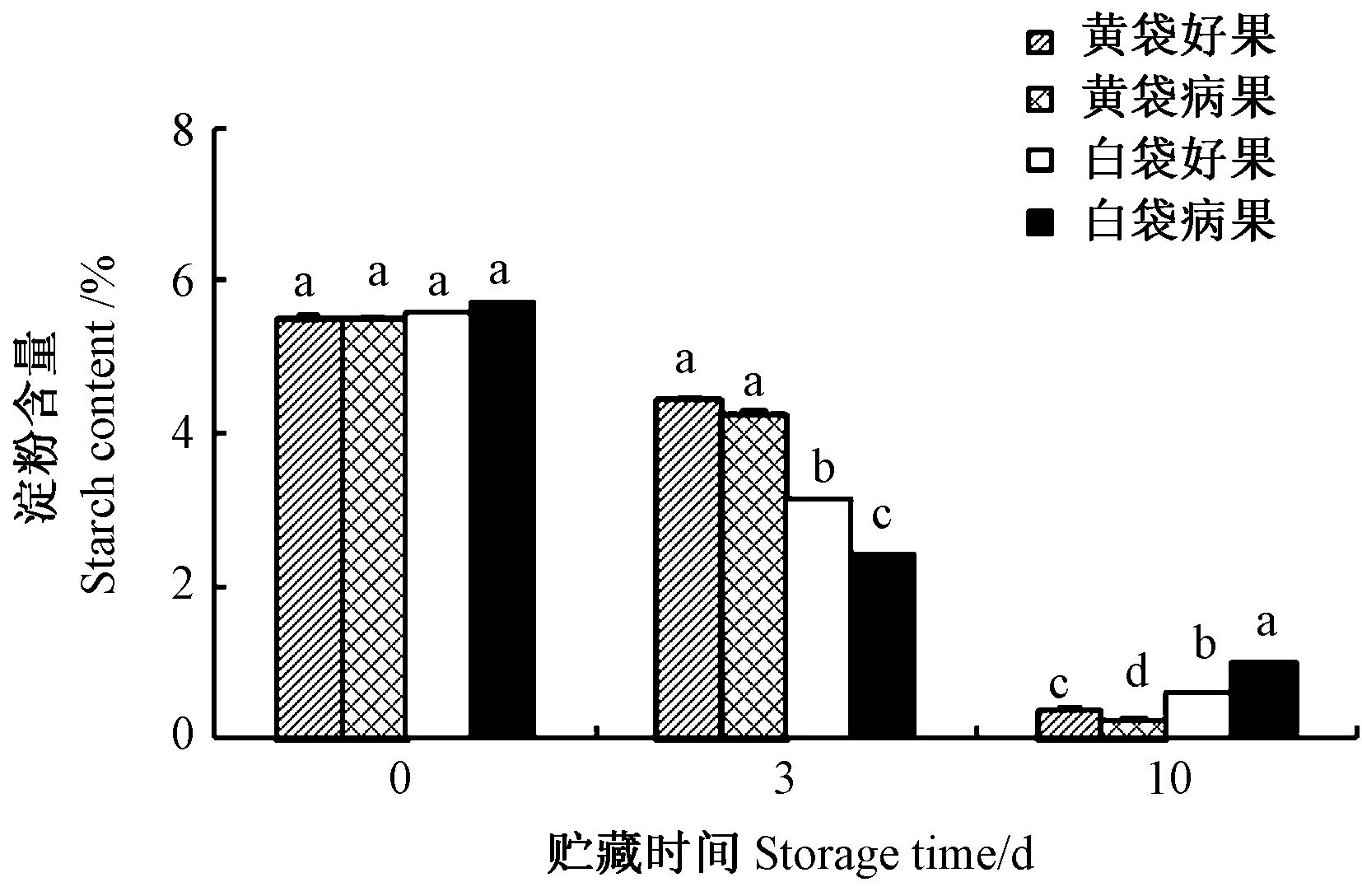
图2 套黄、白袋凯特芒果采后果实淀粉含量的变化Fig.2 Change in starch content in mango fruit cv.Keitt with bagging of yellow or white bags during storage
2.4 套黄、白袋凯特芒果采后果实可溶性总糖含量的变化
由图3 可知,随着贮藏时间的延长,各组芒果采后果实可溶性总糖的积累呈递增趋势,且各贮藏时期套黄袋好果的可溶性总糖含量显著低于套白袋芒果。两种套袋果实病果的可溶性总糖含量高于好果,且在各贮藏时期套白袋病果的可溶性总糖含量最高。说明芒果果实软鼻病发病加速了淀粉向可溶性总糖的转化,导致可溶性总糖积累。

图3 套黄、白袋凯特芒果采后果实可溶性总糖含量的变化Fig.3 Change in the soluble sugar content in mango fruit cv. Keitt with bagging of yellow or white bags during storage
2.5 套黄、白袋凯特芒果采后果实葡萄糖、果糖和蔗糖含量的变化
由图4-A 可知,随着贮藏时间的延长,套黄、白袋凯特芒果好果和病果的蔗糖含量均呈上升趋势。在采后贮藏0 d 时,两种套袋处理好果的蔗糖含量分别为8.58 和16.55 mg·g-1,至贮藏3 d 时,套黄、白袋好果的蔗糖含量分别增加了145.3%和181.9%,说明芒果果实经白袋套袋处理后,更早地开启了糖代谢系统,使得蔗糖更快地积累;与套白袋处理相比,套黄袋处理则显著降低了果实的蔗糖积累量。
由图4-B 可知,随着贮藏时间的延长,套黄、白袋凯特芒果好果和病果的果糖含量均先上升后略下降。套黄、白袋芒果好果果糖含量在贮藏第3 天时分别为19.21 和23.41 mg·g-1,套黄袋好果果糖含量仅为套白袋好果的82.1%,显著低于套白袋果实(P<0.05)。说明套黄袋处理缓解了芒果采后果实果糖积累的速率,尤其在贮藏前期这种效果更明显。
由图4-C 可知,整个贮藏期间套黄、白袋凯特芒果好果和病果葡萄糖含量的变化趋势与果糖基本一致。芒果葡萄糖含量在贮藏初期迅速增加,在贮藏末期降低;其中套白袋好果的葡萄糖含量在贮藏10 d 时显著低于其他果实。
2.6 套黄、白袋凯特芒果采后果实淀粉酶活性的变化

图4 套黄、白袋凯特芒果采后果实蔗糖含量(A)、果糖含量(B)和葡萄糖含量(C)的变化Fig.4 Change in the sucrose content (A),fructose content (B),and glucose content (C) in mango fruit cv.Keitt with bagging of yellow or white bags during storage
由图5 可知,在贮藏0 和3 d 时套黄、白袋芒果好果的淀粉酶活性显著低于发病果,在贮藏10 d 时,套黄袋好果和病果的淀粉酶活性降低。而套白袋好果和病果的淀粉酶活性升高,但两种套袋处理好果的淀粉酶活性均显著高于其对应的病果(P<0.05)。


图6 套黄、白袋凯特芒果采后果实AI(A)和NI(B)活性的变化Fig.6 Change in AI(A)and NI(B)activity in mango fruit cv. Keitt with bagging of yellow or white bags during storages

图7 套黄、白袋凯特芒果采后果实SS (A) 和SPS (B) 活性的变化Fig.7 Change in SS(A)and SPS(B)activity in mango fruit cv. Keitt with bagging of yellow or white bags during storages
3 讨论
芒果是典型的淀粉转化型果实,即生长发育阶段以积累淀粉为主,成熟阶段以积累蔗糖为主,采后果实在后熟过程中淀粉降解,蔗糖迅快速积累,在完熟时达到最高值[14]。研究表明,苹果[15]、香蕉[16]、猕猴桃[17]、桃[18]等采后果实的软化与淀粉降解密切相关,果实细胞内淀粉向可溶性糖的转化速率间接影响果实的软化进程。同时,芒果的后熟软化与胞壁扩展蛋白质(expansin,ExpA)表达增加,多聚半乳糖醛酸酶( polygalacturonase,PG)、 果胶甲酯酶 ( pectin pectylhydrolase,PME)、α-半乳糖苷酶,β-半乳糖苷酶、纤维素酶(cellulase,Cx)等细胞壁降解酶活性增加,进而导致细胞壁降解密切相关[19]。同时,芒果在采后贮藏过程中,由于淀粉酶的催化作用使淀粉水解转化为可溶性糖,引起细胞膨胀力下降,从而导致果实软化[20]。本试验结果表明,尽管采收期套黄、白袋芒果果实的淀粉含量无显著差异,但套白袋好果和病果的可溶性总糖、果糖和蔗糖含量均显著高于套黄袋好果和病果,而且两种套袋处理病果在贮藏0 和3 d 时可溶性总糖含量、蔗糖含量以及淀粉酶活性总体显著高于对应的好果。说明与套黄袋相比,套白袋促进了采后芒果果实淀粉的降解,而且软鼻病发病果也提前加快了淀粉的降解,进而促进了果实的软化成熟。当芒果开始变软后熟(3 d 时),套白袋芒果果实淀粉酶活性低于套黄袋果实,这可能是由于果实中的果糖和葡萄糖是淀粉酶的反馈抑制因子,在转熟期套白袋芒果果实的果糖和葡萄糖含量保持较高水平,因而抑制了淀粉酶活性。
果实可溶性总糖的积累是形成果实风味物质的基础,也直接决定果实的商品价值[21]。据前人研究报道,不同纸袋套袋处理使果实的含糖量产生差异,其原因主要是套不同纸袋导致果实外围微环境的光照、温度、湿度产生差异,这些环境因子的改变势必直接影响果实生长发育阶段的生理代谢,进而影响采后果实的生理代谢,导致果实糖、酸等营养品质及贮藏性发生变化[22-26]。然而套白袋和黄袋对芒果果实微环境因子的影响及其对果实生长品质及贮藏性的影响还需进一步研究。
果实SPS、SS、AI 和NI 是参与蔗糖代谢的主要酶[27-28],其中,SS 既能合成蔗糖又能水解蔗糖,具有双功能酶的特性;AI 和NI 催化蔗糖不可逆地分解为果糖和葡萄糖;SPS 是蔗糖合成中的关键酶,催化合成蔗糖的不可逆反应[5]。本试验结果发现,套黄袋、白袋芒果果实贮藏过程中蔗糖的合成占主导地位,但果实蔗糖含量在贮藏期间变化趋势与SPS 活性变化不一致,而葡萄糖和果糖含量与AI 活性变化趋势基本一致,随着贮藏时间的延长,蔗糖快速大量积累,而葡萄糖和果糖含量在贮藏末期与贮藏初期相比变化不大。然而,与套白袋相比,套黄袋有效抑制果实贮藏初期蔗糖代谢AI、NI、SS 等相关酶活性,使套黄袋果实采后蔗糖积累的速率低于套白袋果实,果实采后软鼻病发病率也显著低于套白袋果实,且套黄袋和白袋好果的蔗糖积累量分别在贮藏3~10 d 和0 ~3 d 显著低于其相应的病果。另外,本研究结果表明,套黄、白袋芒果采后果实软鼻病症即果肉软化溃败随果实的成熟衰老进程而加剧,这与不套袋芒果采后软鼻病症状通常随果实成熟加重相类似[10]。上述结果表明,芒果采后果肉糖代谢变化可能与果实软鼻病的病情发展相关;与套白袋相比,套黄袋更有利于降低采后果实的糖代谢,延缓果实的衰老进程,降低果实软鼻病发病率,提高果实的耐贮性。然而,有关芒果套黄、白袋引起果实外围微环境光、温和湿度的差异,进而影响果实糖代谢等活动,以及果实采后糖代谢调控与软鼻病病害控制之间的关系尚需进一步研究。
4 结论
本研究结果表明,套袋芒果果实采后软鼻病发病率均伴随果实的成熟衰老而增加,但套黄袋芒果采后果实软鼻病发病率显著低于套白袋果实。套黄袋芒果采后果实淀粉转化为蔗糖的代谢活性低于套白袋芒果,从而有助于延缓采后果实后熟衰老,提高果实的耐贮性,降低果实软鼻病发病率。与芒果好果相比,病果的糖代谢相关酶活性总体较高,淀粉降解快速,蔗糖快速增加累积。采后芒果果肉蔗糖代谢可能与软鼻病的病情发展相关,但套袋对芒果采后果实糖代谢的影响及与软鼻病病情发展的内在关联仍需进一步研究。

