木薯MePYL12 基因克隆及采后生理性变质过程的表达分析
郭 靖,章玉香,黄芷颐,吴春来,颜 彦,曾 坚,3,胡 伟
(1. 韶关学院英东生物与农业学院,广东 韶关 512005;2. 中国热带农业科学院热带生物技术研究所,海南 海口571101;3. 韶关市芳香植物工程技术研究中心,广东 韶关 512005)
0 引言
【研究意义】脱落酸是植物生长过程中重要的调节因子。ABA 参与了植物各阶段的生长过程,同时也作为关键因子来响应逆境胁迫[1]。ABA 信号可以提高植物在高渗、高盐以及干旱等不利生长环境中的存活能力。核心组分为PYR/PYL/RCAR(Pyrabactin resistance/Pyrabactin resistance like/Regulatory component of ABA receptor)、蔗糖非酶解型蛋白激酶(Sucrose non-fermenting1-related protein kinase, SnRK2)及2C类蛋白磷酸酶(Protein phosphatase 2C, PP2C)。接收上游信号的受体为PYR/PYL/RCAR;SnRK2 和PP2C则分别是通路的正负调控因子。ABA 受体、SnRK2和PP2C 共同组成了ABA 介导的信号通路[2−4]。【前人研究进展】在PYR/PYL/RCAR 研究过程中,PARK等科学家通过筛选得到的Pyrabactin 突变株克隆得到了13 个PYR1 同源基因[3]。MA 等科学家则发现PYR/PYL/RCAR 能够和ABA 结合并抑制ABI的活性[4]。对PYL 家族的结构进行分析显示,PYL家族成员的蛋白结构中都含有一个由7 个β-折叠和2 个α-螺旋组成的螺旋手柄结构[5−6]。到目前为止,PYR/PYL/RCARs 家族基因在拟南芥中有14 个家族成员[3,7],番茄中有15 个[8],棉花中有22 个[9],水稻中则只有13 个[10]。在拟南芥中,AtPYL5 和AtPYL9基因的过表达可以提高植株应对干旱胁迫和感受ABA 的能力[11−12]。水稻的OsPYL9 基因过表达能提高种子在萌发时对ABA 信号的敏感程度[13];将耐旱棉花品种中的GhPYL9-11A基因在拟南芥中过表达也可以提高种子在萌发时对ABA 信号的敏感程度[9]。将杨树中的PtPYRL5 和PtPYRL1 基因过表达能提高杨树清除活性氧的能力[14]。多个玉米PYL基因的过表达可以提高植株适应干旱胁迫和感受ABA 信号的能力[15]。木薯MePYL8 可能在非生物胁迫的信号转导中发挥作用,而木薯MePYL13 基因则可能参与了木薯块根的PPD 过 程[16−17]。不同物种的研究结果显示PYL基因在植物中参与响应了不同的逆境胁迫。木薯是热带和亚热带范围内被大量种植的粮食作物,是全世界将近8 亿人口的主粮[18]。我国的木薯种植区域主要为华南地区,是该地区一种重要的经济作物,全国约有50 万 hm2的种植面积,每年的总产量约为500万 t,年总产值约为人民币150 亿元[16]。木薯具有耐贫瘠和抗旱等特性,可作为重要的绿色能源[16,19−20]。但木薯块根由于收获后出现“采后生理性变质”现象(post-harvest physiological deterioration, PPD),使 其无法长时间保存,因而也限制其在生产中的大规模利用[21−23]。【本研究切入点】ABA 受体PYR/PYL/RCARs 家族基因是ABA 信号通路中重要的组成成分,在ABA 介导的非生物胁迫应答中具有重要作用。因此,研究PYL基因在PPD 过程和非生物胁迫中的功能,能够为进一步研究ABA 信号在木薯抗逆和PPD 过程中的功能奠定基础。【拟解决的关键问题】通过对MePYL12 基因进行克隆,对其编码蛋白序列进行生物信息学分析,分析MePYL12 基因在不同处理和PPD 过程中的表达模式,为研究MePYL12基因功能提供参考。
1 材料与方法
1.1 材料
中国热带农业科学院热带生物技术研究所保存并提 供木薯SC124(Manihot esculentacv. SC124)作为试验材料。RNA 提取和反转录试剂分别购自天根生 化(No.: DP437)和Fermentas(No.: K1622)。上海生工合成PCR 引物。
1.2 材料处理
木薯种茎切成15 cm 左右的茎秆小节,每个小节有3~4 个芽点,分别种入盆中生长,盆中土壤比例为蛭石∶营养土=1∶1(V/V)。挑选生长状况类似的植株(生长约60 d)作为处理材料。PEG-6000(20 %,W/V)浇灌植株来模拟干旱,浇水的植株作为对照,分别在0、3、5、7 d 后收集样品(取植株的老叶、第一片完全展开叶和未展开叶混合为1 个样品,共5 个),进行3 次重复。对样品采用液氮进行速冻后于−80 ℃保存;ABA 溶液喷洒木薯苗子(浓度为100 μmol·L−1),在0、3、5、7 d 分别收集处理后的叶片。叶片样品液氮处理后置于−80 ℃保存;取生长期约为10 个月的木薯块根,将块根切成片状(厚度为5 mm 左右)后实行暗培养,温度为25 ℃(RH 70 %),处理相应时间(0、6、12、48 h)后收集块根样品(重复3 次),块根样品液氮处理后置于−80 ℃。
1.3 基因克隆
叶片cDNA 模板通过反转录叶片RNA 获得。根据Phytozome 数据库中的木薯同源序列(Manes.02G087400.1)设计引物(P1: 5′-ATGGAACCTAACC AATCCCAG-3′; P2: 5′- GGCTTCTCTGGATGGACAT GAA-3′),以叶片cDNA 为基因模板克隆MePYL12,扩增片段送测序公司验证。
1.4 生信分析
在数据库NCBI 中搜索比对同源序列;ExPASy ProtParam 预测MePYL12 的理化性质;蛋白的结构预测使用SWISS-MODEL 和SOPMA 等在线网站[17];Plantcare 分析启动子元件组成;NCBI-CDD 预测保守结构域;序列比对采用DNAMAN6;NJ 法构建进化树;Primer 5.0 进行引物设计。
1.5 基因的表达分析
上海美吉生物技术有限公司完成处理样品的RNA 提取和建库,然后通过Illumina GAII(Illumina,San Diego, CA, USA)测序平台进行测序。测序数据处理方法见参考文献[24]。FPKM(Fragments per kilobase per million mapped reads)值代表基因表达水平。
2 结果与分析
2.1 克隆MePYL12 基因
拟南芥PYR1-like2 的蛋白质序列(基因登录号:AT3G24520)作为比对序列,在Phytozome 中比对搜索木薯基因组,得到了相似性较高的序列Manes.16G079500.1。针对Manes.16G079500.1 的核苷酸序列进行引物设计并扩增,最后测序得到全长为567 bp的片段(图1),氨基酸总数为188 个,将其命名为MePYL12 基因。MePYL12 蛋白预测的分子式为C926H1 466N244O286S6,不稳定指数为35.4,预测为稳定蛋白。MePYL12 蛋白的等电点和分子量分别为5.55和20.8 kD。对MePYL12 蛋白进行二级预测显示,α-螺旋占40.96%,无规则卷曲占36.17%,延伸链占18.09%,β-转角占4.79%。MePYL12 蛋白的三级结构预测发现,MePYL12 蛋白包含有2 个α-螺旋和7 个β-折叠的典型PYL 螺旋手柄结构(图2)。同时进行的保守结构预测分析显示MePYL12 蛋白含有PYR/PYL/RCAR like 家族结构域(图3),这些预测结果表明克隆得到的基因属于PYL 家族基因。
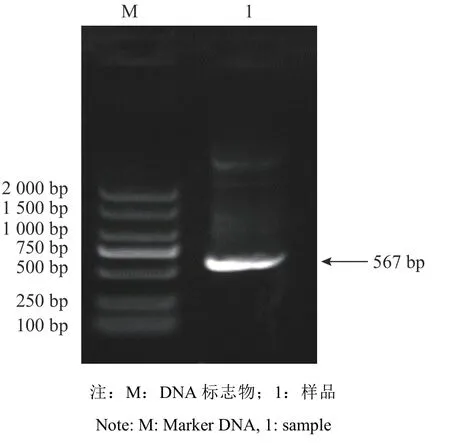
图 1 MePYL12 基因扩增结果Fig. 1 PCR amplification of MePYL12
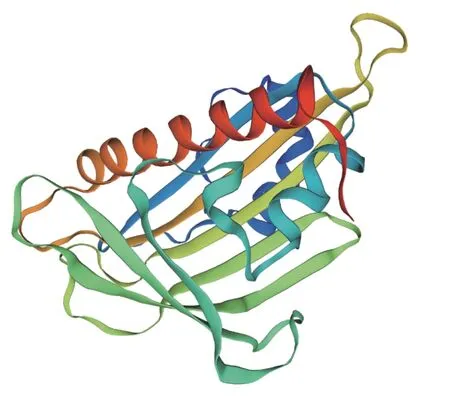
图 2 MePYL12 蛋白三级结构预测Fig. 2 Predicted tertiary structure of MePYL12
2.2 MePYL12 基因的进化分析
以MePYL12 基因作为探针,在数据库NCBI 中进行蛋白序列比对,得到和目标基因氨基酸序列一致性较高的蛋白序列,其中橡胶树(XP_021640277.1)的序列相似性最高,达到94.68%;其次是蓖麻(XP_002516457.1),达到86.77%。从图4 可知MePYL12基因的序列和其他PYL 基因的序列具有很高的一致性,特别是蛋白结构中和ABA 结合的区域“Latch”和“Gate”序列100%一致(图4),能够证明MePYL12属于PYL 家族。进一步的遗传进化分析显示,MePYL12和RcPYL2、HbPYL2-lke在同一分支,三种植物都属于大戟科,证明PYL 蛋白的氨基酸序列相似性很高(图5)。

图 3 MePYL12 结构域分析Fig. 3 Conserved domain analysis on MePYL12

图 4 MePYL12 蛋白序列的同源性比对Fig. 4 Homologous sequence alignments of MePYL12
2.3 MePYL12 基因的组织表达分析
从数据库中(shiny.danforthcenter.org/cassava_atlas/)下载得到的表达数据为10 个未经处理的木薯组织。10 个组织分别是分化胚组织(organized embryogenic structure, OES)、茎顶端分生组织(shoot apical meristem, SAM)、根顶端分生组织(root apical meristem, RAM)、须根(fibrous root, FR)、侧芽(lateral bud, LB)、叶柄(petiole, P)、茎(stem, S)、中脉(midvein, M)根(storage root, SR)和叶(leaf,L)。结果显示MePYL12 基因在不同组织中呈现出不同的表达量,较高的表达量则出现在叶片、SAM 和RAM 出现在叶片、SAM和RAM 等组织(图6)。
2.4 不同处理条件下的MePYL12 基因表达分析
MePYL12 基因含有ABRE 和MBS 等元件(表1)。MePYL12 基因在模拟干旱和ABA 处理下的表达水平被显著诱导,在处理5 d 后表达量被显著提高并达到峰值,随后表达量逐渐下降(图7),这些结果表明MePYL12 基因明显受到PEG 和ABA 诱导。
为探究MePYL12 基因和木薯块根PPD 之间的联系,对MePYL12 基因在此过程中的表达情况进行分析。如图8 所示,MePYL12 基因的表达水平在PPD早期(6 h)被显著诱导并达到峰值,随后12 h 和48 h的表达量逐渐下降。这些结果表明MePYL12 基因明显受到PPD 诱导,推测MePYL12 基因在PPD 过程中可能发挥重要作用。
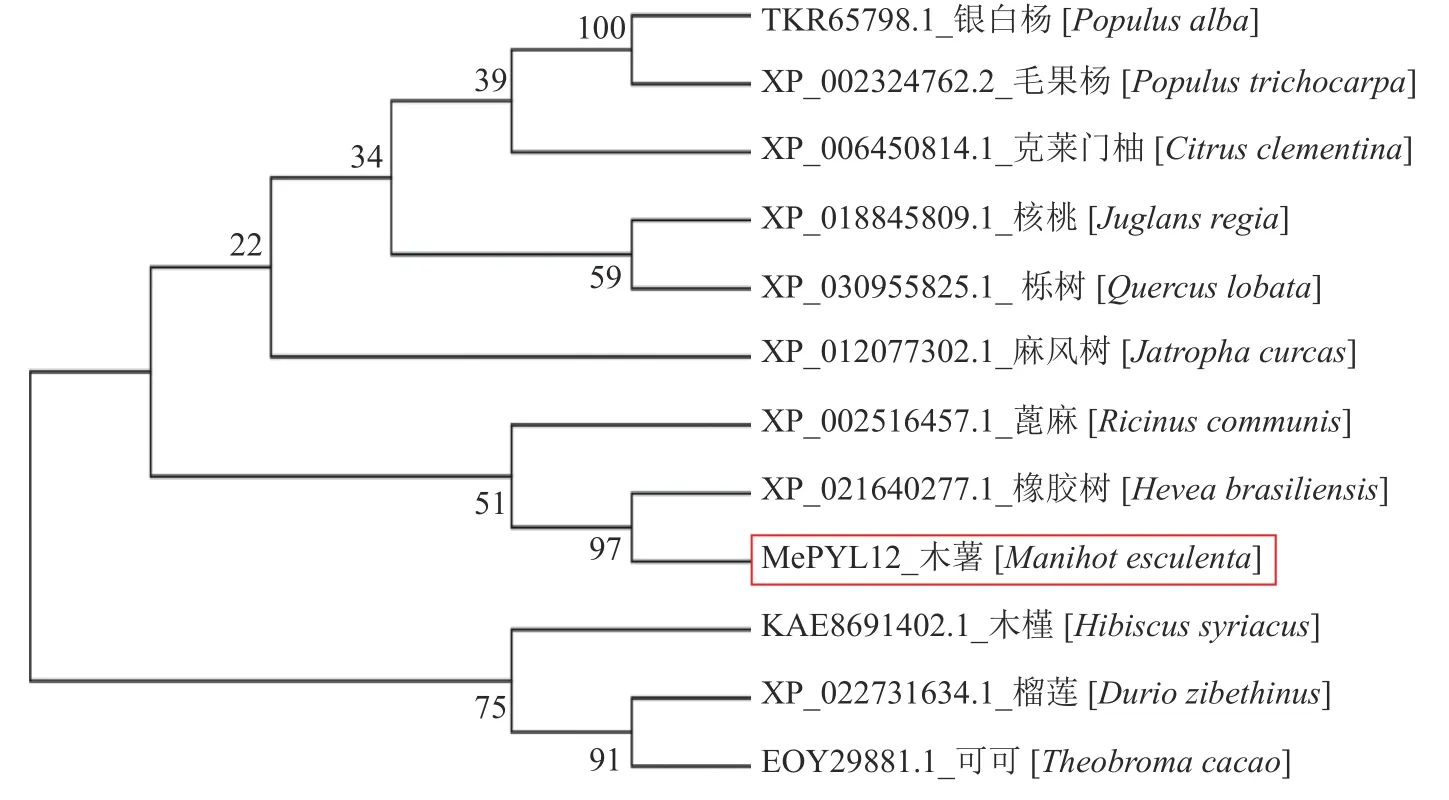
图 5 PYL 基因的系统进化树Fig. 5 Phylogenetic tree of PYL genes
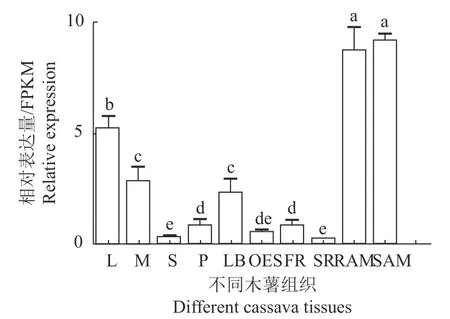
图 6 不同组织中的MePYL12 表达Fig. 6 Expression of MePYL12 in different tissues/organs of cassava

图 7 MePYL12 基因在不同处理下的表达,A:ABA;B:PEGFig. 7 Expressions of MePYL12 under Treatment A (ABA) and Treatment B (PEG)

表 1 MePYL12 启动子元件组成分析Table 1 Promoter elements of MePYL12

图 8 MePYL12 基因在PPD 中的表达变化Fig. 8 Expressions of MePYL12 of cassava tubers in PPD
3 讨论与结论
不同物种中的PYL 数量不一样,作为ABA 信号途径的核心组件,分析PYL基因的功能,为进一步解析ABA 信号通路有重要作用。本研究克隆得到了木薯MePYL12 基因,MePYL12 蛋白的氨基酸数量为188 个,三级结构预测含有典型PYL 螺旋手柄结构,保守结构预测含有PYR/PYL/RCAR like 家族结构域(图4),多序列比对显示ABA 结合的关键蛋白序列Latch 和Gate 环100%一致[5],结果表明MePYL12和蓖麻及橡胶树的PYL 蛋白的进化关系较近。这些结果都证明MePYL12 基因属于植物PYL家族。
木薯(Manihot esculentaCrantz)是热带重要的经济作物之一,但木薯块根收获后出现的PPD 现象严重限制了其在工业中的大规模利用[21−23],研究表明ABA 信号在采后贮藏方面扮演非常重要的角色,能够影响果实的存储品质和采后生理指标[25]。另外,PYL作为ABA 信号途径中的核心成分,是植物通过ABA信号响应非生物胁迫的关键因子。如2019 年报道在小麦中过表达ABA 受体TaPYL4 大幅度提高了植株应对干旱的能力[26];玉米ZmPYL9 和棉花GhPYL9-11A都可以提高拟南芥在干旱胁迫中的存活能力[9,15];杨树PtPYRL1/5 基因的过表达能够提高植株清除活性氧的能力[14]。拟南芥基因PYL9 的过表达能够在植株受到干旱胁迫时显著提高细胞中的抗氧化酶活性来保护细胞[11]。有研究表明活性氧(Reactive oxygen species,ROS)是木薯块根PPD 发生的主要因素之一,因此,清除ROS 将能大大延缓PPD 过程的发生[27,28]。而MePYL12 基因在ABA 处理和干旱胁迫中受到诱导,在块根PPD 过程中也显著被诱导。因此,推测MePYL12 基因可能参与木薯块根的PPD 过程,同时具有提高植物应对非生物胁迫的能力,这和之前的研究类似[16,17]。这些结果能为进一步研究MePYL12基因在延缓木薯PPD 过程和提高非生物胁迫中的适应能力提供参考。

