功能化金纳米材料在肿瘤诊疗中的研究与应用
葛浩英,杜健军,2,龙飒然,2,孙 文,2,樊江莉,2,彭孝军
(1.大连理工大学精细化工国家重点实验室,大连116024;2.大连理工大学宁波研究院,宁波315016)
金(Au)作为一种稀有的贵金属,在催化、电子通讯及医疗诊断等领域发挥着重要的作用,是不可或缺的重要材料[1]. 18世纪60年代,科学家们开始有意识地制备金纳米粒子,从而拉开了金纳米材料研究的序幕. 近年来,随着材料表征手段的快速发展,人们可以更加直观地看到金纳米材料的“真面目”并利用其在催化及光学等方面的独特性质开发其在光声成像、药物传递、传感诊断和临床治疗等新领域的功能和应用.

Fig.1 Absorption wavelengths of gold nanomaterials with different morphologies and sizes
金纳米材料具有独特的局域表面等离子共振(LSPR)的光学特性,当入射光照射到金纳米粒子表面时,如果入射光频率和金纳米粒子表面传导电子的整体振动频率相匹配时,其表面就会发生自由电子的集体振荡现象,在光谱中表现为明显的LSPR特征吸收[2~8]. 著名的莱克格斯杯(公元前4世纪,现存于大英博物馆)呈现出奇特的变色现象,就是由于玻璃中纳米尺度的金、银颗粒LSPR特征吸收导致的. 大量研究表明,这种LSPR特征吸收与金纳米材料的形貌、大小、粒子间距及其表面修饰等因素密切相关(图1). 金纳米粒子(13 nm)的LSPR特征吸收峰在520 nm处,其溶液呈现明亮的酒红色. 当纳米粒子发生聚集时,其在520 nm 处的吸收强度降低并在600~800 nm 范围内出现一个新的LSPR 吸收峰,溶液颜色则变为蓝色. 这种颜色变化在金属离子检测、小分子识别及蛋白质间相互作用等研究中广泛应用[6,7,9~11].
进一步研究发现,金纳米材料的局域表面等离子体激元还会极大地提高其表面吸附分子的拉曼信号强度,因此可以用作拉曼增强基质材料[12~15]. Zhan等[16]利用DNA折纸法将两个金纳米三角形组成类似蝴蝶结的纳米结构,在纳米粒子缝隙中呈现出明显的局部电磁场增强和空间限域效应,从而极大地提高了拉曼信号强度[图2(A)]. 此外,上述电磁增强效应还可以应用于荧光增强、光学镊子和非线性光学等领域. 金纳米粒子局域增强的电磁场可以影响其周围的荧光分子. 例如,当荧光分子和金纳米粒子之间的距离满足福斯特共振能量转移的条件时,分子荧光会被金纳米粒子有效地猝灭. Li等[17]将荧光分子修饰在金纳米粒子的表面,在其富集到肿瘤处后特异性地释放荧光分子,从而实现肿瘤的特异性荧光成像[图2(B)].
金纳米材料可以将吸收光子的能量转换成电子的动能[18]. 当运动电子被晶格/声子散射时,部分动能转化为晶格振动能,并最终以热的形式释放,这就是所谓的“光热效应”[19,20]. LSPR现象可以显著地增强金纳米粒子(金纳米棒、金纳米笼、金纳米星、金纳米锥等)的吸光能力,使其在光热转换方面发挥重要作用[21~24]. 金纳米棒在可见光和近红外两个波长范围内均具有较强的吸收[25]. 其中,低长径比金纳米棒常用于拉曼成像,而高长径比的金纳米棒则更适合用于光热治疗[26,27]. Zhang等[28]利用金纳米棒负载药物对肿瘤处进行光声成像和光热治疗,实现与化疗协同抑制肿瘤生长[图2(C)]. 近年来,为了进一步增强入射光的穿透深度并降低其光毒性,近红外二区光疗成为研究热点[20]. 研究结果表明,通过增加金纳米棒的长径比或发展新的金纳米结构(如金纳米骨等)可以将其吸收红移至近红外二区(1100~1200 nm)[14,29].
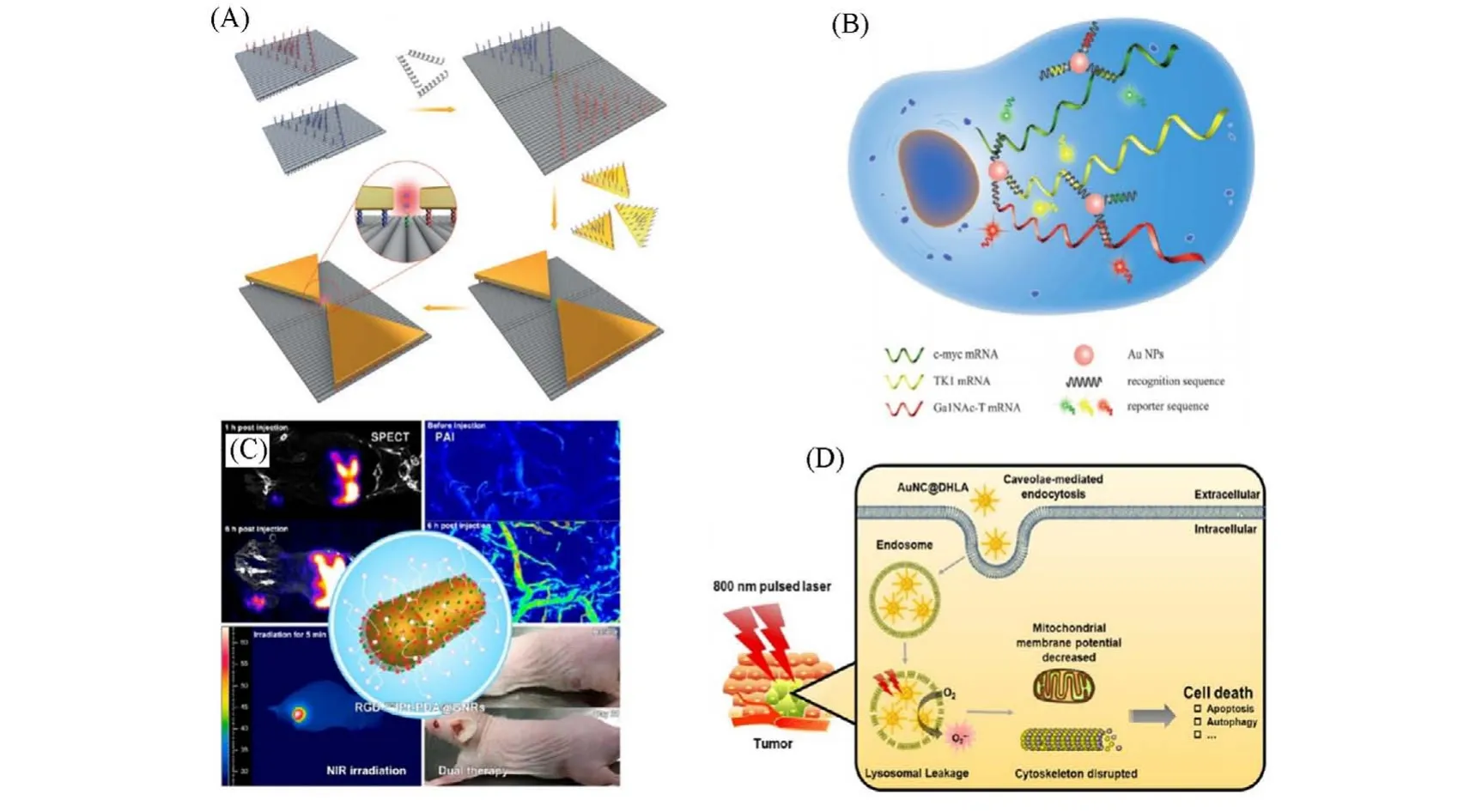
Fig.2 Properties of gold nanoparticles in imaging and treatments
2004年,Hainfeld 等[30]首次证明具有高原子序数的金纳米粒子可以增加局部辐射剂量,通过增强光电效应和康普顿效应,放大对DNA的损伤效应[31]. 此外,金纳米材料可以通过能量或电子转移的形式将吸收的光子能量转移给其周围的氧气、过氧化氢或光敏剂等小分子,通过光化学反应产生活性氧实现对肿瘤的光动力治疗,有效解决光利用率低、吸收波长短及肿瘤乏氧等制约光动力治疗发展的问题. Han 等[32]利用二氢硫辛酸包覆金纳米团簇用于肿瘤的光动力治疗[图2(D)]. 实验结果表明,在800 nm光照下二氢硫辛酸包覆的金纳米团簇产生了大量的超氧阴离子,可有效地杀伤肿瘤细胞并抑制肿瘤细胞的转移.
用于肿瘤诊疗的金纳米材料要具有良好的生物相容性、稳定性和分散性. 因此,在其表面可以通过氢键、配位络合或静电作用修饰带有氨基、巯基等功能基团的小分子或高聚物,以增加体系的生物相容性和多功能性. 由于金纳米材料在溶液中具有较大的比表面积并且呈现负电性,因此带正电的物质很容易吸附在金纳米材料表面来提高自身稳定性. 但由于生物体内环境复杂,较弱的静电力容易受到干扰而使修饰物脱落. 巯基容易与金生成稳定性更好的Au—S键(1-十二烷硫醇在金表面的结合能约为162 eV),该方法已成为在生物体内应用金纳米材料的主要修饰方法[33]. 例如,巯基连接聚乙二醇常用来增加生物相容性从而避免巨噬细胞的吞噬. 同时,在金纳米材料表面连接荧光分子可以实现对肿瘤的选择性成像,或者连接核酸序列对micRNA进行灵敏检测[17,18,34]. 此外,含氮(N)和氧(O)等的功能基团也可以修饰在金表面,但由于该两类原子为硬酸,其作用力明显弱于Au—S键[35]. 本文将主要介绍近年来金纳米材料的表面功能化及在肿瘤诊断和治疗等领域的最新进展.
1 增强金纳米材料的肿瘤靶向性
与正常组织相比,肿瘤处的血管壁间隙大、通透性好,金纳米材料经过静脉注射后会通过被动靶向富集到肿瘤组织处. 通过在金表面修饰靶向分子,可极大地提高纳米材料的生物相容性和主动靶向能力.
1.1 粒径影响
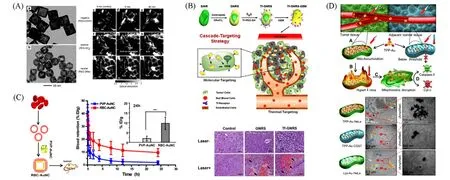
Fig.3 Influence factors of gold nanometer for their enrichment in tumor
金纳米粒子的粒径直接影响其被动靶向肿瘤的能力. 纳米粒子在血液中的运输速度通常会随粒径的增大而降低,并减小其组织穿透深度;但对于粒径过小的纳米粒子,其被动靶向作用将大大减弱.因此,通常将金纳米粒子的粒径控制在10~200 nm范围内. Cai等[36]合成了不同粒径的金纳米笼,研究了其在淋巴系统中的转运及在淋巴结中的传输速率和积累量[图3(A)]. 与粒径为50 nm的金纳米笼相比,粒径为30 nm的金纳米笼表现出更快的传输速率和更大的积累量,不但可以在前哨淋巴结12 mm的深度进行成像,还可以进一步到达第二和第三腋窝淋巴结.
1.2 血管通透性
肿瘤处的血管通透性越好,在血管中随血液流动的纳米粒子就越容易富集于肿瘤组织. 为了增加肿瘤部位的血管通透性,人们做出了很多的尝试,例如用药物或热刺激肿瘤处的血管. 药物可以清除肿瘤处少量的血小板,但其用量及安全性都有严格的要求. 相比之下,利用光热改善血管的通透性从而增强纳米粒子在肿瘤处积累的方法更加安全. Zhao等[37]合成了金纳米壳包覆棒状介孔二氧化硅纳米颗粒[图3(B)],并发现通过近红外激光照射引发的光热作用可显著改善吉西他滨在肿瘤组织中的渗透和蓄积,进一步破坏胰腺癌的致密间质屏障,增强小鼠的化疗敏感性. 小鼠实验证明该体系可以通过整合肿瘤靶向策略和增强药物传递效率实现胰腺癌的治疗并有效降低其复发率.
1.3 生物相容性
在生物体内,纳米粒子很容易被巨噬细胞吞噬而影响其靶向性递送[38]. 因此,需要通过表面修饰增加其生物相容性,从而减少巨噬细胞对纳米粒子的吞噬. Benjamin等[39]利用噬菌体Qβ表面的天然配体来合成金纳米粒子,并负载了大量的阿霉素药物分子. 体外实验表明,在同一个培养基中仅在激光照射的区域才会有阿霉素的释放并诱导细胞死亡,说明该结构具有高选择性的药物可控释放和细胞杀伤能力. Gao等[40]利用脂质体包裹金纳米笼和光敏剂,实现了体外双光子光热/光动力联合治疗肿瘤.同样地,Piao等[41]利用红细胞膜包裹金纳米笼用于肿瘤的光热治疗,不仅增加了金纳米笼的稳定性和循环时间,还有效地增加了肿瘤细胞对纳米笼的摄取[图3(C)]. 小鼠实验结果表明,红细胞膜包裹后的金纳米笼具有较高的生物安全性,不会对小鼠的正常组织和器官造成损害.
1.4 主动靶向性
纳米粒子通过自身被动靶向能力在肿瘤处富集的程度和选择性较低,因此需要通过对金纳米粒子表面进行修饰以增加其主动靶向肿瘤的能力. Ma等[42]将三苯基膦修饰在金纳米粒子的表面来靶向肿瘤细胞的线粒体,通过金纳米粒子之间的等离子体耦合效应实现光热转化. 体外实验结果表明,光照射下肿瘤组织的局部温度是正常组织的4 倍,说明金纳米粒子在修饰后能靶向肿瘤的线粒体[图3(D)]. 常用的靶向修饰分子还包括叶酸、透明质酸及蛋白受体等[42~46].
2 肿瘤成像及体外诊断
2.1 荧光成像
金纳米粒子是能量转移的良好受体,可以通过福斯特能量共振转移高效地猝灭荧光分子的荧光,因此广泛用于开发“关-开”型成像体系用于肿瘤成像[45,47]. Shi等[48]在金@银/金纳米粒子表面修饰了靶向肿瘤的适配子和带有荧光团的互补核酸序列[F-cDNA,图4(A)]. 银元素的引入显著增大了纳米粒子在400~1100 nm范围内的吸收截面. 在到达肿瘤细胞前,荧光团F-cDNA被有效猝灭. 当纳米粒子主动靶向到达肿瘤处时,靶向适配子与靶细胞表面的受体发生特异性的相互作用,导致荧光团F-cDNA的释放,极大地提高了荧光成像对比度. 该体系可以用于肿瘤诊断成像及指导后续治疗.
2.2 光声成像
生物体内的环境复杂,为了避免荧光分子从纳米粒子的表面脱落或被置换而影响其成像的准确性,急需开发新的成像方式. 由于热声信号之间可以相互转换,金纳米材料的光声成像性能逐渐被开发并用于生物医学成像[49~51]. Liu 等[52]通过湿法化学合成和逐层自组装相结合的方法制备了谷胱甘肽响应的磁性金纳米环[图4(B)],其可以实现核磁成像和光声成像双模式肿瘤定位,精准指导肿瘤处的光热治疗. 体外测试结果表明,其光热升温能够达到80 ℃,可以通过光热疗去除皮下模型肿瘤.Zhang等[53]进一步通过利用酸触发多肽-金纳米粒子聚集诱导的耦合效应实现了光声、CT及光热等多模式肿瘤成像.
2.3 表面增强拉曼成像
当入射光照射到金纳米粒子表面时,其周围的电子和电磁辐射发生强烈的电子相干振荡,导致电磁场增强,特别是纳米颗粒的锐边、尖端以及颗粒间的缝隙等位置增强更加明显. 当具有拉曼信号的分子处于上述“热点”时,其拉曼信号显著增强(106~1015数量级)[15,45]. Wang 等[14]在金纳米粒子表面修饰了4-氨基苯硫酚用于超小肿瘤的表面增强拉曼成像,并利用金纳米骨负载化疗药物阿霉素[图4(C)]. 该体系具有非常高的灵敏度,可用于肿瘤原位成像识别. 荷瘤小鼠活体实验表明该纳米粒子可以在光声-拉曼双重成像的引导下,利用近红外二区的光高效地杀伤肿瘤.
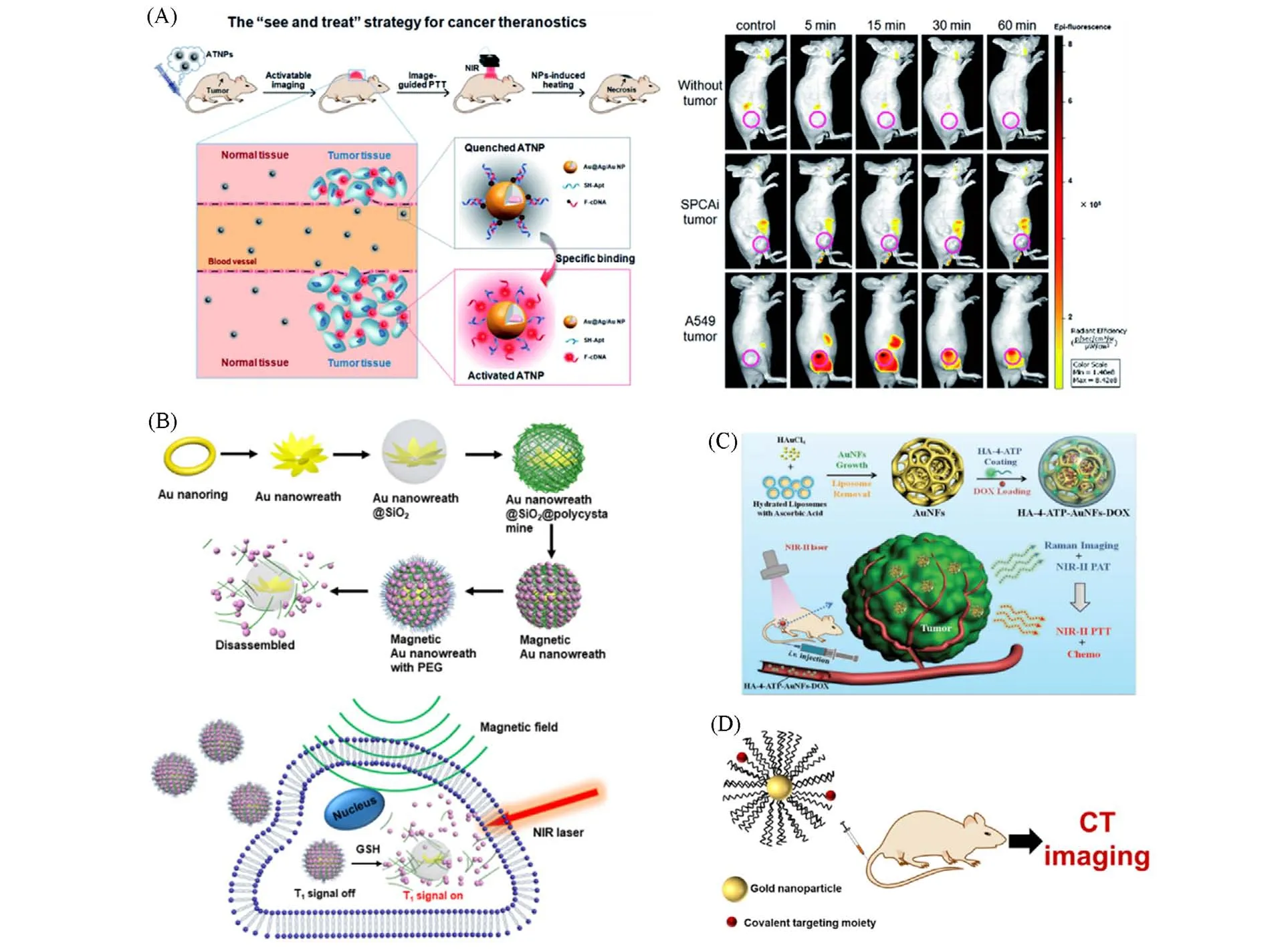
Fig.4 Gold nanomaterials⁃based tumor imaging
2.4 CT成像
目前,临床上主要使用含碘的有机分子作为X 射线计算机断层扫描(CT)成像的造影剂,但造影时间短和可能电离出碘离子等问题急需解决. 与碘相比,金由于具有更高的原子序数和更强的X 射线吸收能力而有望成为新一代CT 成像造影剂[50,54,55]. Liu 等[54]利用CT 成像技术研究了金纳米星结构在生物体内的生物分布和肿瘤摄取情况,并用于追踪金纳米星在老鼠体内光热治疗肿瘤的效果.Tsvirkun等[56]将金纳米共价连接组织蛋白酶靶向探针,有效用于肿瘤靶向CT成像[图4(D)].
2.5 体外诊断
与在生物体内实现光声成像、CT成像、荧光成像和拉曼成像不同,利用体液(血液、尿液等)可以更加简便地实现疾病的检测诊断. 尿酸、肌酐和腺苷等生物小分子在体液中的含量是评价肾功能及其相关疾病的重要依据. 我们[57]发现,汞离子可诱导肌酐和尿酸共同修饰的金纳米粒子溶液产生灵敏的颜色变化,首次提出了尿酸和肌酸酐分子由于纳米粒子空间位阻的存在而在金纳米粒子表面表现出针对汞离子的协同络合效应. 以上述发现为基础,我们[58]转换思路进一步组装了尿酸/汞离子-金纳米粒子体系,实现了血清及尿液等体液中肌酸酐的定性/定量识别. 基于金纳米粒子这种以自身空间位阻形式被动参与目标客体识别的机理,随后我们进一步筛选并开发了腺苷/银离子修饰的金纳米粒子体系,实现了其在尿液及血液样品中肌酸酐比色识别的无汞化[图5(A)][6],为金纳米粒子在疾病体外检测方面的应用奠定了基础[2]. Loynachan等[59]将2 nm金纳米簇连接上功能性多肽并负载到蛋白载体上,该功能性多肽在疾病发生部位因可以被特异性的酶切割而导致金纳米簇的高效释放[图5(B)]. 他们在大肠癌小鼠模型中应用金属蛋白酶反应性的金纳米簇-蛋白酶复合物,通过简单的比色读数成功地检测了荷瘤小鼠尿液中的金纳米簇,为快速检测多种疾病相关的蛋白酶提供了简单灵敏的方法.
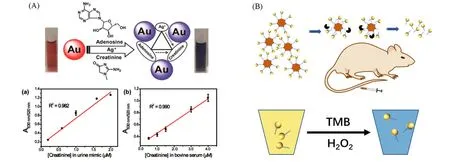
Fig.5 Colorimetric assay of creatinine based on AuNPs via synergistic coordination chemistry of creatinine with adenosine and Ag+(A)[6]and nanocatalyst signal amplification sensing system(B)
综上所述,金纳米材料在肿瘤成像和诊断中有着重要的应用价值. 基于金纳米粒子表面修饰荧光分子体系的荧光成像既保留了荧光分子成像灵敏度高及可视化的优点,又增加了靶向性和可激活等特点,但依然存在分子易漂白及易脱落等问题. 利用金纳米材料自身的LSPR特性可以大幅提高光声成像和表面增强拉曼的信号强度,避免了荧光成像中的缺点,但如何将金纳米粒子精准靶向运输至肿瘤内以及如何提高光的穿透深度仍是急需解决的难题. 由于金纳米粒子具有高X射线光子俘获截面,其可以作为计算机断层扫描造影剂,解决光穿透深度差的问题. 但计算机断层扫描对比度随着金纳米粒子粒径的增加而增加,对金纳米粒子的大小和形貌也有严格要求,还需要不断地探索和优化. 基于荧光成像、光声成像、拉曼成像和CT成像的诊断方法虽然准确度较高,但需要依赖昂贵、复杂的大型仪器设备. 相比之下,将金纳米粒子的比色变化用于疾病的体外诊断是一种快速、简单且方便的方法,当其稳定性、准确性及重现性进一步提高后将有望实现临床应用.
3 肿瘤治疗
金纳米材料因具有突出的光热转换效率而被广泛用于光热治疗,如金纳米棒、金纳米笼和金纳米粒子聚集体等[22,23,53,60,61]. 金纳米材料的光敏性质和催化活性也被开发用于肿瘤光动力治疗[62]. 此外,金纳米粒子还可以通过负载化疗药物、RNA及DNA等来实现化疗-基因联合治疗肿瘤[63].
3.1 光热治疗
近年来,基于贵金属的肿瘤光治疗策略受到广泛关注[64~67]. 生物组织对短波长的光具有较强的吸收和散射作用,因此入射光的波长越长,其组织穿透力越强;且长波长的光对生物组织的光毒性也较低[20]. 文献报道,金纳米棒、金纳米笼及金纳米花等结构的LSPR特征吸收波长可以红移到近红外乃至近红外二区,能够实现长波长光热治疗[24,68~72]. Chen 等[25]合成了吸收在1100 nm 的超小型金纳米棒(8 nm×45 nm,比常见金纳米棒的尺寸缩小了约5~11 倍),可用于近红外二区光照下的肿瘤光声成像和光热治疗. 通过体外实验发现其稳定性是普通金纳米棒的3 倍,光声信号强度是常用金纳米棒的3.5 倍. Zhou 等[23]采用一锅法合成了具有超支化内部结构的金等离子体黑体(粒径小于50 nm),其在400~1350 nm 范围内具有强烈的吸收,光热转换效率超过80%,可实现近红外一区和二区高效光热治疗肿瘤(图6).

Fig.6 Schematic diagram of synthesis and mechanism of gold plasmonic blackbodies and UV⁃Vis⁃NIR transmittance of 45 nm AuPBs at different concentrations[23]
3.2 载药治疗
化疗是治疗肿瘤的常规手段,但化疗药物分子的靶向性较差,对正常组织和器官也有损伤. 因此,如何增强化疗药物的靶向性,并提高对耐药性细胞的治疗效果是该领域目前急需解决的问题. 金纳米材料具有大的比表面积,可用于负载化疗药物[73,74],实现化疗和光热治疗协同作用,从而解决化疗药物靶向性和耐药性等问题[63]. Xu等[24]利用小鼠肝癌细胞膜脂质体包覆金纳米笼和化疗药物阿霉素,以增加其在血液内的循环时间并增大肿瘤细胞的摄取率. Wang等[75]利用三苯基膦修饰的金纳米笼包载热引发剂,高效率地靶向肿瘤线粒体并导致线粒体损伤,在常氧和缺氧条件下都可以诱导肿瘤细胞的凋亡[图7(A)]. 小鼠实验证明了该复合纳米粒子对肿瘤具有很好的靶向性和治疗效果,并且表现出细胞毒性低及炎症反应小等优点. 同样,在金纳米粒子表面修饰小干扰RNA可实现对肿瘤的基因治疗[76]. Shen等[77]将小干扰RNA和金纳米棒组装并靶向至乳腺癌细胞,实现了肿瘤的光热和基因沉默联合治疗. 体外实验发现该体系没有明显的细胞毒性和免疫毒性,可以显著降低乳腺癌细胞的存活率[图7(B)].
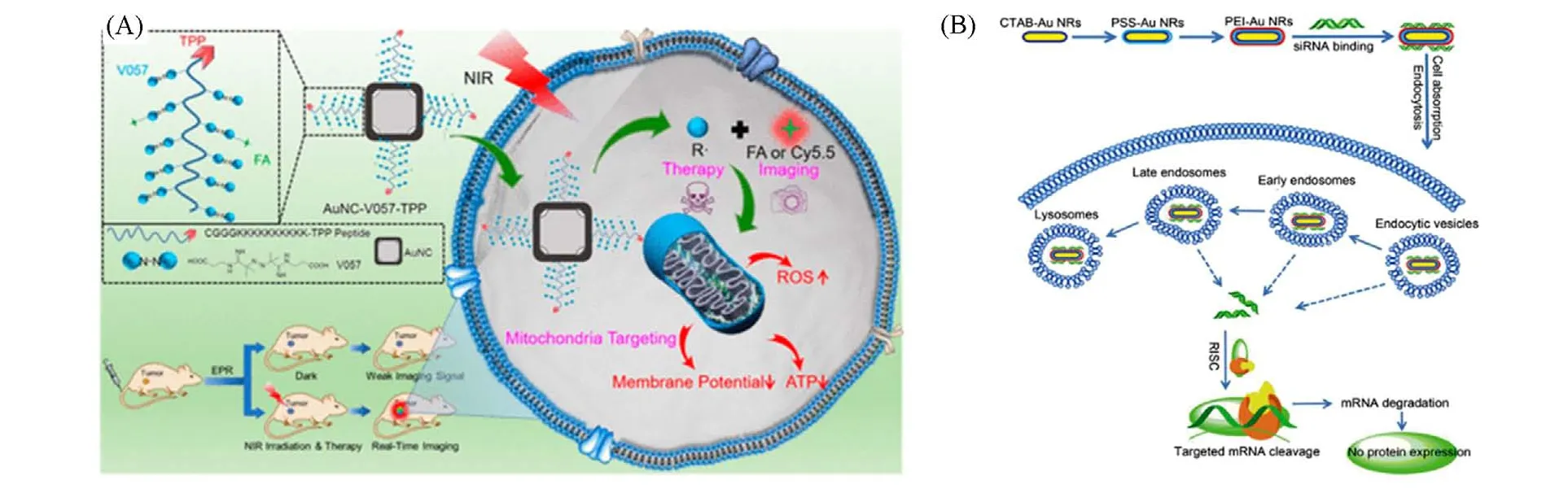
Fig.7 Gold materials as drug carriers for treatments
3.3 光动力治疗
鉴于近红外光的组织穿透能力和安全性,利用其作为光源进行光动力治疗是一种很有前景的策略. 研究发现,金纳米簇具有较好的光动力治疗效果[62,78]. 2018年,Chen等[79]用人血清白蛋白和过氧化氢酶对金纳米团簇进行修饰,得到一种多功能光动力治疗纳米材料[图8(A)]. 一方面,该金纳米簇在人血清蛋白的修饰下可以有效地在肿瘤处积累,能够在1064 nm激光照射下产生单线态氧;另一方面,表面修饰的过氧化氢酶可催化过氧化氢产生氧气,缓解肿瘤深处的乏氧状况. 细胞和活体实验证明该金纳米簇具有较好的肿瘤定位、荧光成像和光动力治疗肿瘤的效果.
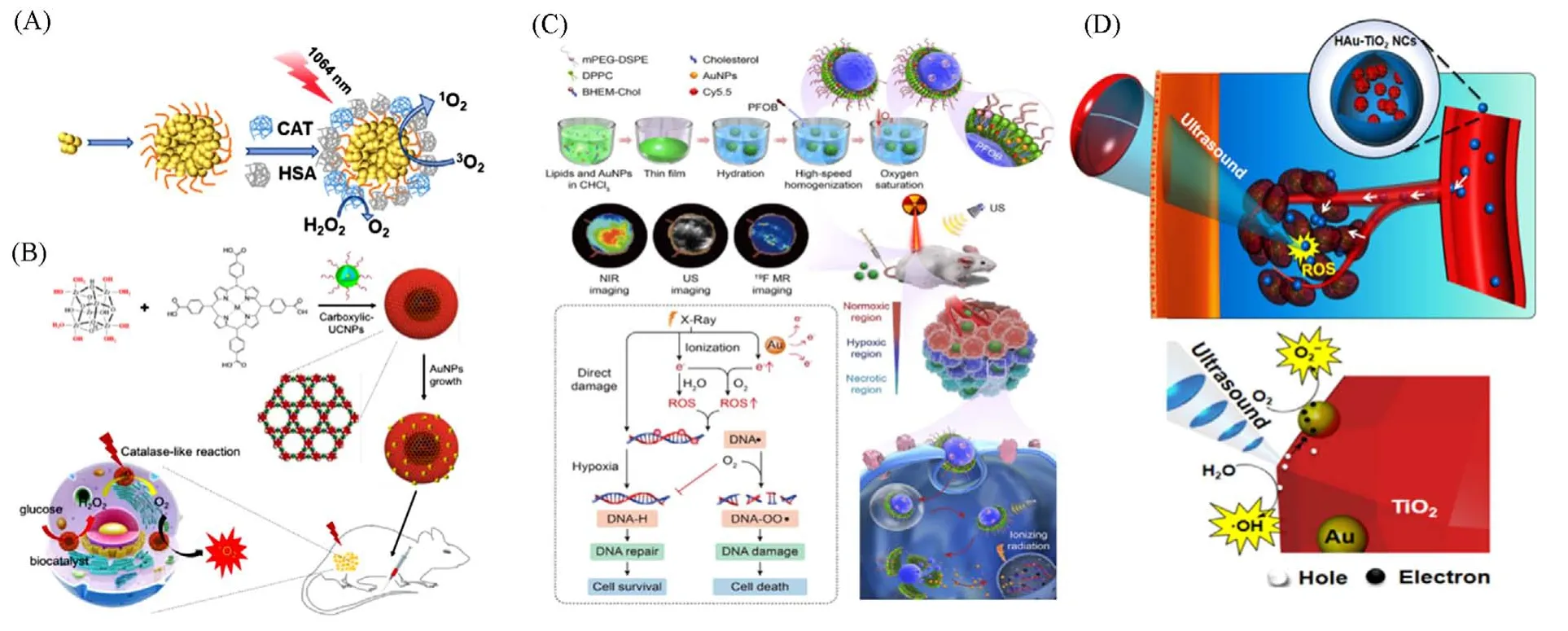
Fig.8 Gold nanomaterials⁃based therapeutic strategies
3.4 纳米酶催化
某些金纳米材料具有酶的催化功能,如催化葡萄糖产生过氧化氢以及类过氧化氢酶催化过氧化氢产生活性氧等[80~82]. He等[80]将人工酶(超小型金纳米粒子)与上转换纳米粒子和卟啉组装[图8(B)],通过高效的生物催化驱动光动力治疗作为生物催化剂和纳米反应器. 其中,超小型金纳米粒子具有类葡萄糖氧化酶的活性,可以催化葡萄糖产生过氧化氢,导致癌症饥饿治疗和过氧化氢水平的升高. 随后产生的过氧化氢由铁卟啉组成的金属有机骨架层催化产生氧气,最后上转换材料将近红外光转化为可见光来激发铁卟啉以产生单线态氧,从而实现针对实体瘤的协同级联反应驱动的近红外光动力治疗.
3.5 放射治疗
金具有较大的原子序数,可以作为辐射增敏剂用于增加局域辐射剂量,有效地增强光电效应对DNA 的损伤. Jiang 等[83]将超小型金纳米颗粒包裹在全氟辛基溴液态纳米滴中,通过辐射引发DNA 损伤,并且超声触发的氧气释放可以缓解肿瘤内的缺氧状况,并固定电离辐射所产生的DNA自由基中间体,阻止DNA修复,即可以同时促进DNA损伤的形成和防止随后的DNA损伤修复,最终导致肿瘤坏死[图8(C)]. 小鼠实验证明该纳米结构具有良好的治疗效果,20 d内监测肿瘤没有复发迹象,为肿瘤治疗提供了一种新的策略.
3.6 声动力治疗
超声具有安全、无创及组织穿透性好等特点,在临床诊断和肿瘤热疗消融等方面得到了广泛的研究和应用. 研究表明,可见光难以穿透厘米级厚度的组织,但超声(1 MHz)在通过10 cm厚的组织后,其强度仍保留31%左右. 因此,声动力治疗可以有效用于实体瘤或深部肿瘤的治疗,是目前研究的热点. 最近,人们发现金纳米粒子和其它材料形成的异质结结构可以吸收超声并产生活性氧用于治疗肿瘤[84,85]. Deepagan等[84]开发了亲水性的金-二氧化钛纳米复合材料,发现当该纳米复合材料通过超声辐射后,金可以增加活性氧的产生效率[图8(D)]. 通过进一步实验表明该纳米复合材料具有很好的肿瘤抑制效果,有希望成为癌症治疗的声敏剂. Lin等[85]开发了超声和谷胱甘肽双重刺激的Au-MnO纳米材料,不但实现了超声刺激产生活性氧用于治疗肿瘤,同时还实现了光声和核磁双重成像.
综上所述,金纳米材料突出的光热转换性能和LSPR 特征吸收使其可应用于肿瘤的光热治疗,并能够通过在金纳米粒子表面负载化疗药物实现多模式联合治疗. 近年来,金纳米材料在光动力领域、声动力领域及放射增敏治疗领域有较快的发展,但具有这类性质的金纳米结构的构建和大规模制备仍是具有挑战性的工作. 利用金纳米粒子作为纳米酶治疗肿瘤的策略虽不依赖于外部光、热及声等形式的能量刺激,但如何提高其效率仍是一个急需解决的难题.
4 挑战与展望
金纳米粒子独特的物理、化学性质使其在肿瘤成像和治疗领域占有非常重要的位置. 但目前金纳米粒子实现临床应用还面临着许多难题,如需要开发可代谢的金纳米材料(小于5.5 nm)以减小生物体肝、肾等器官的负担;开发超声响应的金纳米复合材料以实现深部肿瘤的成像和有效治疗等. 因此,开发更加安全、有效的金纳米材料对于推动其实现临床应用具有重要意义.

