肾移植术后新型冠状病毒肺炎临床表现及预后
程东瑞,吕镗烽,文吉秋,刘 斌,陈劲松
0 引 言
作为被人类新认知的新型冠状病毒,严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2, SARS-CoV-2)凭借超强的传染性已经造成全球范围流行[1]。SARS-CoV-2的致病机理和易感因素目前尚未明确。免疫功能在传染性疾病致病过程中具有重要作用,而肾移植患者术后需要长期服用免疫抑制剂,免疫力处于抑制状态,该类患者感染SARS-CoV-2后临床表现不同于其他人群。目前,对于肾移植患者感染SARS-CoV-2后的临床表现及治疗策略鲜有报道。自2020年2月2日运行以来,我院先后接诊2例肾移植术后感染SARS-CoV-2患者。现就其临床表现及诊治过程进行讨论。
1 病例资料
病例1:男,48岁,主诉“间断发热伴乏力13 d”入院。患者于2020年1月28日无明显诱因出现乏力及发热,体温约37.5 ℃,偶有胸闷,无寒战、咳嗽、喘息、全身肌肉疼痛等不适。患者分别于1月29日和2月4日于当地医院行胸部CT未见异常。2月6日胸部CT提示:左上叶后段及双下肺磨玻璃样密度影,考虑肺炎。鼻腔黏膜拭子新型冠状病毒核酸检测阳性,遂停用免疫抑制剂,服用莫西沙星治疗,2月10日收治入院。2009年患者因肾功能不全接受肾移植手术,术后长期服用他克莫司、吗替麦考酚酯、泼尼松抗排斥治疗。同时高血压服用氨氯地平5 mg/d,缬沙坦胶囊80 mg/d控制血压。
入院检查:体温39 ℃、脉搏95次/min、呼吸20次/min,血压140/86 mmHg(1 mmHg=0.133 kPa),不吸氧指脉氧监测<93%。血常规:白细胞4.5×109/L、中性粒细胞比例65.1%、淋巴细胞比例24.8%、中性粒细胞计数2.96×109/L、淋巴细胞计数1.12×109/L、血红蛋白159 g/L、血小板计数128×109/L、CRP 49.68 mg/L↑、降钙素原0.07 μg/L↑、血肌酐1.27 mg/dL↑、胱抑素C 1.48 mg/L↑、乳酸脱氢酶198.9 U/L。2月13日胸部CT示:两肺见片絮状密度增高影,呈磨玻璃样改变,以两下肺为著。入院诊断:①新型冠状病毒肺炎(重症);②肾移植术后。
患者入院当天即出现高热,体温39 ℃,伴有呼吸困难,给予消炎痛栓退热处理。2020年2月11日患者体温正常,次日患者出现发热症状,体温38.3 ℃。考虑患者持续高热同时依然存在排斥风险,即给予甲泼尼龙40 mg/d静脉滴注,治疗持续12 d(2月24日改为泼尼松20 mg/d口服,同时加用他克莫司)。患者2月13日后体温正常,停用激素后也无发热症状。期间最高体温37.3 ℃。2月20日、22日、29日先后3次新型冠状病毒核酸检测结果均为阴性。2月28日患者复查CT提示双肺病变较前明显吸收,同时CRP、降钙素原均降为正常水平,出院前肌酐0.96 mg/dL,符合出院标准,并于3月3日出院。出院后加用吗替麦考酚酯。患者随访至今无发热症状,复查核酸阴性,肾功能稳定。患者治疗经过及指标变化见图1。
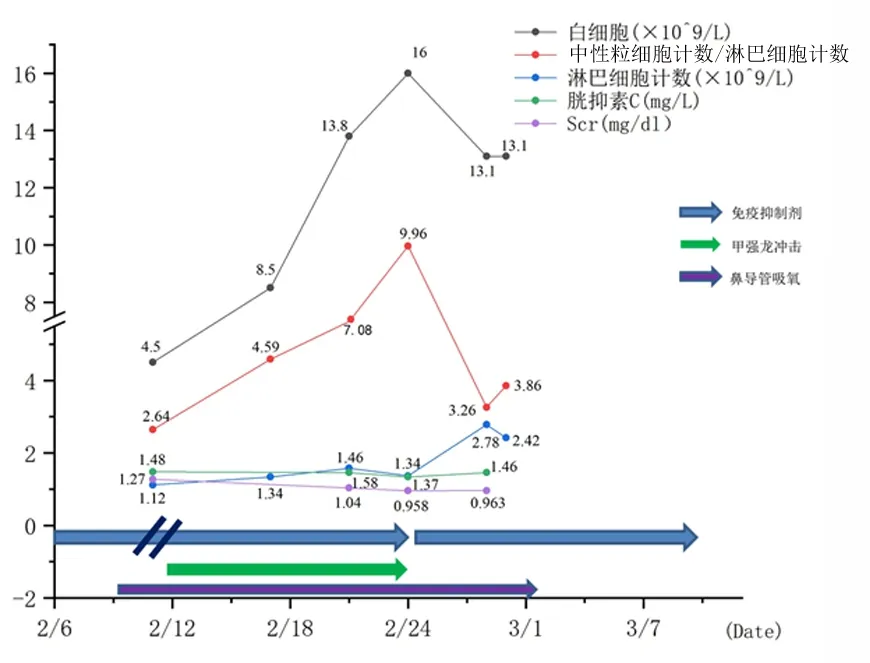
图 1 病例1治疗经过及指标变化
病例2:女,65岁,主诉发热9 d,咳嗽、咳痰胸闷4 d。患者无诱因于2020年1月31日出现发热,最高体温39.0 ℃。2月3日接受鼻咽拭子新型冠状病毒核酸检测提示阳性;2月4日开始出现咳嗽、咳痰,伴有胸闷、感乏力、肌肉酸痛,无明显咽痛、头痛不适。患者胸部CT提示双肺感染,遂于当地医院住院治疗,予阿比多尔、莫西沙星等药物治疗。2月8日收治入本院。
患者于2011年2月8日因慢性肾功能不全行肾移植术,术后移植肾功能稳定,长期服用他克莫司、吗替麦考酚酯、强的松抗排斥治疗。
入院检查:体温37.3 ℃、脉搏77次/min、呼吸22次/min、血压 129/82 mmHg。血常规:白细胞4.7×109/L、中性粒细胞比例77.5%、淋巴细胞比例15.3%、中性粒细胞计数3.64×109/L、淋巴细胞计数0.72×109/L、血红蛋白117g/L、血小板计数171×109/L、CRP40.14↑、血肌酐0.63mg/dL、胱抑素C 1.05、α羟丁酸脱氢酶222.1↑,乳酸脱氢酶256.3↑;不吸氧情况下指脉氧83%,鼻导管吸氧指脉氧>93%。入院诊断:①新型冠状病毒肺炎(重症);②肾移植术后。患者于2月1日在其移植随访医师的指导下停用免疫抑制,入院评估患者不吸氧情况下指脉氧83%,诊断为新型冠状病毒肺炎(重型)。入院后给予氧疗+药物治疗。氧疗方面:2月8日至9日高流量给氧40 L/min,10日评估病情加重,活动后胸闷症状明显,改为无创呼吸机辅助呼吸(40 L/min、50%吸氧浓度)。无创呼吸机辅助呼吸下患者脉氧保持稳定。18至23日开始改为经鼻高流量吸氧(30 L/min、35%),患者2月24日起鼻导管吸氧,脉氧维持在98%左右。药物治疗方面:患者2月1日住院前即停用免疫抑制剂,13至23日考虑患者病情进展快,呼吸困难,同时为防止排斥反应给予甲泼尼龙40 mg静脉滴注,1/d;2月14至22日给予人免疫球蛋白5 g/d静脉滴注。2月24日开始停用甲泼尼龙,给予泼尼松25 mg/d。此后每4~5天泼尼松减量5 mg。2月24日后患者开始加用他克莫司。患者入院后自2月29日起因病情好转,CRP、降钙素原均降至正常水平,核酸检测共8次,其中3次阳性、5次阴性,患者3月16日、18日连续2次阴性后于3月20日出院。患者治疗经过及指标变化见图2。
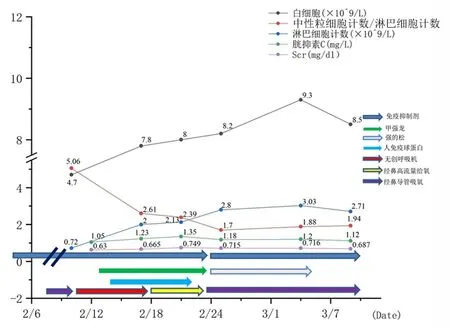
图 2 病例2治疗经过及指标变化
2 讨 论
SARS-CoV-2为RNA病毒属于冠状病毒的一种,目前已知的可以造成人类疾病的冠状病毒共7种。除致病力弱的4种外,其余3种冠状病毒SARS-CoV、EMRS和SARS-CoV-2本世纪以来已经造成了3次大型传播[2]。这3种冠状病毒均可造成急性呼吸窘迫综合征(acute respiratory dysfunction syndrome,ARDS),而SARS-CoV-2和SARS-CoV基因序列相似度更高。SARS-CoV在2003年的流行导致8000余例感染,近800例死亡;MERS虽然病死率达到30%,但主要在中东地区爆发为主[3]。SARS-CoV和MERS有关肾移植患者感染的报道极少,仅2003年香港的报道提及1例高龄肾移植患者感染SARS后死亡[4]。
呼吸内科吕镗烽主任医师:研究表明,感染SARS-CoV-2临床表现以呼吸道症状为主,如发热(82.0%~98.6%)、干咳(59.4%~83.0%)、呼吸困难(31%~55%)、肌肉酸痛(11%~44%),其中发热是最为常见的症状,且至少超过1/3的患者发热体温超过39 ℃,且体温超过39 ℃的患者转为重症的概率更高[5-7]。本文报道的2例肾移植患者均有发热、干咳、乏力的临床表现,且发热体温超过39 ℃,最终临床符合重症标准。男性患者在起病后13 d出现呼吸困难症状;而女性患者进展更为迅速,起病5 d即出现呼吸困难症状。女性患者肺部病变也更为严重,一度需要无创呼吸机维持脉氧。有研究表明,SARS-CoV-2感染患者平均起病后5 d即可出现呼吸困难的症状,而发展到ARDS仅需平均8 d时间[6]。同时发展到呼吸困难的时间越短,临床病情越重。这些特点在移植患者都得到体现。
肾脏科程东瑞主任医师:SARS-CoV-2感染患者胸部CT呈现明显的病毒性肺炎改变,以双下肺为主。这些特点在本文涉及2例肾移植患者中均有体现。前期研究表明,SARS-CoV-2感染患者血常规呈现典型病毒感染特征,入院时平均白细胞4.5×109/L,淋巴细胞计数随着病程进展逐渐减低,死亡患者淋巴细胞计数下降更为明显[6]。这2例患者入院时白细胞水平偏低,病程中白细胞呈现上升趋势,可能与激素的使用有关。这2例患者淋巴细胞计数随着临床症状好转而明显升高,出院时淋巴细胞计数分别是入院时2.16倍和3.76倍。提示免疫力恢复在SARS-CoV-2感染治疗过程中的重要作用。这2例肾移植感染患者在疾病诊疗整个过程中并未观察到明显移植肾损害。病例1在发热39 ℃时尿蛋白1+,肌酐偏高,体温控制良好复查尿蛋白转阴,血肌酐也恢复正常水平。在SARS-CoV-2感染患者中,肾并不是主要的受累器官。既往研究也表明AKI的发生率约3%[5-6]。
目前尚无针对SARS-CoV-2的特效药物。虽然感染患者中大部分症状轻微,可自愈,但仍有部分会转为重症和危重症。对于SARS-CoV-2危重症患者而言,病死率最高可高达61%[8]。预防SARS-CoV-2感染患者进入到危重症成为治疗的关键,故早期干预非常重要。肾移植患者长期服用免疫抑制剂,处于免疫抑制状态,感染初期及时停用免疫抑制剂对于恢复患者免疫力,降低转为危重症风险起到积极作用。2003年SARS感染患者中曾大量使用激素;但彼时激素用量偏大,疗程很长,也带来副作用引起争议[9]。在SARS-CoV-2治疗中激素也被广泛使用。有研究表明,约1/3的SARS-CoV-2感染患者救治过程中使用激素[10]。这2例移植患者治疗中均给予小剂量激素(40 mg)冲击治疗。我们认为小剂量激素冲击治疗对于减轻炎症反应、促进肺部病变吸收都很有益处。对于SARS-CoV-2感染患者出现呼吸困难赢及早给予氧疗。由于SARS-CoV-2感染肺部病变进展迅速,氧疗须要及早进行。

