儿童传染性单核细胞增多症患者外周血T细胞、血浆PD-1和Tim-3水平表达检测的临床意义
王卫国,王伟伟,马黎丽(阜阳市人民医院检验科,安徽阜阳 236001)
传染性单核细胞增多症(infectious mononucleosis,IM)是儿童较为常见的急性传染病,由EB病毒感染导致,发病后淋巴细胞快速增生,外周血反应性淋巴细胞即异型淋巴细胞迅速增高,导致发热、淋巴结肿大、咽峡炎等临床症状出现[1]。IM患儿机体免疫系统应答迅速,致使病毒静息下来,绝大多数形成潜伏感染,若免疫应答低下或过度可形成慢性活动性EB病毒感染或嗜血细胞综合症,造成不同的疾病和临床结局[2]。程序性死亡分子1(programmed death 1,PD-1)和T细胞免疫球蛋白及黏蛋白分子3(T cell immunoglobulin and mucin domain-containing protein 3,Tim-3)是近年来发现的重要的负性免疫调节分子,在抗病毒和维持免疫自稳中起着重要作用,乙肝、丙肝和艾滋病等患者中均发现PD-1和Tim3表达异常[3-4]。PD-1和Tim-3 在儿童IM患者T细胞及血浆中如何表达,目前报道较少,本研究旨在探讨上述指标的表达变化及其临床价值。
1 材料与方法
1.1 研究对象 2018年3月~2020年2月于阜阳市人民医院确诊的IM患儿67例,诊断标准参照《诸福棠实用儿科学》(第8版),男性47例,女性20例,年龄1~8岁,平均年龄3.56±1.91岁。对照组为健康体检者20例,男性13例,女性7例,年龄1~9岁,平均年龄3.60±2.23岁。两组间在性别和年龄上的差异无统计学意义。此次研究通过了本院医学伦理委员会的批准。
1.2 试剂和仪器 CD3,CD4,CD8,PD-1,Tim-3,CD45 及相关同型对照荧光标记抗体购自BD 公司;人血浆PD-1和Tim-3检测ELISA试剂购自江莱生物公司;芬兰雷勃mk3 酶标仪和美国BD Calibur 流式细胞仪。
1.3 方法
1.3.1 T细胞PD-1和Tim-3表达检测:取四支流式管,每种抗体用量为10 μl。第1 和第2 支加入CD3,CD4 和CD45 后,再分别加入PD-1和Tim-3,第3 和第4 支加入CD3,CD8 和CD45 后,再分别加入PD-1和Tim-3,各管加入50 μl EDTA 抗凝全血,避光染色30 min,溶血后离心弃上清,加入磷酸盐缓冲液上机检测。cell quest 软件分析,以百分比(%)表示PD-1和Tim-3 在CD4+和CD8+T细胞上的表达。
1.3.2 血浆PD-1和Tim-3的水平检测:按试剂盒操作说明书进行:样本孔和标准品孔各加50 μl 样品和辣根过氧化物酶标记的检测抗体100 μl,封板后37℃孵育30 min,洗涤5次后加入酶作用底物,15 min 后加入终止液,于酶标仪450 nm 波长读取吸光度值,采用曲线回归方程计算血浆PD-1和Tim-3浓度(ng/ml)。
1.4 统计学分析 应用SPSS 18.0 软件,正态分布资料用均数±标准差(±s)表示,采用t检验、t’检验和相关性分析,绘制ROC曲线,评估其诊断的价值。以P<0.05为差异有统计学意义。
2 结果
2.1 IM组和对照组T细胞上PD-1,Tim-3表达百分比比较 见表1,图1。与对照组比较,IM患儿CD4+T 和CD8+T细胞上PD-1和Tim-3表达百分比均明显升高(均P<0.01)。
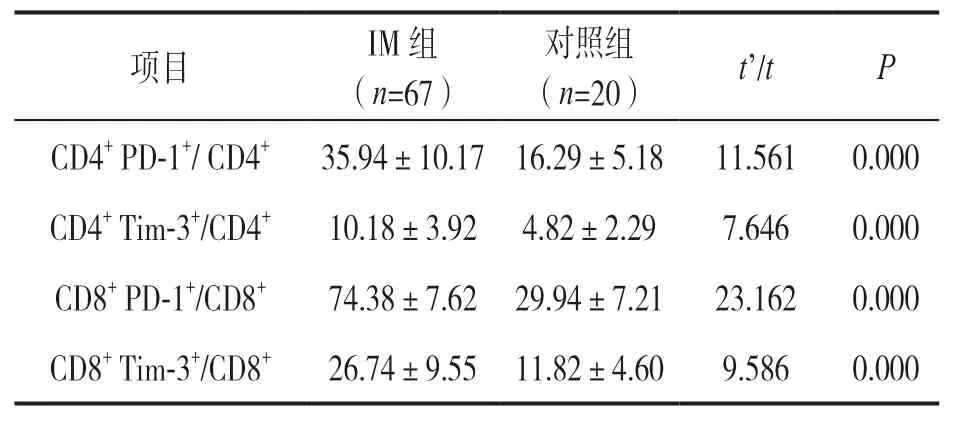
表1 IM组和对照组CD4+和CD8+ T细胞上PD-1和Tim3表达百分比(%)比较
图1 PD-1和Tim-3表达流式图
2.2 IM组和对照组血浆PD-1及Tim-3水平比较 见表2。与对照组比较,IM患儿血浆PD-1和Tim-3浓度明显升高(均P<0.01)。ROC曲线分析,血浆PD-1和Tim-3浓度诊断IM的曲线下面积分别为0.794(95%可信区间为0.694~0.894,P=0.000)和0.722(95%可信区间为0.611~0.833,P=0.003),Youden指数最大点对应的诊断界值分别为1.24 ng/ml 和0.44 ng/ml,血浆PD-1的敏感度和特异度分别为62.7%和85.0%,血浆Tim-3的敏感度和特异度分别为65.7%和75.0%,两者联合诊断的敏感度和特异度分别为52.2%和95.0%,ROC曲线见图2。相关性分析,血浆PD-1和Tim-3水平呈正相关(r=0.63,P<0.01)。

表2 IM组和对照组血浆PD-1 及Tim-3水平(ng/ml)比较
3 讨论
细胞免疫异常是EB病毒感染后发病和转归的关键因素。研究发现[5-6]:急性期IM患者CD8+T细胞迅速增加;CD4+T细胞分化漂移,效应性Th1细胞增加;具有免疫抑制作用的CD4+CD25+调节性T细胞和CD4-CD8-双阴性T细胞增加等,表明IM患者抗病毒和抑制性免疫反应可同时存在。
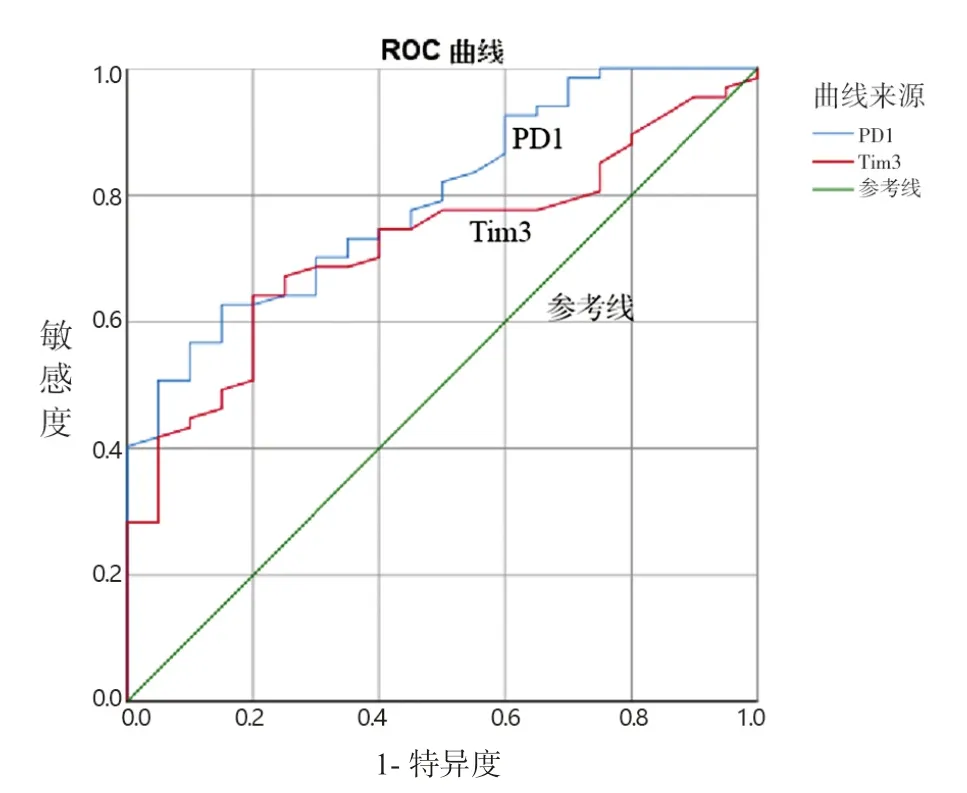
图2 PD-1,Tim-3的ROC曲线
本次实验发现:较对照组,IM患儿CD4+和CD8+T细胞表面PD-1 及Tim-3表达明显升高,血浆中PD-1和Tim-3水平明显升高。PD-1 在活化的淋巴细胞中诱导性的表达上调,能抑制T细胞增殖和IL-2 产生,许多病毒和肿瘤均是通过PD-1 途径逃避机体的免疫防御和监视。CD4+T细胞主要包括辅助性T细胞和调节性T细胞,IM患者不论哪种类型CD4+T细胞PD-1表达增加,都导致机体快速清除病毒的能力减弱,而且会导致CD8+T细胞向效应性的细胞毒性细胞分化减少。CD8+T细胞主要包括抑制性和细胞毒性细胞,IM患儿CD8+T细胞PD-1表达升高,从理论上讲是促进抑制性功能和减弱细胞毒作用,但CHATTERJEE 等[7]发现PD-1 阳性CD8+T细胞保留了增殖、细胞因子产生和细胞毒性的能力,而且在EB病毒特异性细胞毒性CD8+T 上也发现升高的PD-1表达[6],提示IM患儿PD-1表达升高可能在抗病毒和维持过度的免疫应答方面都起着一定的作用。Tim-3 负性调节T细胞的应答反应,过表达能引起病毒感染过程中T细胞的衰竭,引起免疫功能无能。研究发现越来越多的肿瘤细胞对抗PD-1 发生耐药,而抗Tim-3和抗PD-1 联合用药可以解决该问题[8],也证明了Tim-3 在免疫抑制中的关键作用。与其他免疫检查点分子不同,Tim-3 不是在所有的T细胞活化后表达增加,只在Th1 和具有细胞毒作用的CD8+T 中表达上调。IM患儿CD4+和CD8+T细胞Tim-3表达增高,提示两种主要的抗病毒效应细胞存在免疫功能被抑制。血浆PD-1和Tim-3 主要来自于膜型分子的裂解或细胞基因编码产生,不论是膜型还是可溶性分子,均与受体结合的信号途径发挥作用。PD-1和Tim-3 与其受体的信号途径可致使病毒特异性T细胞的失能及耗竭,IFN-γ,IL-2 和TNF等抗病毒的细胞因子水平降低,导致病毒感染的持续或潜伏[8-9],但新的研究似乎并不支持PD-1 抗体应用于EBV感染。ROC曲线显示:血浆PD-1和Tim3浓度对诊断IM的灵敏度不佳,而特异度较好,两者联合诊断IM的特异度可达95%,显示其血浆水平在排除性诊断中具有一定的价值。IM患儿血浆PD-1和Tim3水平呈正相关,提示两者在抑制性功能上具有协同作用。
综上所述,IM患儿PD-1和Tim表达水平升高,一方面降低了免疫应答,另一方面可能预防了过激的免疫反应,维持机体相对的免疫自稳,致使病毒静息和潜伏起来。

