人乳头瘤病毒疫苗临床应用中国专家共识
通信作者:马 丁,魏丽惠,谢 幸,孔北华
1华中科技大学同济医学院附属同济医院妇产科,武汉 430030,E-mail:dma@tjh.tjmu.edu.cn 2北京大学人民医院妇产科,北京 100044,E-mail:weilhpku@163.com 3浙江大学医学院附属妇产科医院,杭州 310006,E-mail:xiex@zju.edu.cn 4山东大学齐鲁医院妇产科,济南 250012,E-mail:kongbeihua@sdu.edu.cn
人乳头瘤病毒(human papilloma virus,HPV)疫苗接种是预防HPV感染的有效方法,是防控HPV感染相关疾病的一级预防措施。对于一般人群的HPV疫苗接种已有规范性指南,但对于高危、特殊人群如何接种HPV疫苗,尚未达成共识。中华医学会妇科肿瘤学分会与中国优生科学协会阴道镜和宫颈病理学分会组织专家,依循医学证据,结合我国国情和临床实际,达成以下共识。
1 人乳头瘤病毒及其流行病学
HPV是双链DNA病毒,可引起人体皮肤黏膜上皮增生[1]。HPV主要通过性生活或密切接触传播。80%以上的女性一生中至少有过一次HPV感染,90%以上的HPV可在感染2年内自然清除,仅不足1%的患者发展至子宫颈癌前病变和子宫颈癌[2-3]。高危型HPV持续性感染是下生殖道高级别上皮内病变和癌发生的必要因素,已成为严重威胁女性健康的公共卫生问题。
1.1 基因型别和分类
目前已确定的HPV型别有200余种,根据其致癌性分为高危型和低危型。我国国家药品监督管理局根据世界卫生组织(World Health Organization,WHO)国际癌症研究机构(International Agency for Research on Cancer,IARC)的建议,将HPV 16/18/31/33/35/39/45/51/52/56/58/59/68定义为高危型,而将HPV 26/53/66/73/82定义为中危型[4],其中以HPV 16/18诱发癌变的风险最高。
1.2 感染率和基因型分布
一项纳入了194项研究、1 016 719名女性的荟萃分析结果显示,子宫颈细胞学正常的女性,高危型HPV感染率为11.7%[5]。随着病变级别的加重,HPV感染率明显上升,其在子宫颈细胞学结果为无明确意义的非典型鳞状上皮细胞(atypical squamous cells of undetermined significance,ASCUS)改变的女性中为52.5%,在低级别鳞状上皮内病变(low-grade squamous intraepi-thelial lesion,LSIL)的女性中为74.8%,在高级别鳞状上皮内病变(high-grade squamous intraepithelial lesion,HSIL)的女性中高达88.9%[6]。子宫颈癌患者中HPV 16的感染率为55.2%,HPV 18的感染率为14.2%,其他型别的HPV按其感染率排序依次为HPV 45、33、58、31、52、35、39、59[7]。此外,关于HPV 16的感染率,鳞癌(61.7%)高于腺癌(50.0%);而关于HPV 18、HPV 45的感染率,腺癌(32.3%、11.9%)高于鳞癌(8.3%、5.4%)[8]。
在中国170万名一般人群中开展的HPV流行病学研究发现,最常见的5种HPV型别分别为HPV 16(3.52%)、HPV 52(2.20%)、HPV 58(2.10%)、HPV 18(1.20%)和HPV 33(1.02%)。我国子宫颈细胞学正常女性高危型HPV的感染率约为7.1%,而ASCUS、LSIL、HSIL女性高危型HPV的感染率分别为37.1%、90.9%和93.06%[9]。69.1%的子宫颈浸润癌归因于HPV 16/18感染[8]。子宫颈鳞癌中,HPV 16(76.7%)和HPV 18(7.8%)感染最常见,其次是HPV 31(3.2%)、HPV 52(2.2%)、HPV 58(2.2%)和HPV 33(1.0%);子宫颈腺癌中HPV 16和HPV 18的感染率分别为35.1%和30.6%[10]。
1.3 感染相关疾病负担
HPV感染相关疾病在世界范围内造成了巨大的卫生和经济负担。HPV感染所致癌症比例存在显著地域差异,在澳大利亚、新西兰和美国,不足3%的女性癌症归因于HPV感染;在印度和撒哈拉以南的非洲地区,超过30%的女性癌症归因于HPV感染[11]。高危型HPV感染与全球约4.5%的癌症新发病例相关(约63万例),其中女性约57万例(8.6%),男性约6万例(0.8%)[12]。据报道,2018年全球范围内子宫颈癌新发病例约57.0万例[13],死亡病例约31.1万例,已成为15~44岁女性第2位常见肿瘤和第3位死亡原因[14]。我国子宫颈癌新发病例约10.6万例,每年死亡病例约4.8万例[15]。几乎100%的子宫颈癌、88%的肛门癌、50%的阴茎癌、43%的外阴癌以及口咽癌等肿瘤均与高危型HPV持续性感染有关[16]。
低危型HPV感染引起生殖器疣等良性病变,约90%的生殖器疣由HPV 6/11感染引起[17]。全球生殖器疣患病率(包括新发和复发病例)为(160~289)/10万(中位数为194.51/10万),其中男性新发生殖器疣发病率为(103~168)/10万(中位数为137/10万),女性发病率为(76~191)/10万(中位数为120.5/10万)[12]。
2 人乳头瘤病毒疫苗
2.1 免疫机制
HPV疫苗主要诱导机体体液免疫反应,产生的中和性抗体在HPV进入机体时即可与病毒抗原结合,从而防止HPV感染。通过预防初次HPV感染和减少持续性HPV感染可阻断子宫颈癌前病变的发生和发展。疫苗产生的抗体可透过血管壁,在局部上皮组织形成较高浓度。当HPV通过黏膜上皮的细微伤口接触基底层细胞时,位于上皮组织中的抗体即可与病毒结合,发挥中和作用。
2.2 免疫原性
国内外研究显示,双价、四价和九价HPV疫苗在完成全程免疫接种后,均可观察到较高的疫苗相关型别抗体转阳率(96%~100%)和血清学抗体滴度[18-20]。我国临床研究结果显示,9~17岁女性接种双价和四价HPV疫苗后免疫应答较强,血清学抗体滴度是18~26岁女性的1.42~3.00倍,而18~25岁女性与26~45岁女性抗体滴度相似[21-23]。目前关于国内九价HPV疫苗免疫原性的数据有限。一项国外Ⅲ期临床试验显示,16~17岁女性接种九价HPV疫苗后HPV 6/11/16/18的抗体滴度均高于18~26岁女性,免疫应答与接种四价HPV疫苗相当[24]。东亚女性的随机对照试验(randomized controlled trial,RCT)也显示,接种四价和九价HPV疫苗后,抗HPV 6/11/16/18的抗体转阳率均>96%[25]。
2.3 保护效力
HPV疫苗在预防HPV型别相关疾病的临床试验中显示出87.3%~100.0%的保护效力[26-28]。
2.3.1 双价HPV吸附疫苗
一项针对18~25岁中国女性的临床研究随访72个月的结果显示,双价HPV吸附疫苗对HPV 16/18相关的子宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN)2~3级或原位腺癌(adenocarcinoma in situ,AIS)的保护效力为87.3%[29]。
2.3.2 国产双价HPV疫苗(大肠杆菌)
国产双价HPV疫苗(大肠杆菌)对18~45岁中国女性的HPV 16/18相关CIN 2~3级、AIS或子宫颈癌的保护效力为100%[30]。
2.3.3 四价HPV疫苗
四价HPV疫苗对18~25岁女性具有很好的保护作用。一项针对20~45岁中国女性的临床研究随访78个月的结果显示,四价HPV疫苗对HPV 16/18相关CIN 2~3级、AIS和子宫颈癌的保护效力均为100%[20]。在完成针对小年龄组的免疫桥接和安全性试验后,2020年11月国家药品监督管理局批准四价HPV疫苗应用于9~19岁女性。全球针对16~26岁女性的Ⅲ期临床研究显示,四价HPV疫苗对HPV 16/18相关的CIN 2+的保护效力为98.2%[31]。2020年,一项纳入近170万名女性的瑞典真实世界研究显示,至少接种1剂四价HPV疫苗即可大幅降低浸润性子宫颈癌的患病风险;17岁之前接种的女性获益更显著,浸润性子宫颈癌发病率降低达88%[32]。
2.3.4 九价HPV疫苗
目前尚无中国临床研究数据。国外临床研究显示,九价HPV疫苗对16~26岁女性的HPV 6/11/16/18相关持续性感染和子宫颈癌的保护效力与四价HPV疫苗相当[33]。九价HPV疫苗对16~26岁东亚女性亚组的HPV 31/33/45/52/58相关CIN 1+的保护效力为100%,对HPV 31/33/45/52/58相关的6个月及以上子宫颈、阴道、外阴、肛门持续性感染的保护效力为95.8%[34]。目前全球尚无关于26~45岁女性的九价HPV疫苗相关免疫原性和保护效力的数据。
2.4 安全性
2017年WHO发布的HPV疫苗立场文件指出,现有证据表明目前已上市的HPV疫苗安全性良好,不良反应与其他疫苗相似[20,35-37]。
3 普通人群人乳头瘤病毒疫苗接种
3.1 国内现有HPV疫苗
2019年《子宫颈癌等人乳头瘤病毒相关疾病免疫预防专家共识(简版)》指出:接种HPV疫苗是子宫颈癌防控工作的重要组成部分[37]。目前,HPV疫苗在我国属于非免疫规划疫苗(第二类疫苗),接种单位应遵照《疫苗流通和预防接种管理条例》和《预防接种工作规范》的要求,按照疫苗说明书和“知情同意、自愿自费”原则,科学告知受种者或其家长后,为受种者及时提供疫苗接种。目前,我国国家药品监督管理局已批准上市4种HPV疫苗:国产双价HPV疫苗(大肠杆菌)、双价HPV吸附疫苗、四价和九价HPV疫苗(表1)。
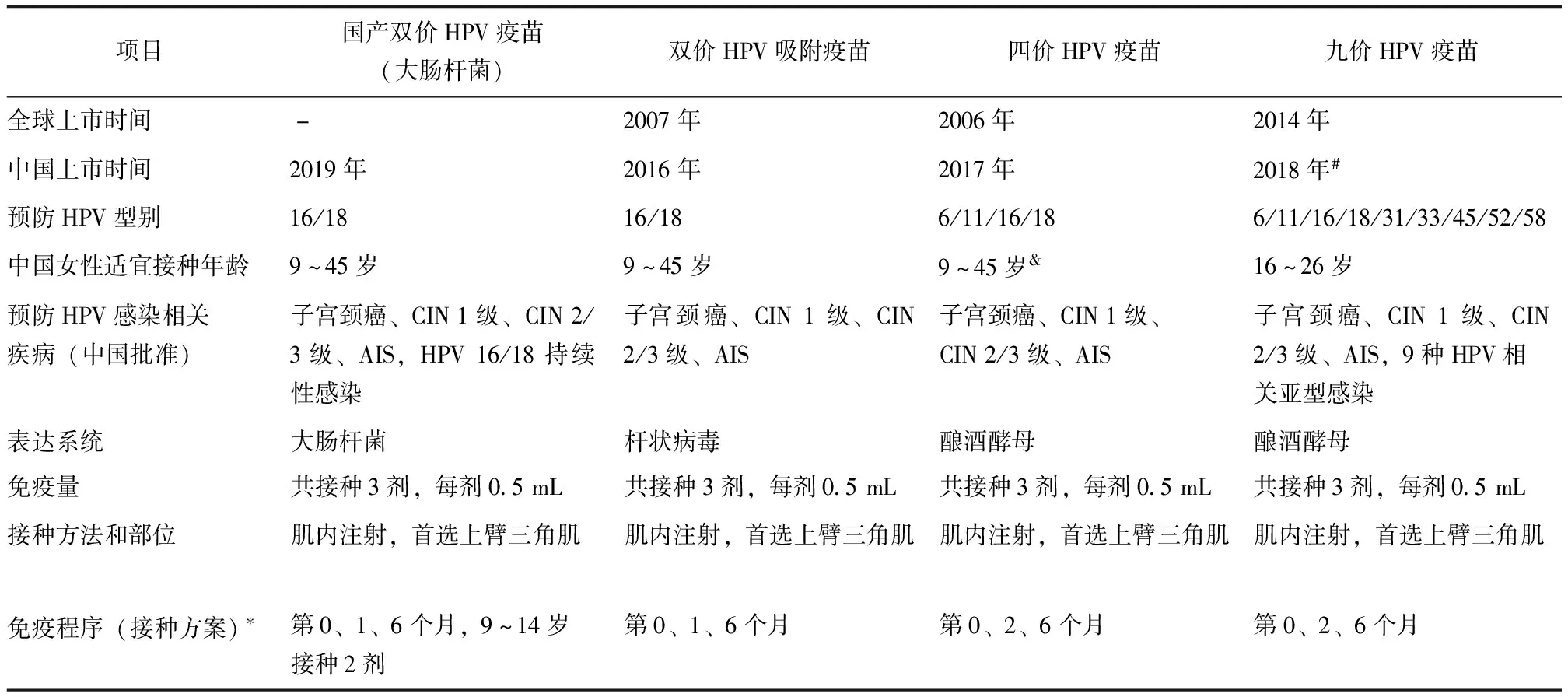
表 1 我国国家药品监督管理局批准上市的HPV疫苗特点和接种程序
3.2 普通人群HPV疫苗接种
3.2.1 国外权威指南对于成年女性接种HPV疫苗的推荐
WHO建议主要目标接种人群为未暴露于疫苗相关HPV基因型的青春期女性[7]。2019年美国疫苗免疫实践咨询委员会(Advisory Committee on Immuniza-tion Practices,ACIP)[39]和美国疾病预防控制中心[40]均建议在11岁或12岁开始接种HPV疫苗,也可从9岁开始接种。HPV疫苗可对尚未感染的HPV型别提供保护,即使感染了1种或多种HPV型别的受种者仍可从疫苗接种中获得保护。2017年美国妇产科医师协会(American College of Obstetricians and Gynecolo-gists,ACOG)指南提出,不论有无性行为或既往暴露于HPV,均推荐接种HPV疫苗[41]。2019年《人乳头瘤病毒:加拿大免疫指南》提出在性行为开始后进行HPV疫苗接种也是有益的[42]。
2020年美国癌症协会(American Cancer Society,ACS)发布了《人乳头瘤病毒疫苗接种指南更新》,其中最重要的变化是,不再建议>26岁人群补种HPV疫苗[43]。主要原因是:①此年龄段人群通过接种HPV疫苗预防癌症的获益很低;②患者与医生沟通过程中的不同观点可能干扰常规人群接种;③对于究竟哪些人群接种HPV疫苗能获益缺乏充分指引。2019年ACIP也明确指出:不建议所有>26岁人群补种HPV疫苗;HPV疫苗未批准用于>45岁人群[39]。
3.2.2 我国HPV疫苗接种背景
我国城市女性初次性行为中位年龄为22岁,农村为21岁,超过10%的15~19岁女性已有性生活[44]。国产双价HPV疫苗(大肠杆菌)研究显示,9~14岁女性接种2剂次可获得与接种3剂次相同的免疫效果[23]。因此,13~15岁女性在首次性行为前接种HPV疫苗的获益可最大化。
纳入198项研究约5.1万例中国女性的汇总数据显示,25~45岁女性高危型HPV感染率高达19.9%[45];随着年龄变化,高危型HPV感染呈现17~24 岁和40~44岁双峰分布[46];且中国女性以单一HPV型别感染为主(73.6%)[19]。结合我国女性高危型HPV感染流行病学特点和HPV疫苗在27~45岁女性中的保护效力,加之我国接种政策和子宫颈癌筛查覆盖率低等国情,个体化接种策略是必要的,不应完全否定27~45岁女性接种HPV疫苗的意义。
推荐意见:依据以上证据,优先推荐9~26岁女性接种HPV疫苗,特别是未满17岁女性;同时推荐27~45岁有条件的女性接种HPV疫苗。
4 高危、特殊人群人乳头瘤病毒疫苗接种
4.1 HPV感染/细胞学异常女性
因免疫原性过低,HPV自然感染所产生的抗体难以预防相同型别HPV再次感染[18,47]。然而,HPV疫苗对既往疫苗型别HPV再感染(一过性或持续性HPV感染)的女性具有显著保护效力。在16~26岁既往感染疫苗型别HPV(血清HPV抗体阳性而子宫颈HPV DNA阴性)的女性中,四价HPV疫苗对疫苗型别HPV再感染或其他未感染疫苗型别HPV所致CIN 1+的保护效力达100%[28]。对24~45岁既往感染疫苗型别HPV的女性,四价HPV疫苗对HPV 16/18相关CIN 1+的保护效力为66.9%[48]。对16~26岁已感染疫苗型别HPV的女性,九价HPV疫苗对覆盖型别中其他未感染型别所致的CIN 2+的保护效力为91.1%[49]。HPV疫苗对细胞学异常女性同样具有较高保护效力。一项针对约1.4万名16~26岁年轻女性的国际多中心RCT研究结果显示,接种九价HPV疫苗6个月后,初始细胞学异常者HPV 31/33/45/52/58持续性感染率在HPV疫苗组和对照组分别为8/639(42/万人·年)和138/649(770.5/万人·年),高危型HPV持续性感染风险在疫苗组下降94.6%(95% CI:89.3%~97.7%)[50]。
推荐意见:依据以上证据,适龄女性无论是否存在HPV感染或细胞学异常,均推荐接种HPV疫苗(接种前无需常规行细胞学及HPV检测)。
4.2 妊娠期与哺乳期女性
4.2.1 妊娠期女性
妊娠期女性接种HPV疫苗的研究数据有限。虽然动物实验未发现接种HPV疫苗对母体和子代造成直接或间接不良影响,然而囿于伦理,不可能实施临床研究评估HPV疫苗接种对妊娠期女性及其子代预后的影响。
双价HPV疫苗在动物实验中未见不良妊娠和子代结局,但缺乏人类研究数据。2015年的一项长期随访研究发现,与未接种HPV疫苗的女性相比,接种双价HPV疫苗且3个月内受孕女性的流产风险无明显增加[51]。国际相关机构曾对妊娠期间意外接种双价HPV疫苗的女性进行注册随访,发现此人群中胎儿先天畸形和自然流产的发生率与普通人群相比并无差异[52]。
四价HPV疫苗在动物实验中亦未发现不良妊娠和子代结局。国际相关机构同样对妊娠期间意外接种四价HPV疫苗的女性进行了注册随访[53]。一项纳入5项15~45岁女性Ⅲ期临床试验的联合分析显示,接种四价HPV疫苗组与安慰剂组女性妊娠后自然流产率(18.2%比19.5%)和胎儿先天发育异常率(2.0%比1.5%)均无显著差异,胎儿晚期死亡率均低于1%[54]。丹麦对近65万名妊娠女性进行为期7年的四价HPV疫苗接种的安全性观察,未发现接种HPV疫苗会增加不良妊娠结局[55]。
接种九价HPV疫苗是否会导致不良妊娠结局同样尚无定论。2014至2017年美国疫苗不良事件报告系统(vaccine adverse event reporting system,VAERS)记录了82例接种九价HPV疫苗的妊娠女性信息,自然流产3例(3.7%),阴道出血2例(2.4%),提示接种九价HPV疫苗未增加不良妊娠结局风险[56]。然而,也有研究发现受孕前或受孕后30 d内接种九价HPV疫苗者自然流产风险有所增加(RR=2.04)[57]。
2014年美国ACIP[58]和2017年WHO发表的HPV疫苗立场文件[7]声明,基于妊娠期HPV疫苗接种数据有限,不推荐妊娠期女性预防性接种HPV疫苗,应将疫苗接种推迟至妊娠结束后。近期计划妊娠者不推荐接种HPV疫苗,且在完成最后一剂接种2个月内应尽量避免受孕。若疫苗接种后发现已怀孕,应将未完成接种剂次推迟至分娩后再行补充接种。接种HPV疫苗前无需妊娠检测。若妊娠期间完成接种,则无需干预。
推荐意见:依据以上证据,不推荐妊娠期女性预防性接种HPV疫苗。若近期准备妊娠,建议推迟至哺乳期后再行接种。若接种后意外妊娠,应停止未完成剂次的接种;已完成接种者,无需干预。
4.2.2 哺乳期女性
哺乳期女性接种HPV疫苗研究数据尤为缺乏。2017年ACOG指出哺乳期女性可接种HPV疫苗,该重组疫苗不影响母乳喂养的安全性[41]。韩国妇科肿瘤学会也认为哺乳期女性可接种九价HPV疫苗[59]。
推荐意见:虽然目前临床试验尚未观察到血清HPV抗体经母乳分泌,但鉴于多种药物可经母乳分泌,且缺乏哺乳期女性接种HPV疫苗的安全性研究数据,因此,慎重推荐哺乳期女性接种HPV疫苗。
4.3 HPV相关病变治疗史人群
4.3.1 下生殖道癌前病变/癌治疗史人群
既往下生殖道HSIL的女性是一类特殊群体,治疗后可能再次发生HPV感染或感染持续存在。HSIL经局部保守治疗后,CIN 2+复发率高达5%~10%,浸润癌风险较普通人群高2~4倍[25]。一项在韩国开展的20~45岁既往HSIL行子宫颈环形电切术(loop electrosurgical excision procedure,LEEP)治疗后接种四价HPV疫苗的回顾性分析显示,与未接种者相比,接种四价HPV疫苗可显著降低HPV16/18相关HSIL(CIN2~3)复发风险(P<0.05),治疗后未接种HPV疫苗是CIN 2+复发的独立危险因素(HR=2.840,95% CI:1.335~6.042,P<0.01)[60]。一项PATRICIA研究的事后分析结果表明,对于发生HSIL(随访4年)且接受切除性治疗的15~25岁女性,无论接种双价HPV疫苗前的HPV DNA、HPV 16/18血清学或子宫颈细胞学状态如何,术前接种HPV疫苗可使术后CIN 2+的复发风险降低88.2%(95% CI:14.8%~99.7%)[61]。这表明接种HPV疫苗后接受LEEP的HSIL患者可能继续受益,从而降低术后CIN 2+复发风险。2018年意大利前瞻性病例对照研究表明,宫颈病变术后接种四价HPV疫苗对于预防CIN 2+复发的保护效力达81.2%(95% CI:34.3%~95.7%)[62]。2018年意大利一项前瞻性RCT研究结果显示,接种四价HPV疫苗可显著降低HSIL者接受LEEP术后的LSIL复发率(P<0.05)[63]。既往HSIL患者手术治疗后立即接种HPV疫苗,可诱导子宫颈基底层细胞产生大量抗体,阻止再生组织自身感染,避免HPV进入未感染的基底层细胞,从而避免CIN 2+复发[60]。
推荐意见:依据以上证据,推荐既往HSIL接受过消融或切除性治疗的适龄女性接种HPV疫苗。对于子宫颈癌治疗后接种HPV疫苗是否获益尚需进一步研究证实。
4.3.2 肛门癌前病变/癌治疗史人群
目前针对女性肛门上皮内瘤变(anal intraepi-thelial neoplasia,AIN)/癌治疗史的临床研究有限,研究多以男性为主。临床研究发现,与未接种疫苗的男性相比,接种四价HPV疫苗可显著降低男男性交(men who have sex with men,MSM)患者AIN 2+复发[64]。对27岁以上既往AIN 2+的人类免疫缺陷病毒(human immunodeficiency virus,HIV)阳性的MSM患者接种四价HPV疫苗可使肛门癌的终身风险降低60.77%[65]。
推荐意见:依据以上证据,推荐既往AIN 2+适龄女性,特别是肛门鳞状上皮性癌高风险人群[包括HIV阳性的女性,既往阴道上皮内瘤变(vaginal intraepithelial neoplasia,VaIN)2+和外阴上皮内瘤变(vulvar intraepithelial neoplasia,VIN)2+的女性患者]接种HPV疫苗。
4.4 遗传易感人群、高危生活方式人群
4.4.1 遗传易感人群
遗传易感因素可能影响HPV感染的敏感性、持续性以及子宫颈癌的发展速度。环境因素是肿瘤发生的始动因素,而个体遗传特征决定了肿瘤的易感性[66]。瑞典国家癌症数据库登记了约12.5万例子宫颈原位癌和1.4万例子宫颈浸润癌,以此评估的子宫颈癌家族相关危险度(familial relative risk,FRR)分别为1.8和2.3[67],共有基因遗传度占子宫颈癌易感性总变异的27%(95% CI:26%~29%)[68]。子宫颈癌遗传度估计值明显高于结直肠癌、肺癌和黑色素瘤[68]。子宫颈癌的全基因组关联分析(genome-wide association study,GWAS)已识别多个遗传易感变异位点,发现其多与免疫反应基因有关。瑞典人群GWAS发现HLA基因(HLA-DPB2等)突变与子宫颈癌易感性显著相关,可能通过免疫应答影响子宫颈癌的发生[69]。中国人群GWAS除证实了先前报道的6p21.32位点突变,新发现了2个位于EXOC1和GSDMB基因(4q12和17q12)区段的遗传易感变异位点,其编码的蛋白分别与固有免疫和肿瘤细胞增殖有关[70]。
推荐意见:依据以上证据,优先推荐遗传易感位点变异的适龄女性(HLA-DPB2、EXOC1和GSDMB基因突变等)接种HPV疫苗。建议遗传易感人群在首次性行为之前接种,即使性暴露后亦应尽早接种。
4.4.2 高危生活方式人群
性生活过早、多性伴、多孕、多产、吸烟、长期口服避孕药、性传播疾病者等是子宫颈癌的高危因素[71]。50%以上的年轻女性在开始性行为后的3年内即会发生HPV感染[72]。青春期女孩下生殖道发育尚未成熟,过早性生活会使子宫颈上皮多次重复暴露于某些细菌或病毒,产生潜在细胞变异[44]。性生活过早、多性伴等因素是HPV感染的重要协同因素[44]。口服避孕药与HPV感染明显相关,用药时间长(5年以上)者HPV感染风险增加[73]。
推荐意见:依据以上证据,优先推荐高危生活方式的适龄女性尽早接种HPV疫苗,即使已知HPV感染/细胞学异常及既往接受过HSIL治疗者亦推荐接种。
4.5 免疫功能低下人群
包括HIV感染者;自身免疫性疾病患者,如自身免疫炎性风湿病(autoimmune inflammatory rheu-matic diseases,AIIRD)、桥本甲状腺炎等;肥胖、糖尿病、肾衰竭血液透析者;器官/骨髓移植后长期服用免疫抑制剂患者。
4.5.1 HIV感染者
HIV以人体免疫系统CD4+T细胞为攻击目标,缺乏CD4+T细胞辅助的免疫系统将难以杀灭入侵的病原体及体内癌细胞,导致继发感染或恶性肿瘤。CD4+T细胞计数低于200 cells/mL时,细胞免疫几乎完全失去功能[74]。
18~25岁HIV感染女性接种双价HPV疫苗后免疫反应不受CD4+T细胞计数和HIV病毒载量的影响[75]。13~45岁HIV感染女性接种四价HPV疫苗是安全的,且具有免疫原性,其中CD4+T细胞>200 cells/mL者的抗体应答率为85%~100%,CD4+T细胞≤200 cells/mL者的抗体应答率为75%~93%[76]。
四价HPV疫苗可有效减少HIV感染女性的HPV疫苗相关型别的持续性感染,接种组HIV感染女性HPV 6/11/16/18持续性感染比率低于未接种组[2.3/(100人·年)比6.0/(100人·年)][77]。
推荐意见:依据以上证据,优先推荐HIV感染的适龄女性接种HPV疫苗。
4.5.2 自身免疫性疾病患者
包括AIIRD、桥本甲状腺炎等。AIIRD指系统性红斑狼疮(systemic lupus erythematosus,SLE)、风湿性关节炎、幼年特发性关节炎、结缔组织病、干燥综合征、抗磷脂综合征、系统性硬化、大细胞动脉炎、多发性结节性动脉炎、白塞综合征、复发性多软骨炎、周期性发热综合征等。针对AIIRD患者的HPV疫苗接种证据主要源于SLE的研究。18~35岁SLE女性接种四价HPV疫苗后安全性良好,疫苗相关型别的抗体应答率可达76%~95%[78]。
推荐意见:依据以上证据,推荐患有自身免疫性疾病的适龄女性接种HPV疫苗。
4.5.3 糖尿病患者、肾衰竭接受血液透析者等
糖尿病是一种代谢性疾病。1型糖尿病属于自身免疫性疾病;2型糖尿病因体重过重或缺乏运动,随病情进展胰岛素分泌逐渐不足。糖尿病患者免疫力随血糖升高而下降。
推荐意见:推荐患有1型或2型糖尿病的适龄女性接种HPV疫苗。
一项纳入57例9~21岁慢性肾脏病(chronic kidney disease,CKD)、血液透析和肾移植患者的四价HPV疫苗研究显示,CKD组和透析组患者的4种抗体应答率均为100%;肾移植组患者抗体应答率为50%~75%[79]。另一项纳入60例Ⅳ期、Ⅴ期和ⅤD期CKD患者的四价HPV疫苗研究显示,接种后抗体应答率为98.2%~100.0%[80]。
推荐意见:依据以上证据,推荐肾衰竭接受血液透析的适龄女性在病情允许时接种HPV疫苗。对全身脏器功能差、预期寿命有限者不推荐接种。
4.5.4 器官/骨髓移植术后长期服用免疫抑制剂者
器官/骨髓移植术后长期服用免疫抑制剂者在HPV疫苗领域的临床试验样本量小,与正常人群相比,此类人群接种HPV疫苗的抗体应答率低。肾移植者发生肛门生殖区癌前病变/癌的风险显著升高(HR=2.1~51.1)[81]。18~35岁接受过器官(包括肾、肺、心、肝)移植的女性接种四价HPV疫苗安全性好,接种后疫苗相关型别抗体应答率为52%~68%;与移植1年后接种相比,移植1年内接种HPV疫苗呈低免疫反应(85.2%比54.5%)[82],因此,移植1年后接种HPV疫苗更为有利。
推荐意见:依据以上证据,建议临床医生与患者共同探讨,根据疾病轻重差别给予个体化建议。对于预期寿命长的适龄女性,推荐移植1年后接种HPV疫苗;对于预期寿命有限者,不推荐接种。
5 不良反应与不良事件及其处理
疫苗不良反应(adverse reaction,AR)指合格疫苗在正常用法用量下出现与疫苗接种有明确因果关系的有害反应,一般可预见,与剂量相关。疫苗所含外来抗原和佐剂均可引起AR。疫苗不良事件(adverse event,AE)指疫苗接种过程中或之后出现的不良临床事件,但该事件未必与疫苗接种有因果关系。严重不良事件(serious adverse events,SAE)包括死亡、危及生命、残疾或丧失劳动力等。AR和AE均可发生在临床试验中和上市后两个阶段。
按国际医学科学组织委员会(Council for International Organizations of Medical Sciences,CIOMS)的推荐描述AR和AE频率,分为十分常见(≥10%)、常见(1%~10%,含1%)、偶见(0.1%~1.0%,含0.1%)、罕见(0.01%~0.10%,含0.01%)和十分罕见(<0.01%)[83]。
5.1 临床试验中的疫苗不良反应/事件
与其他疫苗一样,HPV疫苗在临床试验中出现的AR包括接种部位AR和全身AR,接种部位AR更为常见。
十分常见的接种部位AR依次为局部疼痛、肿胀和红斑;常见的接种部位AR为瘙痒和硬结。在四价HPV疫苗的安慰剂对照临床试验中,接种部位AR包括疼痛(84%)、肿胀(25%)和红斑(<25%);疫苗组疼痛较安慰剂组更常见:生理盐水对照组疼痛发生率为49%,铝佐剂对照组疼痛发生率为75%[84]。
九价HPV疫苗组接种者局部AR发生率略高于四价HPV疫苗组[33];双价HPV疫苗组接种者局部AR发生率也高于四价HPV疫苗组[85]。双价HPV疫苗组接种者局部疼痛、肿胀、红斑发生率分别为92.9%、36.5%和44.3%,四价HPV疫苗组分别为71.6%、21.8%和25.6%。约6%的接种者报告了严重疼痛[84]。接种部位AR多发生于接种后15 d内,多为轻、中度,大多可自然缓解,一般无需特殊处理。
全身AR有发热、头痛、眩晕、疲劳、肌肉痛、关节痛和胃肠道症状(恶心、呕吐、腹痛)等。四价HPV疫苗临床试验中仅发热十分常见,为10.1%,对照组为8.4%,其他AR的发生率均<0.5%[84]。九价和四价HPV疫苗组接种者全身AR发生率相近,分别为29.5%和27.3%;常见的全身AR为头痛,分别为14.6%和13.7%,发热分别为5.0%和4.3%[33]。双价和四价HPV疫苗的全身AR发生率也相似,但双价HPV疫苗组接种者疲劳和肌肉痛较四价HPV疫苗组多见(分别为49.8%比39.8%和27.6%比19.6%)[86]。眩晕或晕厥在青少年中更明显。这些全身AR常很轻微,有自限性,一般无需特殊处理。
中国双价HPV疫苗临床试验显示总体耐受性良好,尚无严重AR[87]。一项随访长达90个月的中国Ⅲ期RCT显示,四价HPV疫苗在成年女性中耐受性良好,安全性结果与全球临床试验和安全性监测研究所得结果一致[88]。临床试验中四价和双价HPV疫苗未报告疫苗相关SAE[7],九价疫苗相关的SAE发生率<0.1%[89]。死亡报告率极低,且未证实与HPV疫苗接种相关[90]。
5.2 上市后的疫苗不良反应/事件
全球已有超过2亿支HPV疫苗被使用,迄今收集到的数据显示,局部和全身AR与临床试验结果基本一致。
随着大规模人群接种,也监测到一些罕见AE,如吉兰-巴雷综合征(Guillain-Barré syndrome,GBS)、复杂性区域疼痛综合征、体位性心动过速综合征、静脉血栓栓塞、卵巢功能早衰、肌痛性脑脊髓炎、慢性疲劳综合征等,各国报道发生率不同,但基本不超过3/100万剂次。一项美国多中心研究显示,2006至2013年9~26岁女性共接种四价HPV疫苗1 423 399剂,接种后77 d内53例确诊静脉血栓栓塞,其中30例接种前有静脉血栓栓塞风险,发生率为0.2/100万[91]。目前尚无证据证明接种HPV疫苗增加这些疾病或症状的风险[92],也尚无证据证明其影响女性生殖功能。由于现有HPV疫苗均由抗原蛋白与佐剂组成,因此不能完全排除部分AE可能与佐剂有关,需要加强监测予以排除。
6 注意事项
6.1 HPV疫苗接种注意事项
对疫苗的活性成分或任何辅料成分有超敏反应者禁止接种HPV疫苗,注射本品后有超敏反应症状者,不应再次接种本品。对于以下人群,需慎用HPV疫苗:(1)有血小板减少症或其他可成为肌内注射禁忌证的凝血功能障碍者不宜接种;(2)妊娠期女性或备孕女性推迟至妊娠期结束后再接种,哺乳期女性接种时应谨慎;(3)急性疾病常伴有发热等全身症状,接种疫苗可能会加重症状,建议痊愈后接种;(4)因部分女性存在不同程度的经期不适,建议非经期接种。
6.2 接种HPV疫苗后仍应进行子宫颈癌筛查
(1)HPV疫苗对未暴露于疫苗相关HPV型别的人群保护效力较好,但对于存在HPV感染或相关疾病危险因素(如多性伴、既往感染过疫苗相关HPV型别、免疫缺陷等)的人群有效性降低;(2)HPV疫苗是预防性疫苗,不能治疗已感染的HPV及相关疾病,不能预防所有HPV型别感染,也不能阻止HPV感染至疾病进展;(3)少数子宫颈癌可能与HPV感染无关,特别是HPV阴性的特殊类型癌;(4)自2006年HPV疫苗上市以来,长期随访研究证实了HPV疫苗14年的保护效力,但目前尚无证据证实HPV疫苗有终身保护效力;(5)HPV疫苗所含型别有限,即使接种了HPV疫苗,机体仍处于对非疫苗型别HPV的感染风险中,因此,接种HPV疫苗后仍需继续进行子宫颈癌筛查。
HPV疫苗接种是预防HPV感染和相关疾病的有效、安全方法。低龄人群接种效果优于高龄人群,性暴露前接种免疫效果最佳。HPV疫苗不仅适用于普通人群,同样推荐用于高危、特殊人群(表2)。对于具有遗传易感、高危生活方式和HIV感染的适龄女性应优先推荐接种HPV疫苗。无论是否存在HPV感染、细胞学是否异常的适龄女性均可接种HPV疫苗。有HPV相关病变治疗史的适龄女性患者,接种HPV疫苗可能降低复发率。近期有妊娠计划和妊娠期、哺乳期女性不宜接种HPV疫苗。接种HPV疫苗后仍应进行子宫颈癌筛查。

表 2 普通和特殊人群(女性)HPV疫苗接种的推荐级别*#
共识专家组成员(以姓氏笔画为序):
万小平(上海市第一妇婴保健院),马丁(华中科技大学同济医学院附属同济医院),王丹波(辽宁省肿瘤医院),王世宣(华中科技大学同济医学院附属同济医院),王建六(北京大学人民医院),王临虹(中国疾病预防控制中心妇幼保健中心),王新宇(浙江大学医学院附属妇产科医院),尤志学(南京医科大学第一附属医院/江苏省人民医院),尹如铁(四川大学华西第二医院),孔北华(山东大学齐鲁医院),丛青(复旦大学附属妇产科医院),毕蕙(北京大学第一医院),曲芃芃(天津市中心妇产科医院),乔友林(中国医学科学院肿瘤医院),向阳(中国医学科学院北京协和医院),刘红(四川省肿瘤医院/四川省第二人民医院),刘继红(中山大学肿瘤防治中心),李双(华中科技大学同济医学院附属同济医院),李亚里(中国人民解放军总医院第一医学中心),李克敏(四川大学华西第二医院),李明珠(北京大学人民医院),李隆玉(江西省妇幼保健院),杨帆(中山大学肿瘤防治中心),杨佳欣(中国医学科学院北京协和医院),吴小华(复旦大学附属肿瘤医院),吴令英(中国医学科学院肿瘤医院),沈丹华(北京大学人民医院),宋坤(山东大学齐鲁医院),张国楠(四川省肿瘤医院/四川省第二人民医院),张淑兰(中国医科大学附属盛京医院),郄明蓉(四川大学华西第二医院),周琦(重庆大学附属肿瘤医院/重庆市肿瘤医院),赵霞(四川大学华西第二医院),郝敏(山西医科大学第二医院),哈春芳(宁夏医科大学/宁夏医科大学总医院),徐丛剑(复旦大学附属妇产科医院),高雨农(北京大学肿瘤医院),郭瑞霞(郑州大学第一附属医院),崔恒(北京大学人民医院),康山(河北医科大学第四医院),梁志清(陆军军医大学第一附属医院),隋龙(复旦大学附属妇产科医院),程文俊(南京医科大学第一附属医院/江苏省人民医院),谢幸(浙江大学医学院附属妇产科医院),薛凤霞(天津医科大学总医院),魏丽惠(北京大学人民医院)
执笔人
李双,李明珠,丛青,杨帆,刘红,李克敏,宋坤,尹如铁,王新宇,张国楠,隋龙,刘继红,孔北华,谢幸,魏丽惠,马丁
利益冲突:无

