N掺杂TiO2纳米纤维光催化氧化NO
欧小雨,沈群,黎小芳,陆亚超,吕康乐*
(1 中南民族大学 资源与环境学院&教育部催化与能源材料化学重点实验室,武汉430074;2 杭州市质量技术监督检测院,杭州 310019;3 武汉科技大学 化学与化工学院,武汉 430081)
经济的快速发展带来了严峻的环境污染问题.作为一种典型的气态污染物,氮氧化物(NOx)主要由NO和NO2组成,它们主要来源于化石能源的高温燃烧.其中,NO是一种剧毒气体(毒性比CO强50倍),它可以与血铁蛋白结合而使其丧失与氧结合的能力.如果一次性大量吸入NO,则会引起机体严重缺氧,并导致迅速死亡.虽然一般认为NO可以与空气中的氧气迅速反应而转化成NO2,但是低浓度的NO氧化速率很慢[1].因此,如何消除空气中低浓度的NO,并避免转化成毒性更强的NO2气体,是大家共同面临的难题.
TiO2为代表的半导体光催化氧化技术,因有效利用太阳能和空气中的氧气分解有毒物质,引起科研工作者的极大兴趣[2-4].然而,普通的TiO2仍面临太阳光利用率低和光生载流子极易复合等问题,难以实现大规模应用[5-6].为了进一步改善TiO2光吸收的同时,提高光生电子-空穴的分离和迁移效率,通常采用掺杂策略来改变TiO2的电子结构,主要包括金属(如Co[7]和Cu[8])和非金属元素(如C[9]和N[10])等的掺杂.
相对于纳米粉体,具有一维结构的纳米纤维不仅有利于载流子的快速传输,也有利于催化剂的回收利用[11].本文将静电纺丝法制备的TiO2纳米纤维[12],转化成大比表面积的由纳米片组装的TiO2纳米纤维,然后与富氮有机物(尿素、二氰二胺和三聚氰胺)混合煅烧,欲制备N掺杂的TiO2纳米纤维,并考察其光催化氧化NO的性能.本研究不仅有利于丰富半导体光催化理论,也可为日益严峻的空气环境问题的解决提供新的思路.
1 实验部分
1.1 试剂和仪器
所有试剂均为分析纯,包括钛酸四丁酯、聚乙烯吡咯烷酮、冰醋酸、无水乙醇、氢氧化钠、盐酸、尿素、二氰二胺、三聚氰胺等.
X射线衍射仪(Bruker-D8,德国布鲁克);扫描电子显微镜(Hitachi-4800S,日本日立);透射电子显微镜(Tecnai G20, 美国FEI);氮气物理吸附脱附仪(ASAP-2020,美国Micromeritics);紫外漫反射光谱仪(UV-2550, 日本岛津);X射线光电子能谱仪(Multilab 2000,日本岛津);氮吸附仪(ASAP2020,美国微粒体);瞬态荧光光谱仪(FLSP-920,英国Edinburgh);荧光分光光度计(F-7000,日本日立);电化学工作站(CHI760E,上海辰华);发光二极管(3 w,深圳兰普利);静电纺丝机(QZNT-E01,广州涞泊锐);马弗炉(MF-1100C,安徽贝意克);氮氧化物分析仪检测(Model 42i-TL,美国Thermo Scientific).
1.2 催化剂的制备
1.2.1 TiO2纳米纤维膜的制备
参照文献[12]制备TiO2纳米纤维膜:将15.0 g无水乙醇和4.0 g冰醋酸于烧杯中磁力搅拌混匀,然后滴加3.4 g钛酸四丁酯(tetrabutyl titanate,TBOT)和1.0 g聚乙烯吡咯烷酮(PVP,Mw=1300000).继续磁力搅拌6 h后,将得到的黄色透明状纺丝液,转移至静电纺丝机(流速为0.1 mL·min-1,外加电压22 kV,针尖与收集纤维用铝箔板的距离为4.0 cm),纺制出纤维膜.将得到的纤维膜置于马弗炉内,500 ℃下煅烧2 h(升温速率为2 ℃·min-1),所得到的样品即为TiO2纳米纤维膜.
1.2.2 纳米片自组装TiO2纳米纤维的制备
将2.5 g TiO2纳米纤维膜、160 mL NaOH溶液(10 mol·L-1)置于聚四氟乙烯内衬高压釜中(200 mL),转移至烘箱内,升温至120 ℃后保存2 h.待自然冷却后,倒掉水热釜上清液,将收集到的白色粉末重新分散在900 mL的HCl溶液(0.1 mol·L-1)中,磁搅拌12 h后,过滤,并用蒸馏水洗涤至中性.60 ℃烘干后转移至马弗炉内,400 ℃下煅烧1 h,所得到粉末即为由纳米片组装的TiO2纳米纤维,其过程如图1的步骤1~3所示.
1.2.3 N掺杂TiO2纳米纤维的制备
称取1 g TiO2纳米纤维和2 g尿素于200 mL的坩埚中,混合均匀后,转移马弗炉内,550 ℃下煅烧3 h(升温速率为3 ℃·min-1),所得到的样品即为N掺杂TiO2纳米纤维,标记为N-TiO2(U)(“U”表示为尿素).其过程如图1的步骤4所示.

图1 静电纺丝技术制备大比表面积TiO2纳米纤维及其氮掺杂过程意图
为了考察该方法的通用性,保持其他条件不变,将尿素替换为双氰胺和三聚氰胺,所得到样品标记为N-TiO2(D)、N-TiO2(M).为了作对比,将纳米片组装的TiO2纳米纤维前驱体、尿素、双氰胺和三聚氰胺在相同条件下煅烧,得到样品依次标记为TiO2、CN(U)、CN(D)、CN(M).尿素、双氰胺和三聚氰胺是常见的氮化碳合成原料.因此单独热聚合尿素、双氰胺和三聚氰胺,均可以得到石墨相氮化碳.
1.3 催化剂的表征
用场发射扫描电子显微镜和透射电子显微镜在10 kV加速电压下观察了催化剂的形貌;用X射线粉末衍射分析了该光催化剂在15 kV加速电压和20 mA外加电流下的相结构;以硫酸钡为参比物,采用紫外可见漫反射光谱法测定光催化剂的集光性能;用氮吸附仪对光催化剂的BET比表面积和孔结构进行了分析,BET比表面积的计算基于多点BET法在0.05~0.3的相对压力范围内获得的吸附数据,而Barret-Joyner-Halender法则用于根据吸附等温线数据确定光催化剂的孔径分布.为了获得光催化剂中光生载流子分离和迁移的信息,用荧光分光光度计在330 nm的激发波长下记录了光致发光(PL)光谱,通过荧光强弱判断催化剂光催化活性高低.
1.4 光电性能测试
利用标准的三电极光电化学工作站测试样品的光电性质,以铂丝电极、甘汞电极和制备的样品为对电极、参比电极和工作电极,在电化学工作站上测量了光催化剂的光电流响应.分别以365 nm发光二极管(3 W)为光源,Na2SO4溶液(0.4 mol·L-1)为电解液.在测量光电流之前,通过在导电玻璃表面涂覆TiO2浆料制备了工作电极(覆盖面积为1 cm×1 cm).首先,将30 mg TiO2纳米纤维分散在0.75 mL 50%乙醇溶液中,超声处理30 min;其次,在上述分散液中加入20 μL Nafion作为凝聚剂,超声处理30 min;最后,在导电玻璃上涂抹上均匀的浆料,过夜干燥浆料后,在导电玻璃上形成均匀的TiO2薄膜,将其作为工作电极用于光电流测试.
1.5 光催化氧化NO活性测试
通过评估在可见光照射下,催化剂对NO的光催化氧化去除,来评价N掺杂TiO2纳米纤维的光催化性能.NO的可见光催化氧化测试在流动式催化反应系统中进行测试,如图2所示,所用光源为30 W的可见光LED灯.具体做法如下.

图2 光催化去除NO的连续反应装置示意图
将0.2 g催化剂粉末均匀分散在30 mL蒸馏水中,超声5 min后将催化剂悬浮液转移表面皿内(直径7 cm),并置于烘箱中80 ℃下烘2 h进行涂膜.将所制得的涂膜表面皿,放入容积为4.5 L的NO转化反应箱中(30.0 cm×15.0 cm×10.0 cm),通过调节进气的空气和NO(NO钢瓶标准气体浓度为1 mg·kg-1,氮气平衡)流量,使进气流速为1.0 mL·min-1, NO浓度为0.6 mg·kg-1.反应后出口处混合气里NO的浓度通过氮氧化物分析仪检测进行在线检测.光照前先通混合气,使NO在催化剂表面的吸附达到平衡.待反应器出口NO浓度趋于稳定后再灯光照(光照前NO平衡浓度记录为C0),进行NO的催化氧化反应.记录出口处NO浓度Ct随光照时间的变化情况,得到NO去除率为x=(C0-Ct)/C0×100%.
2 结果与讨论
2.1 TiO2纳米纤维的形貌
通过扫描电镜观察煅烧前后各样品的形貌,结果如图3所示.煅烧前的TiO2样品为直径约1 μm的纳米纤维(图3(a)),放大后发现该纳米纤维由细小片状TiO2纳米片组装而成(图3(b)).这些细小纳米片的生成,归结于碱热酸洗工艺(图1步骤3).经该工艺处理后,TiO2纳米纤维的比表面积将增大,活性位点增加,有利于光催化反应[12].与尿素混合煅烧后,样品的形貌基本未发生变化(图3(c)、图3(d)).纯尿素煅烧产物为C3N4超薄纳米片(图2(e)、图2(f)),然而,TiO2与尿素混合煅烧,所得到样品未能直观地观察到C3N4.这说明混合煅烧过程中,尿素可能已全部分解.

图3 煅烧前后各样品的SEM图
2.2 晶体结构与化学组成
为了考察尿素引入对产物结构和组成的影响,对煅烧前后各样品进行了傅里叶红外(FTIR)表征.如图4所示,样品CN(U)在810、1200~1650、3100~3600 cm-1处的振动峰分额别归属于C3N4三嗪环、C和N杂环、—NHx和—OH的特征峰[13].与TiO2纳米纤维混合煅烧后,C3N4的特征峰全部消失,产物N-TiO2(U)只能观察到950~1000 cm-1的宽峰,为TiO2的Ti—O特征振动峰,说明尿素被全部分解.同样的,二氰二胺或三聚氰胺煅烧的到的产物也均为C3N4[曲线CN(D)和CN(M)],而与TiO2纳米纤维混合煅烧,产物也只有TiO2.这进一步说明:在该煅烧条件下,TiO2纳米纤维与有机聚合物煅烧,有机聚合物被完全分解,这可能是因为TiO2具有热催化作用,促进有机聚合物分解.

图4 煅烧后各样品的FTIR谱图
图5为各样品的XRD衍射谱图,结果显示:与尿素、双氰胺或三聚氰胺混合煅烧后,所得到的衍射峰与锐钛矿和金红石TiO2的标准卡一一对应,说明产物为锐钛矿和金红石型TiO2混晶.同时,均未出现C3N4的任何特征衍射峰,进一步说明,有机物与TiO2纳米纤维混合煅烧过程中,被完全分解,与FTIR表征结果相吻合.
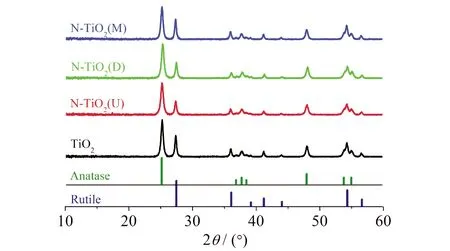
图5 煅烧后各样品的XRD谱图
为了确定产物的表面化学组成和电子结构,对尿素引入前后各样品进行了X射线光电子能谱(XPS)表征,结果如图6所示.从图6(a)的XPS全谱看出:CN(U)的N含量为57%,这与C3N4理论值一致;TiO2样品含N量为0.18%,来源于前驱体制备过程中的聚乙烯吡咯烷酮[PVP,(C6H9NO)n],因煅烧不完全,导致微量N残留;引入尿素后,即样品N-TiO2(U)的含N量提升至0.65%.表明尿素在热分解过程中,部分N元素掺杂进TiO2纳米纤维,导致产物的含氮量有所提高.
为了确定N元素的掺杂及掺杂位置,对各元素的XPS高分辨曲线进行分析.如图6(b)所示,与样品TO相比,样品N-TiO2(U)的Ti 2p3/2和Ti 2p1/2均向高结合能方向偏移0.2 eV.这表明:煅烧过程中,富含电子的N原子进入TiO2的晶格中,并且与Ti原子相互作用,将电子传给Ti4+,还原为Ti3+物种,导致Ti的电子云密度增加,即Ti 2p向高结合能方向偏移.Ti3+物种的形成,将在导带以下形成定位态,有利于改善可将光吸收,提高光催化活性.同时,样品N-TiO2(U)的O 1s 峰也向高结合能方向偏移0.2 eV(图6(c)),进一步表明N元素掺杂进入TiO2的晶格中.图6(d)为样品N-TiO2(U)中N 1s高分辨曲线图,400.9 eV处的峰归结于氮氧物种(NOx),来源于N原子和不同表面氧位点结合,例如N—O;以400.1 eV为中心的主峰的化学成分,为TiO2晶格中O原子被N原子取代形成O—Ti—N键;398.9 eV处的峰对应于Ti—N中的N,主要是TiO2晶格中的间隙氮[14].这表明:混合煅烧过程中,尿素的N元素以间隙氮的形式掺杂至TiO2的晶格.
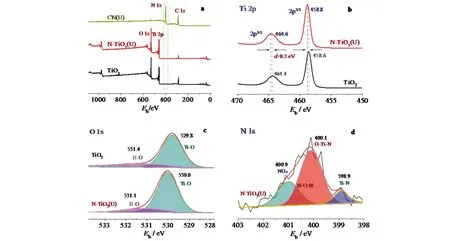
图6 样品TiO2和N-TiO2(U)的XPS谱图
2.3 光电性能测试
为了进一步证实N掺杂对TiO2电子结构的影响,通过紫外-可见漫反射光谱来探究催化剂的光吸收性能.如图7所示,样品TiO2、N-TiO2(U)、N-TiO2(D)和N-TiO2(M)的吸收带边缘分别为420、434、436、438 nm,相应的能带间隙分别为2.95、2.86、2.84、2.83 eV(内插图).由此可见,N掺杂后,样品在可见光区的吸收有所增强,并且光吸收带边缘红移,能带间隙减小,说明N掺杂可以拓宽TiO2纳米纤维的光响应范围.

图7 催化剂的紫外-可见漫反射光谱图
光生载流子分离与迁移效率是影响光催化剂的关键因素,通过荧光光谱,探究光生电子和空穴的复合效率.如图8所示,N掺杂后样品的荧光强度降低,表明以尿素、三聚氰胺、双氰胺为N源与TiO2纳米纤维混合煅烧,形成的N掺杂缺陷可以减少光生电子和空穴的复合效率,这与XPS分析结果一致.此外,N-TiO2(U)的光致荧光强度最小,表明其光生电子和空穴的复合效率最小,理论上其光催化活性将最高.
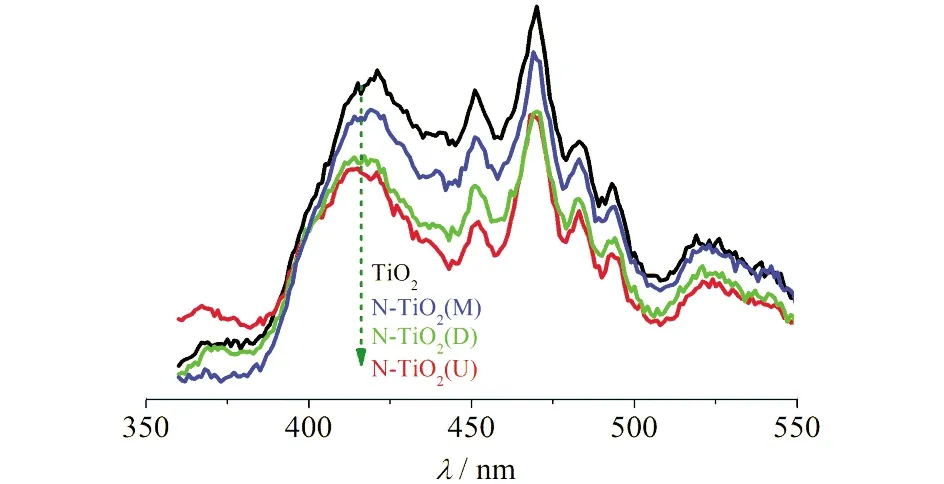
图8 光催化剂的荧光光谱图
进一步利用电化学工作站,测试催化剂的电化学光电流和电化学阻抗信号,来评价光催化剂的光生电荷分离与迁移效率.如图9(a)所示,样品T的光电流响应较弱,仅为6 μA·cm-2.但是,N掺杂TiO2纳米纤维的光电流显著增强.样品N-TiO2(U)的光电流高达12 μA·cm-2,寿命N掺杂有利于促进TiO2纳米纤维光生载流子的分离(抑制复合),提高光催化活性.同时,电化学阻抗表征结果显示(图9(b)),各样品的电化学阻抗半径大小顺序为:N-TiO2(U)< N-TiO2(D)< N-TiO2(M)< TiO2,与电化学光电流的规律一致,表明N掺杂减小了界面电子迁移阻力,有利于光生载流子分离与迁移.由此可见:N-TiO2(U)的光电流最强,电化学阻抗半径最小,这意味着N-TiO2(U)的光催化活性将最高,与荧光光谱分析结果一致.

图9 光催化剂的光电化学性能图
2.4 光催化氧化NO活性及稳定性
通过评估在可见光照射下的NO的光催化去除,探究N掺杂对TiO2纳米纤维光催化活性的影响.光照10 min后,光催化反应器出口处的NO浓度基本稳定.由图10可见:(1)在无催化剂的情况下,NO基本不被氧化,说明低浓度NO(约600 μg·L-1)在空气氛围中是相对稳定的(图10(a));(2)N掺杂显著提升TiO2纳米纤维的可见光催化性能.其中,N-TiO2(U)样品具有最高的NO消除效率(50.8%),较未掺杂TiO2样品的NO消除效率(39.4%)提高11.4%(图10(a));(3)N-TiO2(U)表现出最低的有毒中间产物NO2生成的浓度(图10(b)),说明N-TiO2(U)是比较理想的光催化空气净化材料,它可以将NO进一步深度氧化成亚硝酸盐和硝酸盐;(4)样品N-TiO2(U)的光催化活性最高,与光电性能测试结果相一致,经历5次循环使用后,其光催化氧化NO的活性没有明显下降,表现出非常好循环稳定性(图10(c)).

图10 样品的光催化活性图
2.5 N-掺杂TiO2的光催化机理
掺杂到TiO2的氮元素,主要以取代氮和间隙氮两种形式修饰TiO2,其中取代结构是氮原子置换氧原子,形成Ti—O—N键;而间隙性结构则是N原子进入TiO2晶格中,形成Ti—N键,导致吸收光谱红移动[14-17].XPS表征结果显示(图6(d)):与尿素混合煅烧后的TiO2样品N-TiO2(U),N元素主要以间隙N形式进入到TiO2晶格中.由于N原子的2p轨道与O原子的2p轨道能级接近,它们之间容易发生轨道杂化,导致本征TiO2的能带结构被改变,引入的氮掺杂能级,通过缩小禁带宽度,增强了光吸收,并促进光生载流子分离效率,最终导致TiO2的可见光催化氧化NO的性能得以显著提升.
3 结语
将含氮有机物与TiO2纳米纤维混合煅烧,成功制备了N掺杂TiO2纳米纤维,该方法简单便捷,并具有通用性;N掺杂TiO2纳米纤维光催化氧化NO的活性显著提升,其中以尿素为N源得到的N掺杂TiO2纳米纤维表现出最佳的可见光催化活性(NO去除率高达50.8%),并具有很好的稳定性.N掺杂TiO2纳米纤维光催化活性提高,归结于间隙N掺杂拓宽了TiO2的可见光相应范围,并提高了光生载流子的分离与迁移效率.
——潘桂棠光生的地质情怀

