重症新型冠状病毒肺炎患者的临床特点及预后相关危险因素 分析
徐虹,陈辉,黄文杰*
1解放军南部战区总医院全军呼吸内科中心,广州 510010;2解放军联勤保障部队第940医院卫生经济科,兰州 730050
新型冠状病毒肺炎(coronavirus disease 2019,COVID-19)是由严重急性呼吸综合征冠状病毒2 (severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)感染引起的急性呼吸道传染病,人群具有普遍易感性,已被我国列为按甲类传染病管理的乙类传染病[1]。截至2021年1月5日,全球累计确诊病例已超过8300万,死亡病例超过180万[2]。根据WHO报告,约80%的COVID-19患者为轻型,整体预后良好;20%为重型和危重型,预后差,病死率高[3]。本研究探讨与重症COVID-19患者的预后相关危险因素,以为临床早期识别重点患者并给予个体化干预提供参考。
1 资料与方法
1.1 一般资料 回顾性分析2020年2-4月曾入住武汉火神山医院重症科(ICU)的重型和危重型COVID-19确诊患者的临床资料,根据转归情况分为存活组与死亡组。
1.2 纳入标准 符合国家卫生健康委员会颁布的《新型冠状病毒感染的肺炎诊疗方案》(试行第六版)中的诊断和分型标准[4]。COVID-19临床分型标准:(1)普通型。具有发热、呼吸道等症状,影像学可见肺炎表现。(2)重型(符合下列任何一条):①出现气促,呼吸频率≥30次/min;②静息状态下指氧饱和度≤93%;③动脉血氧分压/吸氧浓度≤300 mmHg(1 mmHg=0.133 kPa)。肺部影像学显示24~48 h内病灶明显进展(>50%)者按重型管理。 (3)危重型(符合下列任何一条):①出现呼吸衰竭,且需要机械通气;②出现休克;③合并其他器官衰竭需ICU监护治疗。
1.3 排除标准 (1)入院72 h内死亡;(2)入院时存在意识障碍,无法采集病史且临床资料不全。
1.4 临床资料收集 通过电子病历系统提取患者的个人资料、诊断、病历记录、实验室检查、治疗方案等信息。血常规、乳酸脱氢酶(LDH)、α-羟丁酸脱氢酶(α-HBDH)提取入院后连续3次检查的结果,其他实验室检查提取入院后第1次检查的 结果。
1.5 统计学处理 应用SPSS 20.0软件进行统计分析。计数资料以例(%)表示,组间比较采用χ2检验。正态分布的计量资料以±s表示,组间比较采用独立样本t检验;偏态分布的计量资料以M(Q1,Q3)表示,组间比较采用u检验。采用受试者工作特征(ROC)曲线分析各指标对预后的判断效能。P<0.05为差异有统计学意义。
2 结 果
2.1 一般资料 入院后曾入住ICU的患者共128例,排除入院后72 h内死亡及资料不完整者6例,共122例纳入本研究。其中男80例,女42例,年龄36~100(70.1±11.1)岁;入院首次分型:普通型14例,重型48例,危重型60例;住院期间最高分型:重型24例,危重型98例。死亡56例,存活66例,病死率45.9%。死亡组与存活组患者年龄、性别、主诉症状差异无统计学意义(P>0.05);死亡组合并冠心病的比例高于存活组,差异有统计学意义(19.6% vs. 7.6%,P=0.049,表1)。

表1 两组重症COVID-19患者一般资料比较Tab.1 General data of severe COVID-19 patients in two groups
2.2 两组患者入院实验室检查结果比较 如表2所示,死亡组入院时血小板计数(PLT)低于存活组(P=0.015),C反应蛋白(CRP)、脑钠肽(BNP)水平高于存活组(P=0.027,P=0.007),凝血酶原时间(PT)和凝血酶时间(TT)长于存活组(P<0.001,P=0.037),但两组数值均在正常范围。两组血清钙浓度均低于正常参考值(2.11~2.52 mmol/L),但死亡组低于存活组(P=0.006)。
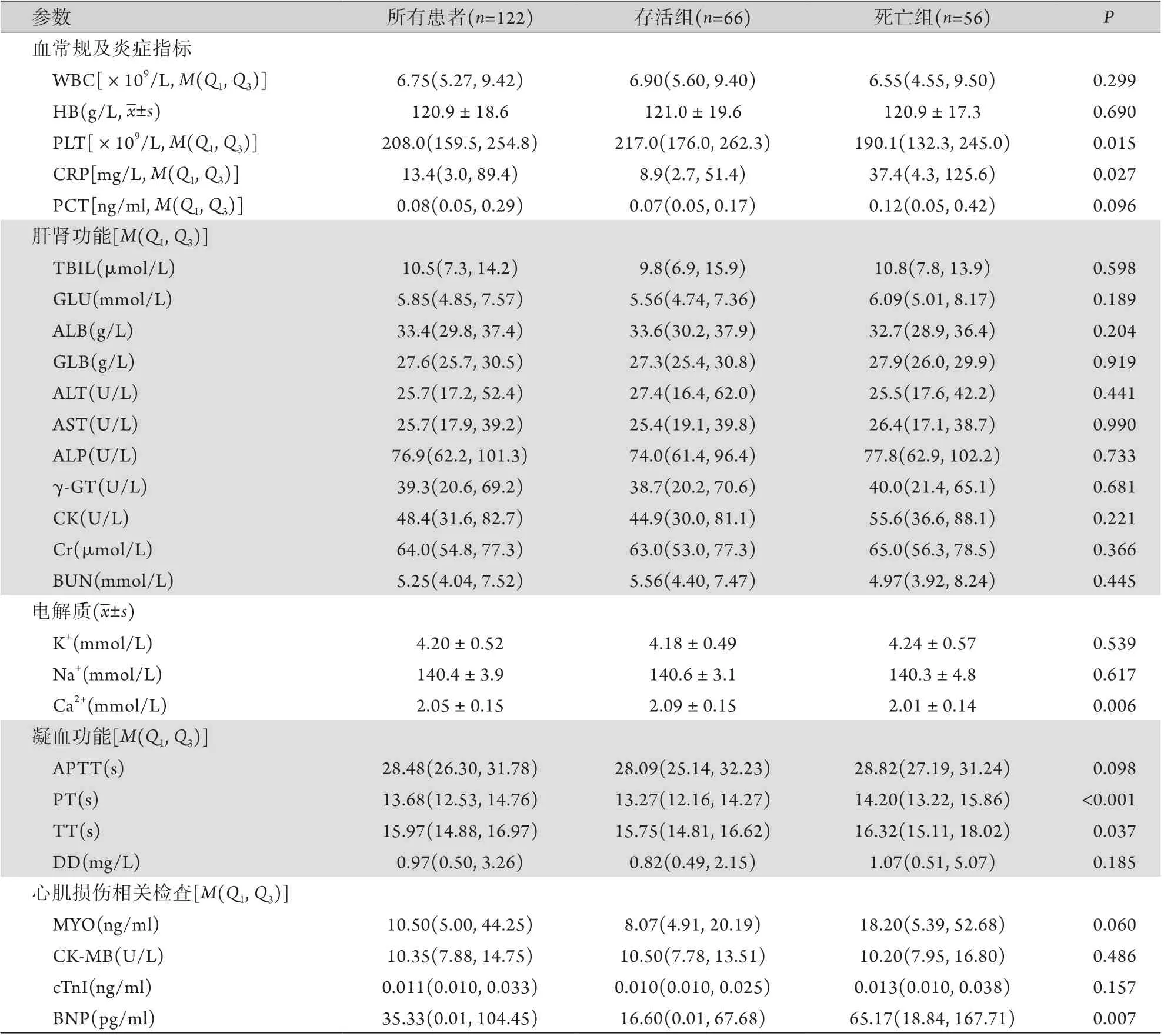
表2 两组重症COVID-19患者入院实验室检查结果比较Tab.2 Comparison of laboratory results of severe COVID-19 patients in two groups
2.3 两组中性粒细胞计数(NEU)、淋巴细胞计数(LYM)、中性粒细胞与淋巴细胞比值(NLR)、LDH、α-HBDH动态变化 存活组与死亡组第1次血常规检查NEU、LYM差异无统计学意义,但死亡组NLR明显高于存活组(P=0.029)。动态观察显示,存活组LYM呈升高趋势,NLR逐渐下降,死亡组LYM持续维持在低水平,NLR持续维持在高水平。两组LDH、α-HBDH差异有统计学意义,多次检测死亡组LDH和α-HBDH水平均明显高于存活组(P<0.001,表3)。
2.4 实验室检查结果预测死亡结局的ROC曲线分析 对单因素分析中有统计学差异的实验室检查指标进行ROC曲线分析,结果显示,LDH、α-HBDH及第2、3次检测的NEU预测死亡结局的价值较高,曲线下面积(AUC)>0.7(图1、表4)。
2.5 两组治疗情况比较 两组患者治疗情况如表5 所示。死亡组接受机械通气及使用抗细菌药治疗的比例高于存活组(P<0.05)。死亡组中6例未进行有创机械通气,其中3例因家属拒绝气管插管,仅予以无创通气;2例高流量氧疗和无创通气后低氧改善,发生心源性猝死;1例予以高流量氧疗,低氧改善后因脑干梗死猝死。两组采用抗病毒、糖皮质激素等治疗的比例差异无统计学意义(P>0.05)。93.9%的存活组患者接受了中药治疗,明显高于死亡组(37.5%,P<0.001)。

表3 两组重症COVID-19患者实验室检查结果动态比较[M(Q1, Q3)]Tab.3 Dynamic data of laboratory indices of severe COVID-19 patients in two groups [M(Q1, Q3)]
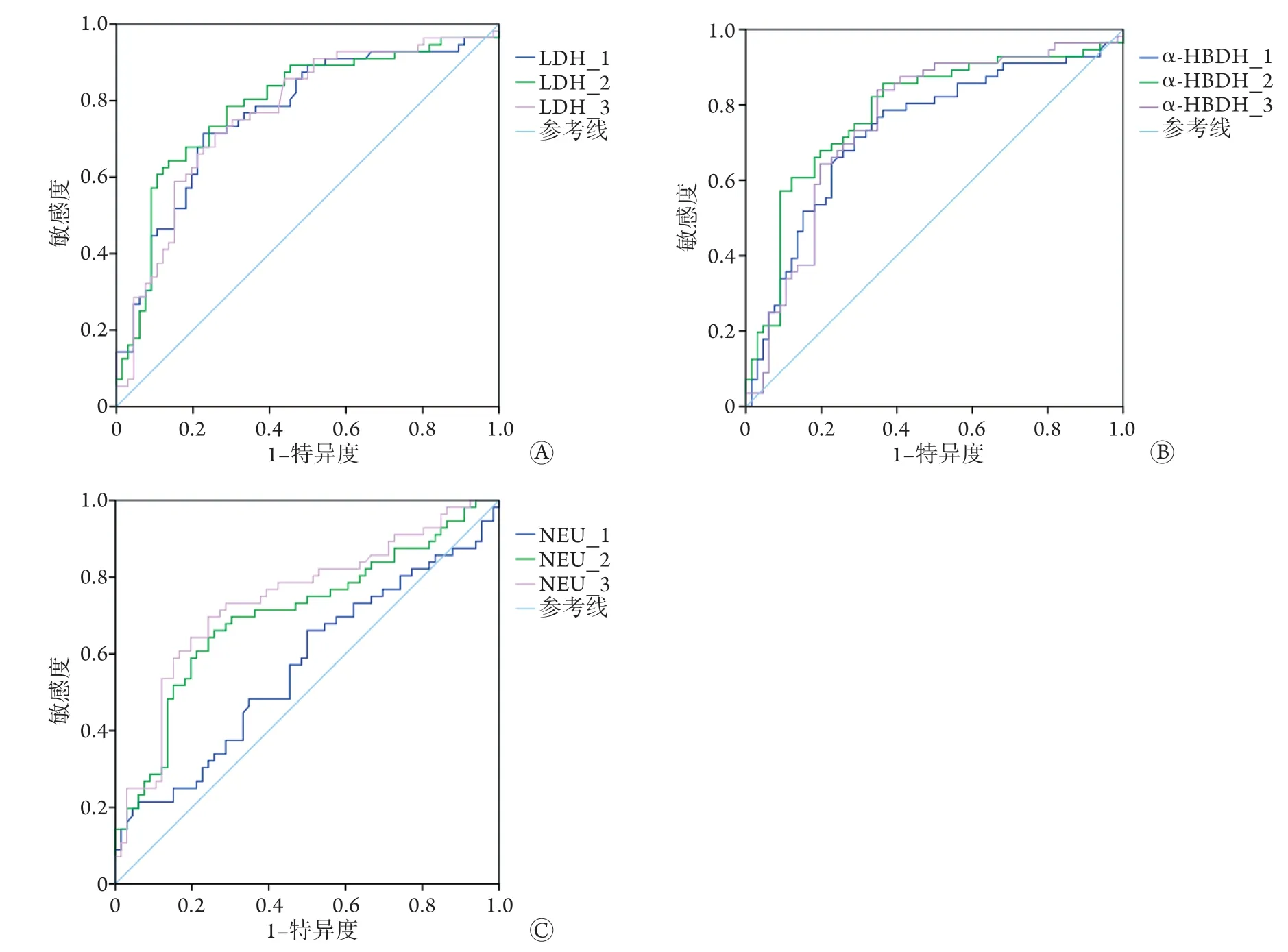
图1 LDH、α-HBDH、NEU预测重症COVID-19患者死亡结局的ROC曲线Fig.1 ROC curve of LDH, α-HBDH and NEU for predicting the outcome of death of severe COVID-19 patients
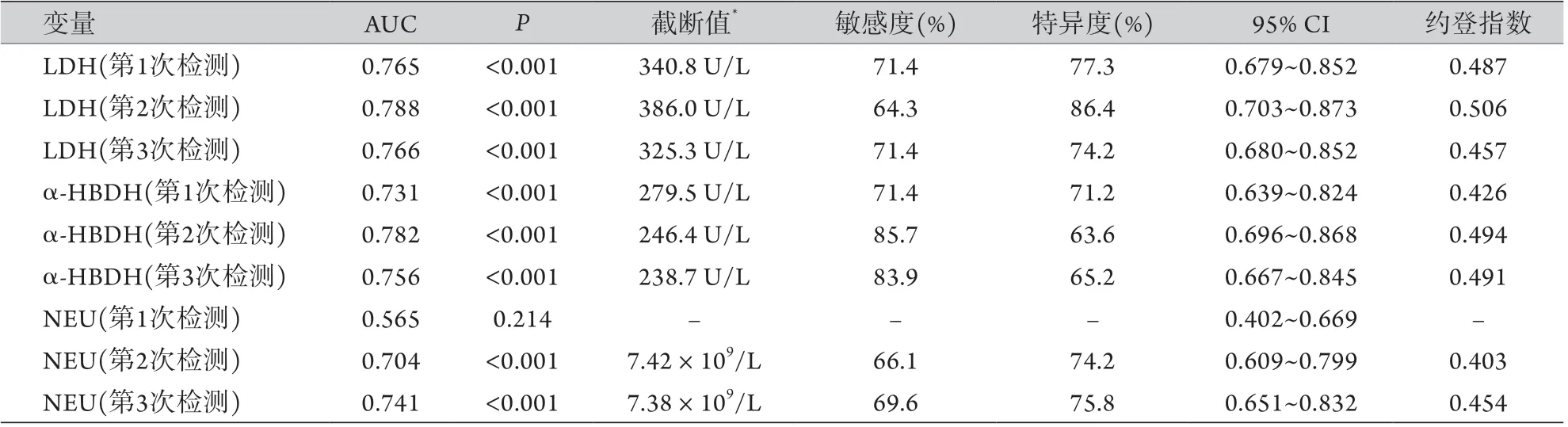
表4 LDH、α-HBDH及NEU预测重症COVID-19患者死亡结局的ROC曲线分析Tab.4 ROC curve analysis of LDH, α-HBDH and NEU for predicting the outcome of death of severe COVID-19 patients

表5 两组重症COVID-19患者治疗情况比较[例(%)]Tab.5 Treatment for severe COVID-19 patients in two groups [n(%)]
3 讨 论
COVID-19疫情发生以来,我国积极采取防控策略和措施,有效控制了本地传播,但目前国际疫情形势仍十分严峻。国内外研究资料显示,重症COVID-19患者病死率高,而早期识别重症患者、合理配置医疗资源有利于提高救治成功率[5-7]。多项临床研究发现,合并高血压、心血管疾病、慢性肾病和糖尿病等常见慢性疾病以及高龄可能是导致COVID-19重症化及死亡的重要诱因[5,8-10]。本研究将观察对象限定为入住过ICU的重症患者,平均年龄达70.1岁,超过70%的患者合并基础疾病,最常见的为高血压(56.1%)、糖尿病(26.2%)、冠心病(13.1%),其中死亡组合并冠心病的比例明显高于存活组,2例在低氧改善后发生心源性猝死,提示心血管疾病可能增加重症患者的死亡风险。
探索实验室检查对患者预后的预警作用是临床研究的热点,据此建立病例分级管理系统具有重要的临床和管理意义。血常规、CRP等是最早受到关注的检验指标,LYM下降被列入诊断标准,并被证实与病情严重程度相关[11-12]。中性粒细胞及CRP升高被认为可能与炎症风暴有关,可以预测COVID-19患者重症化及死亡的风险。Lu等[13]总结了577例确诊或疑似COVID-19住院患者的临床特征,以年龄和CRP这两个简单指标确定ACP指数,结果显示,ACP指数与12 d死亡风险及病情严重程度密切相关。NLR判断患者重症化的作用得到了多项研究的支持,如Liu等[14]发现,年龄>50岁且NLR≥3.13的COVID-19患者进展为重症的可能性大,应尽快转入ICU治疗。本研究入组患者均为重症,LYM中位数始终<1.0×109/L,死亡组LYM明显低于存活组,且动态观察显示,死亡组LYM持续维持在低水平,而存活组第2、3次检测较入院时有所升高,NEU和LYM的变化特点与其他报道相似。 本研究同时证实NLR与疾病严重程度相关,3次检测存活组患者NLR中位值均>5,死亡组NLR中位值均>13,两组差异有统计学意义。
重症COVID-19患者存在凝血功能异常[15],主要表现为凝血激活、纤溶抑制,实验室检查发现PLT计数减少、PT轻度延长、D-二聚体升高。Tang等[16]对183例COVID-19患者的凝血指标进行回顾性分析,结果显示,约71%的死亡病例在病程中满足弥漫性血管内凝血(DIC)的诊断标准,而存活患者中仅0.6%满足DIC的诊断标准。本研究入组患者除D-二聚体水平升高外,PLT、PT、TT检测的中位值均在正常范围,似乎未表现出明显的凝血功能异常,但死亡组PLT计数明显低于存活组,PT、TT检测值大于存活组,差异有统计学意义。临床实际工作中,重症患者的凝血功能随病情及治疗方案的变化可发生明显改变,本研究未动态监测凝血功能,也未能确定凝血功能检测时间点与病程的关系,因此,本研究收集的数据用于判断凝血功能与预后的关系具有较大的局限性。
多项临床研究显示,重症COVID-19患者心肌损伤指标(包括CK、LDH、cTnI、MYO、BNP等)较轻症患者升高[17-19]。上海援鄂医疗队对武汉金银潭医院188例COVID-19患者的临床资料进行回顾性分析,发现COVID-19患者入院时cTnI、CK-MB、LDH、α-HBDH水平较高,且与患者死亡风险增加有关[20]。Yan等[21]回顾性分析武汉同济医院收治的404例COVID-19患者的血液样本数据,并通过机器学习工具对预测COVID-19患者存活率的生物标志物进行研究,结果显示,LDH预测生存率的准确性超过90%。LDH升高与各种疾病中发生的组织分解有关,LDH主要有5种同工酶,其中LDH1、LDH2主要来源于心脏,LDH3主要来源于肺、脾脏,LDH4、LDH5主要来源于肝脏和骨骼肌,临床测定的α-HBDH实际是LDH1和LHD2的活性之和。cTnI和CK-MB用于诊断心肌损伤具有很高的敏感性和特异性,临床价值优于LDH。本研究观察到,cTnI和CK-MB升高的患者,其LDH和α-HBDH水平均升高,而超过50%的LDH和α-HBDH升高患者,其CK-MB及cTnI检测结果正常,提示LDH和α-HBDH升高并不总对应心肌损害,可能与病毒导致的多系统损害及炎症反应等有关。
由于缺乏生存时间数据,本研究采用ROC曲线初步探索预测重症患者死亡风险有价值的临床指标,结果显示,符合AUC>0.7标准的参数仅有LDH、α-HBDH、NEU。3次LDH和α-HBDH检测的ROC曲线分析结果相似,重复性较好。入院首次NEU检测两组无差异,随后死亡组NEU升高明显,第2、3次检测结果预测死亡风险的AUC>0.7,但敏感度<70%。NEU水平还可能受激素治疗、合并细菌感染等其他情况影响,其意义需谨慎判断。
本研究所有患者均给予呼吸支持治疗,两组呼吸支持方式的差异主要与病情严重程度相关,给予有创通气前,多数患者接受了高流量氧疗和(或)无创通气治疗。由于资料有限,本研究未探讨不同呼吸支持治疗方式及其合理转换对预后的影响。药物治疗的差异主要表现在抗细菌药物和中药的使用。89.3%的患者接受了抗细菌治疗,但病原学资料不完整,以经验性治疗为主。存活组与死亡组中药使用率差异明显(93.9% vs. 37.5%),但不能排除医师根据患者进食等情况主动选择导致的偏倚,中药对死亡风险的影响需要进一步通过临床对照试验进行 验证。
本研究为回顾性分析,存在难以避免的局限性,但仍能给临床医师以下启示:重症COVID-19多为高龄及有基础疾病的患者,持续的LYM降低和NLR升高是其显著的临床特征,LDH和α-HBDH持续升高的患者死亡风险较高,应予以特别重视,并及时给予个体化治疗,以降低死亡风险。

