干热环境创伤失血性休克猪继发肝损伤的变化特点及机制
吴彬,游云,沈才福,3,夏亮,杨欣悦,李辉文,刘江伟*,戴勇华
1新疆特殊环境医学重点实验室,乌鲁木齐 830000;2解放军联勤保障部队临潼康复疗养中心,西安 710000;3陆军957医院消化血液内分泌科,西藏阿里地区 859000;4解放军69223部队卫生连,新疆阿克苏 842300
失血性休克是由多种原因造成的机体有效循环血量锐减,重要组织器官灌注不足、缺血缺氧,以及各种炎性因子大量释放,继发各重要脏器部分或全部可逆或不可逆损伤的一系列病理变化过程[1-2], 其中以创伤失血性休克较为多见,造成创伤休克的主要原因有暴力打击、高空坠落、交通事故等[3]。 创伤发生时腹部脏器因缺少骨骼的有效保护,受到暴力打击后损伤更为直接、严重,如肝、肾损伤等[4]。 在大量失血及直接暴力的双重作用下,急性肝、肾损伤常可危及生命。我国西北地区夏季日照时间长、气温高,加之距离海洋远、气候干旱、空气湿度低,在极端干热条件下机体丢失水分量剧增,血液浓缩,血容量相对较少,在遭受创伤后机体代偿能力明显下降[5],更易诱发休克,创伤性休克使得肝脏等血供丰富的器官发生损伤且程度更为严重[6]。 目前国内外沙漠干热环境创伤失血性休克继发肝损伤相关的研究较少。本研究建立血压控制型创伤失血性休克猪模型,探讨沙漠干热环境创伤失血性休克继发肝损伤的变化特点及其可能机制,以期为进一步研究及临床救治提供理论依据。
1 材料与方法
1.1 主要试剂及仪器 匀浆内肿瘤坏死因子-α (tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β) ELISA试剂盒(南京建成生物工程研究所);高迁移率族蛋白B-1(high mobility group box-1,HMGB-1)兔多克隆抗体(ab228624)、二抗山羊抗兔(ab205718)、β-actin抗体小鼠单克隆抗体(a b 8 2 2 6,英国A b c a m 公司);肝组织内细胞间黏附分子-1(intercellular cell adhesion molecule-1,ICAM-1)抗体(ab2796798,美国SouthernBiotech公司)。全自动生化分析仪(美国Abbott Aeroset公司);环境模拟于西北特殊环境人工实验舱(新疆军区总医院自主研发)。
1.2 实验分组及血压控制型失血性休克模型建立 健康雄性长白仔猪60只,体重27~32 kg,由新疆天康畜牧生物技术股份有限公司提供,实验前一周运抵动物实验室饲养,确保健康并使其适应环境。随机分为干热创伤失血性休克组(dry heat trauma hemorrhagic shock group,DHS组,n=20)、干热创伤失血性休克假手术组(dry heat trauma hemorrhagic shock sham operation group,DHC组,n=20)与常温创伤失血性休克组(normal temperature trauma hemorrhagic shock group,NTS组,n=20)。各组分别在相应环境[干热环境:温度(40.5±0.5) ℃,湿度(10±2)%;常温环境:温度(25.0±0.5) ℃,湿度35%±5%]下暴露3 h后建模,实验前12 h禁食、4 h禁水。肌注氯胺酮(20 mg/kg)及阿托品(0.05 mg/kg)诱导麻醉,1.5%~3.0%七氟烷维持麻醉,利用心电监护仪监测生命体征,BL-420生物机能实验系统监测体温。麻醉成功后,暴露双侧股动脉,右侧股动脉用于监测动脉血压,左侧股动脉用于快速放血。腹正中入路开腹,膀胱造瘘。DHS组、NTS组切除脾脏及部分肝脏,称重,并输注3倍于脾重量的乳酸林格液[7-8],DHC组不切除脾脏及部分肝脏,不予以股动脉放血,其他操作同上述两组。模拟休克模型[9]后,快速放血并监测平均动脉压(MAP)在(45±5) mmHg,稳定20 min后记录为休克初始时间(0 min)。各组分别于建模成功后0 min(T0)、50 min(T1)、100 min(T2)、150 min(T3)用3%戊巴比妥钠注射液(美国Sigma公司)安乐处死。取剩余肝组织,分别于多聚甲醛中固定或液氮中保存待测。实验过程符合国家及单位关于动物管理和使用的 规定。
1.3 HE染色观察肝组织病理学变化 建模成功后T0、T1、T2、T3时,快速切取肝组织,用10%多聚甲醛固定,石蜡包埋、切片,HE染色,光镜下观察肝组织病理学变化。
1.4 血清谷丙转氨酶(alanine amino transferase,ALT)、谷草转氨酶(aspartate amino transferase,AST)含量测定 建模成功后T0、T1、T2、T3时,经左侧股动脉抽取3 ml血液,4 ℃下静置2 h,常温下3000 r/min离心10 min,采用全自动生化分析仪测定血清ALT、AST含量。
1.5 ELISA法检测肝组织TNF-α、IL-1β水平 取冻存的肝组织,称重并与匀浆缓冲液混合(每100 mg组织加入1 ml缓冲液),4 ℃孵化1 h,12 000 ×g离心,取上清,采用TNF-α、IL-1β ELISA试剂盒检测450 nm处各孔光密度(A)值,计算TNF-α、IL-1β 水平。
1.6 Western blotting检测肝组织中HMGB-1、ICAM-1的表达 取出液氮冻存的肝组织0.2 mg,液氮研磨、裂解、离心(4 ℃,12 000 r/min,10 min),BCA法测定总蛋白浓度,取上清液与上样缓冲液混合煮沸,离心取上清,行10% SDS-PAGE凝胶蛋白电泳、转膜、5% BSA封闭,加入一抗ICAM-1 (1:1000)、HMGB-1(1:1000)、β-actin(1:2000),4 ℃下孵育过夜,洗膜,加入二抗(1:3000)常温孵育2 h,洗膜,用ECL化学发光液显影,凝胶成像系统成像后分析。
1.7 统计学处理 采用SPSS 20.0软件进行统计分析。计量资料以±s表示,组间及组内各时间点比较采用单因素方差分析,进一步两两比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组肝组织病理学变化 HE染色结果显示,DHS组在不同时间点均出现了肝组织病理变化,建模成功T0时少量肝窦轻度扩张、充血,肝小叶、汇管区尚清晰,肝细胞结构正常。T1时肝窦轻度扩张、内有充血,少量炎性细胞浸润;肝小叶、汇管区结构欠清晰,个别肝细胞颗粒样变性。T2时肝窦中度扩张、充血,炎性细胞浸润并伴有少量嗜酸性粒细胞;部分肝小叶、汇管区结构紊乱,部分肝细胞变性、坏死。T3时肝窦扩张并弥漫性充血,炎性细胞浸润,肝细胞呈片状坏死,肝细胞核浓缩,小叶结构破坏,可见肝静脉血栓形成。NTS组在T0、T1时肝窦未见明显扩张,肝小叶、汇管区清晰,肝细胞结构基本正常,随休克时间延长肝组织病理变化逐渐加重,至T3时可见肝窦扩张、少量充血,肝小叶、汇管区结构稍紊乱,炎性细胞浸润,肝细胞轻度变性。DHC组自T2开始有少量肝窦轻度扩张,未见其他明显病理变化(图1)。
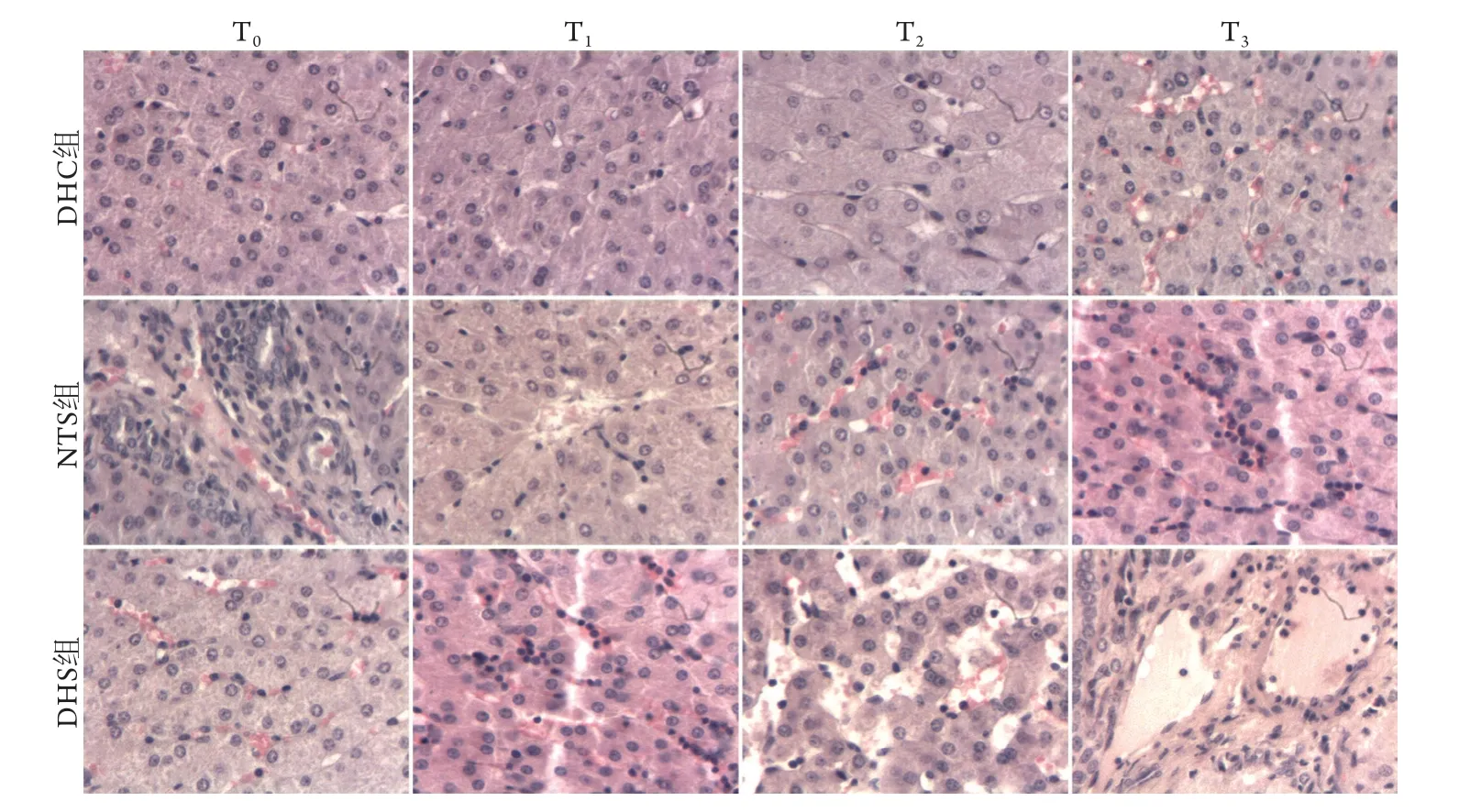
图1 创伤失血性休克猪不同时间点肝组织病理学变化(HE ×400)Fig.1 Pathological changes of liver tissue at different time points of pigs with traumatic hemorrhagic shock (HE ×400)
2.2 各组血清ALT、AST含量变化 DHS组与NTS组ALT及AST均呈动态变化且变化趋势基本一致。与DHC组比较,DHS组血清ALT及AST在T0时即开始升高(P<0.01),T1时达到第一个峰值,后平稳下降,T3时再次升高,且较T1时峰值更高(P<0.01);与NTS组比较,除T0时,DHS组各时间点血清ALT及AST含量均较高(P<0.01)。DHC组各时间点血清ALT及AST含量均未出现明显变化(P>0.05,图2)。
2.3 各组肝组织TNF-α、IL-1β水平变化 与NTS组、DHC组比较,DHS组TNF-α、IL-1β水平T0时均开始升高(P<0.01),且随时间推移DHS组与NTS组呈持续增高趋势,各组内后一时间点与前一时间点比较差异均有统计学意义(P<0.05或P<0.01),组间相同时间点比较,DHS组较NTS组升高更为迅速,差异有统计学意义(P<0.01)。DHC组各时间点TNF-α、IL-1β水平比较,差异无统计学意义(P>0.05,图3)。
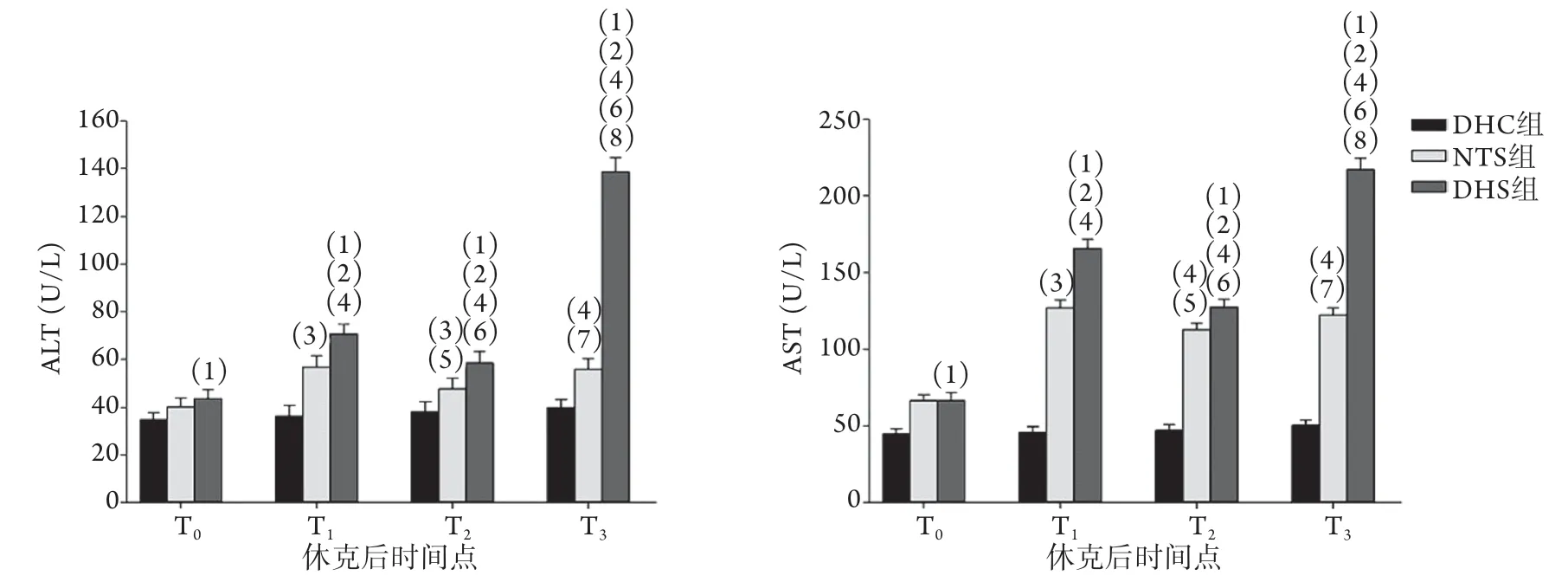
图2 各组创伤失血性休克猪不同时间点血清ALT、AST含量变化Fig.2 Changes of serum ALT and AST at different time points of pigs with traumatic hemorrhagic shock
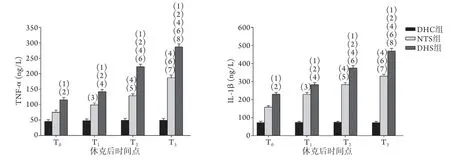
图3 各组创伤失血性休克猪不同时间点肝组织TNF-α、IL-1β水平变化Fig.3 Changes of TNF-α and IL-1β levels at different time points of pigs with traumatic hemorrhagic shock
2.4 干热环境创伤失血性休克猪肝组织HMGB-1、ICAM-1表达水平变化 T0、T1、T2、T3时,DHS组肝组织HMGB-1的相对表达量分别为0.26±0.03、0.55±0.02、1.15±0.10、2.89±0.34,后一时间点与前一时间点比较,差异均有统计学意义(P<0.05或P<0.01);ICAM-1的相对表达量分别为0.33±0.04、0.63±0.03、1.08±0.12、1.89±0.28,后一时间点与前一时间点比较,差异均有统计学意义(P<0.01,图4)。
3 讨 论
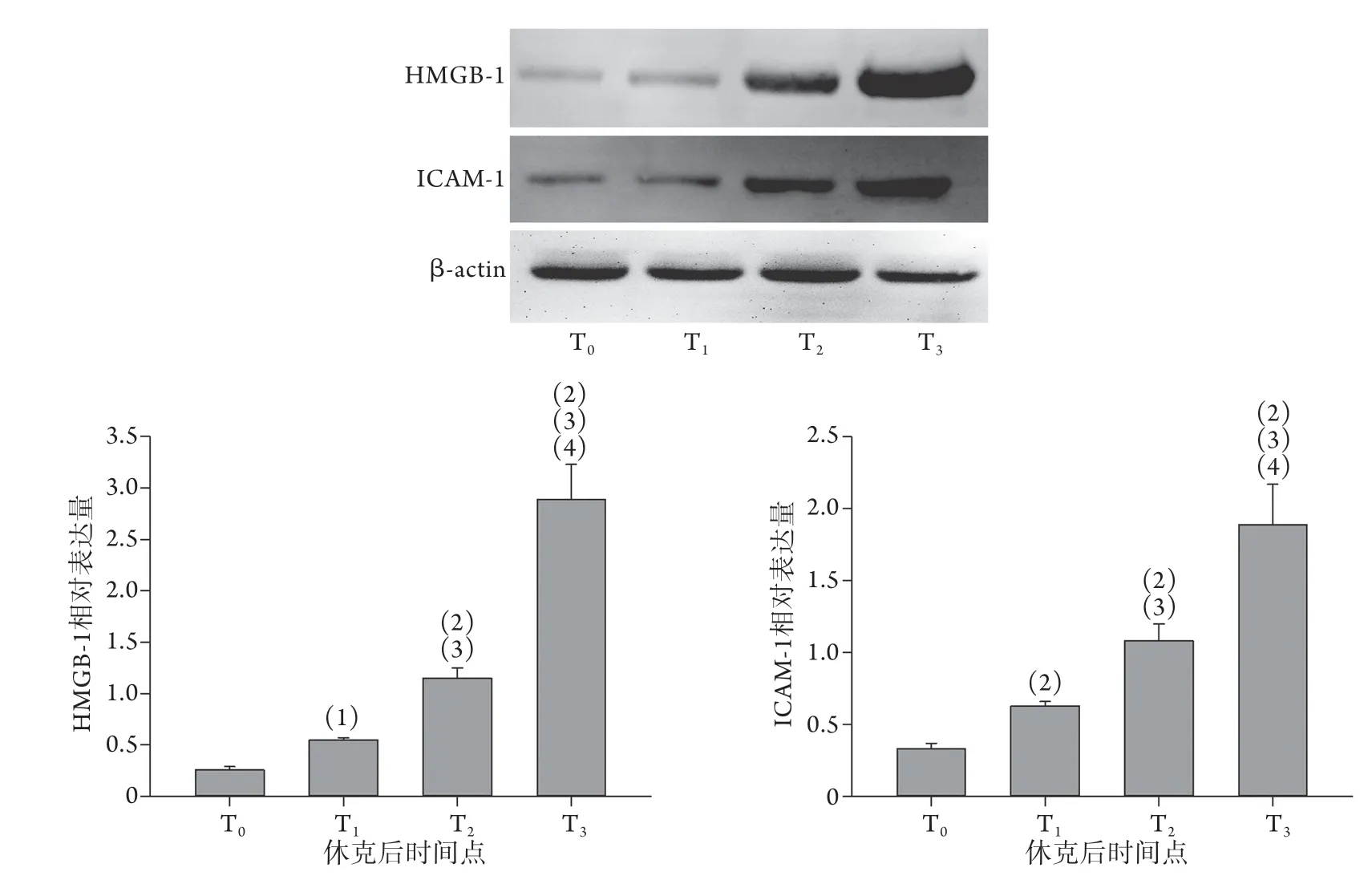
图4 干热环境创伤失血性休克猪肝组织HMGB-1、ICAM-1表达水平变化Fig.4 Changes of the expression levels of HMGB-1 and ICAM-1 protein in liver tissue of pigs with traumatic hemorrhagic shock at different time points exposed under dry heat environment
创伤失血性休克发生后全身有效循环血量锐减,相继或同时出现外周组织灌注不足、微循环障碍、炎性因子大量释放等一系列病理生理改变,此时机体迅速启动神经-体液调节机制,使血液重新分配至重要脏器,机体需氧量增加以保证休克代偿期的供能。然而,在沙漠干热环境下机体蒸发失水量巨大,体液严重不足,各个屏障功能减弱,防御机制受阻,机体代偿能力下降,尤其对缺血缺氧较为敏感的脏器代偿能力急剧下降。肝脏作为腹腔内最大的实质脏器,有着较为丰富的血液供应,一般环境下失血性休克发生早期,重新分配的血液可基本供应肝脏进行应激性代偿调节,保证重要脏器的血供。但本研究发现,沙漠干热环境下创伤失血性休克猪自模型建立初始即出现肝损伤病理变化,且随着时间的推移,肝损伤进展迅速,很快达到不可逆的变性、坏死阶段,这一系列的变化过程可能与干热环境下体液丢失较多、血液浓缩缺氧,并伴随着机体的应激反应、代偿能力急剧下降有关,虽然急性缺血缺氧导致血液重新分布进入肝脏,但进入肝脏的血液含氧量低且相对减少,肝组织损伤严重且变化迅速,肝脏容量血管失去正常的调节作用,血液淤滞于肝脏内,加之肝组织内单核/巨噬细胞防御功能减弱,肠道细菌转移、内毒素大量释放进入肝门静脉,加重肝损害,促进了炎性介质释放。这一系列应激、级联反应对肝脏造成了严重打击,这也可能是肝细胞凋亡的重要诱因[10]。当大量肝细胞凋亡无法被吞噬细胞清除时,会刺激炎性细胞向肝脏迁移,并持续释放炎性因子,形成恶性循环[11-12]。 同时肝脏血管内皮细胞损伤,凝血功能障碍诱发血栓形成,使肝内血液循环受阻并导致肝脏衰竭,最终引发多器官功能障碍综合征(MODS)[13-14]。
肝脏作为人体最大的消化腺及代谢器官,内含各种丰富的酶,当肝脏受损时储存在肝细胞内的酶释放入血,血清中相关酶含量升高可间接反映肝脏损伤的程度。ALT与AST作为临床上诊断急性肝损伤的指标被广泛运用,前者主要分布于肝细胞质中,后者主要储存于肝细胞线粒体中,两者对肝细胞损伤的灵敏度均较高[15]。有研究发现,每1%的肝细胞坏死即可导致血液中ALT活性增高1倍[16]。本研究发现,干热环境及常温环境下创伤失血性休克猪血清ALT及AST均呈动态变化,且变化趋势基本一致;与DHC组比较,DHS组T0时即出现ALT和AST升高,T1及T3时分别达到高峰,且T3较T1时峰值更高;除T0时,DHS组各时间点血清ALT及AST含量均较NTS组高;DHC组各时间点均未出现明显变化。ALT及AST作为肝损伤的敏感性指标,在肝细胞被破坏时即释放入血,并在短时间内达到峰值,由此推测,干热环境和创伤失血性休克的双重打击使机体肝细胞受到损伤,且随着时间延长,损伤程度进一步加重,此时机体启动了调节机制,调动周围血管内的血液进入肝、肾、脑等重要器官,以保证血液及氧的供应,并为延缓重要器官的不可逆损伤提供时间;其次肝脏内血供极为丰富,具有肝动脉及门静脉两套供血系统,一套血供不足或携氧量下降时可由另一套作为补充,沙漠干热环境下虽然血容量减少、机体代偿功能下降,但相应的代偿能力并没有消失,其独特的血供系统可能是保证肝脏短时间正常运转的重要条件,但平衡再次被打破,肝脏很快进入失代偿阶段,ALT及AST再次升高,表明肝脏缺血缺氧及损伤程度不断加重;而常温环境下,机体代偿能力相对完好,ALT及AST再次升高较为延缓,肝损伤进程相对缓慢。
TNF-α、IL-1β作为最具代表性的炎性因子在全身或局部炎症反应中扮演着重要角色。在肝脏内TNF-α与IL-1β主要由Kupffer细胞释放[17]。本研究发现,沙漠干热环境下创伤失血性休克猪模型建立后,出现了特殊的肝脏代偿及缺血再灌注损伤,与常温环境下比较,各时间点TNF-α与IL-1β在肝内表达量增加。分析其原因可能为,沙漠干热环境下肝损伤激活了更多的Kupffer细胞,可上调丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)p38亚族信号分子[18]的表达,合成并释放大量的TNF-α、IL-1β,从而诱导中性粒细胞释放更多的氧自由基(ROS),形成大量脂质化过氧化物(LPO)。LPO可裂解生成具有细胞毒性的丙二醛(MDA),后者是造成细胞核酸突变及蛋白质变性的重要物质,最终导致组织器官损伤[19-20]。此外,作为一种趋化因子,IL-1β可促进T淋巴细胞活化及B淋巴细胞分泌抗体,诱导肝细胞损伤急性期合成各种蛋白,上调中性粒细胞的功能,增强炎症反应对肝细胞的破坏作用;而TNF-α具有肝细胞毒性,可直接引起肝细胞坏死,并与内毒素及其他炎性介质相互作用,产生级联反应,加重急性肝损伤。肝内上述两种炎性因子水平升高可直接或间接对肝脏产生破坏作用,尤其在沙漠干热环境下TNF-α与IL-1β均较常温环境下表达增加,表明肝细胞内炎性因子表达增强并对肝细胞产生破坏,从而引发更为严重的肝损伤。而DHC组TNF-α及IL-1β水平并未出现明显的升高,可能是因未造成创伤失血性休克,短时间内机体调动代偿机制,对肝细胞没有造成实质性的破坏。
作为一种炎性介质,HMGB-1在创伤失血性休克、脓毒症、类风湿关节炎、恶性肿瘤等多种疾病中发挥重要作用[21-22]。HMGB-1主要在巨噬细胞内合成并释放到细胞外,而TNF-α、IL-1β、IL-18等炎性介质可促进HMGB-1的合成及释放[23]。被释放的HMGB-1与晚期糖基化终产物受体(RAGE)结合,激活MAPK、p38、细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)等多种信号转导途径,使MAPK发生磷酸化,引起核转录因子κB(NF-κB)激活并最终启动炎症应答,且可指导趋化因子、细胞因子的迁移活动[24]。此外激活上调的p38信号转导途径可促进TNF-α及IL-1β的释放,加重炎症反应。ICAM-1是一种黏附分子,主要存在于肝血管内皮细胞表面,其结构为跨膜单链糖蛋白[25],正常情况下表达非常少,组织损伤后,经上游信号通路(NF-κB)调控后表达量增加,当ICAM-1异常表达时可引起内皮损伤。在炎症反应中,ICAM-1可将单核/巨噬细胞、淋巴细胞等向血管内皮黏附,牵引白细胞向炎症区移行,并促使白细胞释放更多炎性介质和细胞因子。另外,ICAM-1在肝内可募集各种炎性细胞阻塞肝脏微循环,导致肝脏缺血缺氧,进一步加重肝损伤[26]。有研究发现,在TNF-α、IL-1β的作用下,ICAM-1表达明显增加,TNF-α、IL-1β与ICAM-1具有相互促进的作 用[27-28]。由此可见,ICAM1、TNF-α、IL-1β在炎症反应中均起着重要作用。
综上所述,干热环境创伤失血性休克猪继发肝损伤可能与激活了更多的Kupffer细胞,上调p38信号分子,促使TNF-α、IL-1β大量释放,并进一步引起HMGB-1、ICAM-1高表达有关,上述炎性因子相互协同并促进肝组织损伤。如何提高机体在特殊环境下的耐受力,减轻应激损伤,抑制或减缓炎性因子的释放,是特殊环境下失血性休克继发肝损伤防治的关键环节。目前干热环境下创伤失血性休克的相关研究尚处于初始阶段,其具体机制仍有待深入探讨。

