房间隔缺损合并先天性纤维蛋白原缺乏的体外循环围术期管理:1例报告并文献复习
李杨,李洪利,齐德林,冯磊,李超,丁瑞田,刘燕晖,尚学斌
首都医科大学宣武医院心脏外科,北京 100053
先天性纤维蛋白原缺乏症(congenital fibrinogen deficiency,CFD)是一种十分罕见的常染色体遗传病,由于机体合成的纤维蛋白原数量减少(甚至缺如)和(或)分子结构异常而造成凝血功能障碍,患者可表现自发出血、外伤后出血、颅内出血、血栓栓塞等并发症[1]。自1920年首次报道以来,目前全世界已发现约150例,发病率约为百万分之一[2]。CFD是体外循环(cardiopulmonary bypass,CPB)心脏术后出血过多的重要原因之一。房间隔缺损(atrial septal defect,ASD)是原始房间隔在胚胎发育过程中出现异常,致左、右心房之间遗留孔隙,根据发生学的不同可分为原发孔型和继发孔型[3]。对于不宜介入治疗的继发孔ASD(以左向右分流为主)可实施外科手术治疗。通常情况下,常规CPB辅助下修补ASD难度不大,但对于合并CFD的ASD患者,实施外科手术具有较高的术后出血风险。目前关于ASD合并CFD治疗的围术期管理尚缺乏循证医学证据,补充纤维蛋白原(fibrinogen,FIB)的方案仍存在争议。本研究报告1例ASD合并CFD患者CPB的围术期管理情况并进行文献复习。
1 资料与方法
1.1 临床病史 患者女,30岁,因体检发现ASD 8个月为主诉入院,患者幼年经常发生上呼吸道感染,偶伴肺炎,随着年龄增长,发生频率下降,8个月前单位体检时行心脏超声发现房间隔连续性中断,肺动脉高压,医师建议手术治疗,为进一步诊治来本院。平素活动后无胸闷、气短、心慌及乏力等不适,无发绀,饮食及二便正常,体重无明显下降。既往史:受伤后出血时间延长,2009-2017年因黄体破裂曾行4次卵巢修补术,为预防黄体破裂,长期服用促性腺激素释放激素激动剂(GnRHa)。家族史:母亲有低FIB病史,父母为近亲结婚。
1.2 入院查体 体温36.5 ℃,血压120/80 mmHg,心率82次/min,呼吸18次/min,经皮动脉血氧饱和度100%,营养一般,体型消瘦,面色苍白,口唇无发绀,咽部无红肿,扁桃体及甲状腺无肿大,胸廓无畸形,双侧呼吸动度一致,双肺呼吸音清,未闻及干湿啰音,未触及胸膜摩擦感,心前区无隆起,心尖搏动在左侧第五肋间锁骨中线内0.5 cm,未触及震颤,心音有力,律齐,胸骨左缘2~3肋间可闻及3/6级柔和的收缩期杂音,P2亢进伴固定分裂,未闻及心包摩擦音。腹软,无压痛、反跳痛及肌紧张,肝脾肋下未及,肠鸣音4次/min,四肢关节无畸形,无杵状指/趾,神经病理征阴性。
1.3 辅助检查 血常规:白细胞10.05×109/L[参考值(4.0~10.0)×109/L],血红蛋白127 g/L(参考值110~150 g/L),血小板341×1012/L[参考值(100~300)×1012/L]。生化:乳酸脱氢酶275 U/L (参考值109~245 U/L),球蛋白37.7 g/L(参考值25~35 g/L),低密度脂蛋白3.73 mmol/L(参考值2.08~3.12 mmol/L),载脂蛋白A1 1.64 g/L(参考值1.0~1.6 g/L)。凝血功能检查结果如表1所示。动脉血气分析:pH 7.41,PaO292.5 mmHg(参考值8 0 ~1 0 0 m m Hg),PaCO23 3 m m Hg(参考值3 5 ~4 5 m m H g),乳酸1.5 m m o l/L(参考值0.4~1.8 mmol/L)。
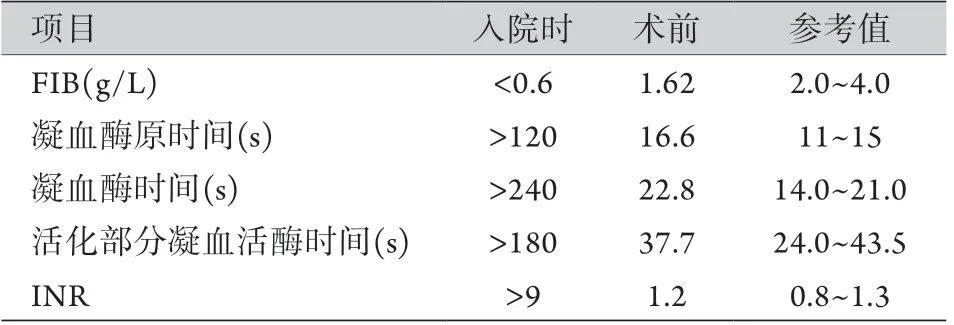
表1 ASD合并CFD患者凝血功能检查结果Tab.1 Results of coagulation function examination of patients with atrial septal defect and congenital fibrinogen deficiency
1.4 心电图及影像学检查 心电图检查示:导联Ⅰ以负向波为主,导联Ⅲ以正向波为主(R>S),导联Ⅱ、Ⅲ和avF中P波振幅>0.25 mV,导联Ⅰ的S波加深,avR以正向波为主(R>Q),avR的R波>0.5 mV,V1的R波增高,V5的S波增深,RV1+SV5>1.2 mV,V1和V2导联QRS波群呈M形态改变,QRS波群的时限≥0.12 s。X线片示:右心增大,肺动脉段突出,主动脉结小,肺纹理增多,心胸比例0.55。心脏超声检查示:房间隔中部回声中断约34 mm,彩色多普勒超声探及收缩期左向右分流,分流速度115 cm/s,缺损边缘距上腔静脉约7 mm,距下腔静脉约6 mm,三尖瓣反流压差66 mmHg,估测肺动脉收缩压(systolic pulmonary artery pressure,SPAP)76 mmHg,射血分数(ejection fraction,EF)64%。术前头颅CT和MRI检查已排除脑、脊髓血管畸形。
1.5 诊断及治疗 术前诊断:先天性心脏病,继发孔ASD(中央型,左向右分流),肺动脉高压(重度),右心扩大,三尖瓣反流(中度),CFD,卵巢黄体破裂修复术后。术前3 d,每天静脉给予人FIB 4 g(深圳卫光生物制品股份有限公司,国药准字1S520000)。患者于2019年12月26日在全麻CPB下行不停跳ASD修补术,手术当日晨再次复查凝血功能(表1),术中常规正中开胸,肝素化(3 mg/kg),经主动脉及上、下腔静脉插管,建立CPB,鼻温降至34 ℃,阻断上、下腔静脉,并行循环,头低右侧抬高体位,心脏不停跳,切开右房,4-0 Prolene线直接缝合ASD,打结前嘱麻醉膨肺,左心排气,术中给予人FIB 2 g,探查三尖瓣瓣叶完整,三尖瓣前瓣和后瓣对合欠佳,外交界间断缝合两针,反复注水试验,未见明显反流,5-0 Prolene线连续缝合关闭右房切口,开放上下腔静脉阻断带,鱼精蛋白1:1中和肝素,顺利停机拔管,再给予人FIB 2 g,手术时间3.5 h,CPB时间45 min。
1.6 术后情况 术后安返ICU病房,呼吸机辅助时间4 h,拔除气管插管,术后输入新鲜冰冻血浆600 ml,红细胞2 U,第2天转回普通病房。术后每天滴注人FIB 4 g,连续5 d。胸腔纵隔引流量:第1天400 ml,第2天600 ml,第3天560 ml,第4天130 ml,第4天拔除胸腔引流管。术后未发生出血及血栓栓塞并发症,凝血相关指标如表2所示,切口愈合佳,术后第7天出院。
1.7 随访 术后3个月门诊随访,患者手术切口愈合佳,无自发性出血。复查心脏超声提示房间隔未见残余分流,少量心包积液,EF为67%。
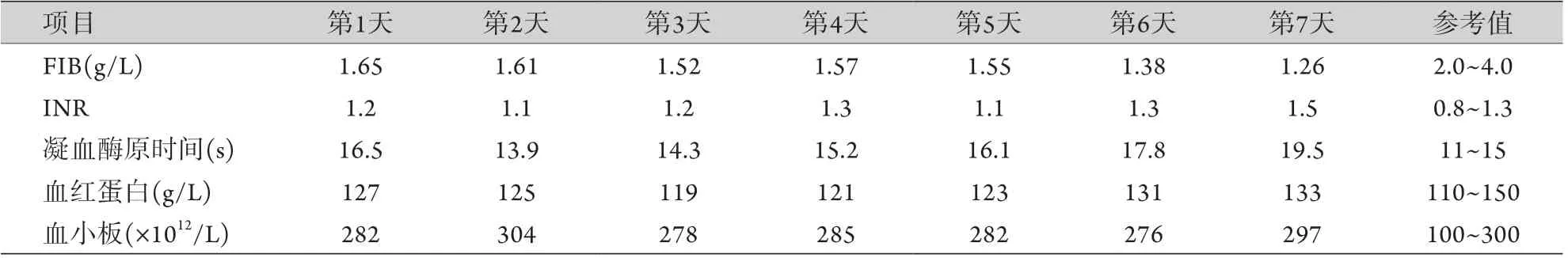
表2 ASD合并CFD患者术后复查的凝血相关指标Tab.2 Coagulation related indexes of postoperative reexamination of patients with atrial septal defect and congenital fibrinogen deficiency
2 文献复习
以“congenital fibrinogen deficiency”“hypofibrinogenemia”“cardiac surgery”“cardiopulmonary bypass”和“perioperative management”为关键词,在PubMed数据库中检索英文文献并获取全文(截至2020年1月31日),共检索到英文文献8篇(研究对象为人类)[4-11],包括875例CPB心脏手术后低蛋白血症患者,其中男604例(69.0%),女271例(31.0%)。
其中6篇为个案报告[4-9],包括婴幼儿1例(出生后5 d,体重2.5 kg),成人5例,均为男性,年龄(27.6±8.4)岁,中位年龄22.5岁。其中美国2例,英国1例,澳大利亚1例,加拿大1例,印度1例。所有患者均诊断为CFD,临床表现多样,包括自发性出血1例,左颈内动脉急性闭塞导致的左侧大脑中部区域脑梗死1例,因严重酸血症出现呼吸骤停和弥散性血管内凝血(disseminated intravascular coagulation,DIC)1例,此外大多数患者有受伤后出血时间延长。术前给予新鲜冰冻血浆、冷沉淀、血小板及FIB替代治疗,维持血清中FIB含量>1.0 g/L。 心脏手术均在CPB下完成,手术方式包括肺动脉狭窄解除术、主动脉赘生物清除术、主动脉瓣膜狭窄解除术、主动脉瓣膜置换+冠状动脉搭桥术、ADS修补及主动脉弓中断矫正术。CPB时间(132±37) min(中位时间135 min),手术时间(188±56) min(中位时间192 min)。术后未见出血并发症,二次开胸手术取出冠脉血栓1例,合并真菌感染死亡1例。
德国Ranucci等[10]报道了一项单中心、前瞻性、随机、安慰剂对照、双盲研究,共纳入116例接受心脏手术的患者,预计体外循环持续时间>90 min。治疗组患者在鱼精蛋白中和肝素后输注FIB浓缩物,对照组给予生理盐水,结果显示,治疗组患者的血液制品使用率明显降低(OR=0.40,95%CI 0.19~0.84,P=0.015),术后出血量明显减少[355(250~600) ml vs. 300(200~400) ml,P=0.042],表明输注FIB浓缩物减轻了复杂心脏手术的术后出血,可明显减少血液制品用量。
加拿大Callum等[11]报道了一系列心脏外科术后出现明显出血及低FIB血症的成人患者,共735例,中位年龄64岁,30%为女性,72%接受复杂手术,95%有中重度出血,治疗前FIB<1.6 g/L。将患者随机分为两组,其中372例CPB心脏手术后24 h给予FIB浓缩物4 g,363例给予冷沉淀10 U。统计术后24 h血液制品(红细胞、血小板和血浆)的输注量,以评价非劣效应(非劣效比值阈值<1.2)。结果显示,FIB浓缩物组为16.3(95% CI 14.9~17.8) U,冷沉淀组为17.0(95% CI 15.6~18.6) U,FIB浓缩物对于减少CBP术后24 h血液制品输注量不劣于冷沉淀(非劣效性P<0.001)。FIB浓缩物组26例(7.0%)、冷沉淀组35例(9.6%)发生血栓栓塞事件。该结果表明对于CFD心脏术后患者,可以考虑使用FIB浓缩物治疗出血。
3 讨 论
出血过多是心脏手术后常见的并发症,CFD是导致出血的重要原因之一[12]。CFD是一种罕见的常染色体隐性或显性遗传病,发病率约为百万分之一。CFD包括FIB数量异常和质量异常两类,其中数量异常包括低FIB血症(血液中FIB<1.0 g/L,为杂合子型)和无FIB血症(血液中FIB缺如或检测微量,为纯合子型),质量异常为FIB分子结构异常,此类型可合并数量异常。该病的临床表现多样,低FIB血症的患者常无出血症状或者症状较轻,大多数有受伤后出血时间延长;无FIB血症的患者以全身各部位自发出血为特征;质量异常FIB血症的患者可有出血和栓塞症状并存。CFD诊断主要依据实验FIB定量检测,除外可引起继发性FIB减少的原发病(如严重感染、肝功能异常、DIC、大剂量糖皮质激素治疗、溶栓药或者肝素使用过量等情况),伴或不伴有家族史[13-15]。本病例血液中FIB降低,未治疗前多次复查均<0.6 g/L,排除可能继发FIB降低的疾病,平时有受伤后出血时间延长,但无自发性出血,其母亲为低FIB血症,父母为近亲结婚,诊断为杂合子型CFD。
FIB是人体血液循环中最丰富的凝血因子,通过促进血栓形成和血小板聚集,在血栓形成和凝血级联反应中发挥重要作用。CPB是一种非生理过程,研究发现,长时间CPB可使血浆FIB含量和活力均受到损害,围术期渗血增多,常需大量异体输血。由于FIB在体内储备有限,其水平降低到1.5~2.0 g/L即会损伤凝血功能,增加出血并发症的可能。低FIB被认为是CPB心脏术后出血的重要预测因子[16]。合并CFD的患者行CPB心脏手术往往出现严重的术后出血并发症。有研究发现,FIB每降低1 g/L,术后出血风险可增加数倍[17]。因此,对于CFD患者,术前补充FIB可降低CPB围术期出血风险,术前血液中FIB含量应至少达到1.5 g/L,其手术出血的风险才可与非CFD患者相当。血液病诊疗指南推荐输注FIB、冷沉淀物或者新鲜冰冻血浆补充血液FIB[18]。静脉输入FIB 1 g可提升血液中FIB约0.25 g/L,每单位冷沉淀物约提高血液FIB 0.06 g/L。如果没有FIB和冷沉淀物,也可用新鲜冰冻血浆替代治疗,每100 ml新鲜冰冻血浆可提供FIB 0.2~0.3 g。根据患者的体重、血容量和血浆FIB浓度,计算注射替代品的量,以达到血液FIB的目标值。由于FIB的半衰期为3~4 d,所以需要间隔3~4 d继续替代治疗。
大量研究证实,CPB患者有目的地补充FIB能够快速恢复凝血功能,避免或尽量减少输注同种异体血浆,从而减少术后出血[19]。本病例采用静脉输注人FIB的围术期管理方法,取得了良好的治疗效果,围术期凝血相关指标保持稳定,未见出血及血栓栓塞等并发症发生。术前3 d连续输注人FIB 4 g/d, 维持血浆FIB>1.5 g/L。由于CPB可破坏血液成分,造成凝血功能异常,特别是深低温停循环会消耗大量的凝血因子,因此心脏手术应尽可能采取非CPB的方式,如采用CPB手术,应尽可能采用浅低温或者不停跳的方式。在CPB中和停机后分别输注2 g人FIB,可减少术后出血和血液制品的使用量。术后5 d血浆FIB仍需维持在1.5 g/L以上,密切监测胸腔及纵隔出血量和引流量,确认无活动性出血,胸腔纵隔引流不多,拔除引流管后再降低FIB的输注量。术后第5天开始维持FIB在1.0 g/L以上即可,直至拆线,拆线出院后不需要预防性补充FIB。
围术期应及时复查FIB定量及凝血功能,以指导替代治疗。实际上,CFD并不影响血红蛋白及血小板的质量和功能,替代治疗前后均能保持正常水平。传统实验室凝血功能检查周期长,存在监测滞后的缺陷。目前,现场即时的旋转血栓弹力图(rotational thromboelastometry,ROTEM)可帮助医师更快速、完整地了解患者的凝血功能状态,更好地指导围术期替代治疗[13,15]。在CPB心脏手术后,如果没有手术出血,内源性FIB可以每小时0.08 g/L的速度自然恢复。单纯根据体外循环后一段时间单点测量血浆FIB而进行FIB浓缩物输注是不合理的。因此,对于体外循环术后低FIB患者应多时间点检测凝血功能,以调整FIB浓缩物的用量。术后2 d,每6~8 h检测一次凝血功能为宜。
除围术期补充足够的FIB外,手术操作本身也可影响患者的治疗效果。因此,手术操作应尽可能快,止血要充分,手术时间应尽可能短。本例术前诊断继发孔ASD(左向右分流),合并三尖瓣中度反流和肺动脉重度高压,不宜行介入封堵,因此医师采取外科手术治疗的方法,手术方式为CPB辅助不停跳ASD修补术,与CPB停跳心内直视缺损修补相比,此手术方法操作简单,可缩短手术时间,减少术中出血以及纤维蛋白原的降解。对于CPB的全肝素化,术中及术后需要警惕硬膜外血肿及颅内出血的风险[20]。术中应严密监测,及时发现异常,若术后出现新发的或持续进展的背痛、感觉或运动缺失、二便失禁等神经系统症状,应尽可能快速地进行头部CT或MRI检查,以明确是否存在脑血管意外,同时尽快请神经科医师会诊评估,决定进一步的干预措施。
综上所述,FIB缺乏是导致CPB心脏手术后出血过多的重要原因之一。围术期需要补充FIB、冷沉淀或者新鲜冰冻血浆,以提高血浆FIB水平,预防术后出血。根据患者围术期的FIB定量和凝血相关指标,综合评估患者的凝血状态,并结合替代治疗的反应性和有效性,做出个体化的CPB围术期管理方案。

