天然环庚三烯酚酮类化合物的生物合成及生物活性研究进展
张丛,武临专,王丽非,洪斌
环庚三烯酚酮(tropolone)类化合物最早在真菌的次级代谢天然产物中被发现,随后,在细菌次级代谢产物、植物和海洋生物中也发现了此类化合物的存在[1]。它的核心基团为独特的环七-2,4,6-三烯酮非苯芳香环结构。环庚三烯酚酮类化合物目前已被报道具有广泛的生物学活性,主要包括抗菌、抗病毒、抗肿瘤、抗炎、杀虫等作用[2]。构效关系研究表明,一些环庚三烯酚酮类化合物的活性来自于核心的非苯芳香环结构,针对某些生理相关的金属酶,该结构具有金属螯合和氧化还原能力[3-5]。本文主要对天然的环庚三烯酚酮类化合物的结构多样性、生物合成机制以及相关的生物活性报道进行综述。
1 结构多样的环庚三烯酚酮类天然产物
1942 年,研究人员最初从一株青霉菌属(Penicillium stipitatum)真菌代谢产物中提取并分离得到密挤青霉酸(stipitatic acid),然而并没有确证它的结构[6]。1945年,科学家猜想密挤青霉酸可能包含非苯环的芳香环结构[7]。直到 1950年,该化合物的结构才被证实,即包含七元非苯基芳香环结构,这种结构被命名为环庚三烯酚酮[8]。自此,开启了人们对非苯环芳香族化合物的研究热潮。
迄今为止,随着化学分离技术、测序技术、分子生物学技术的发展,已在真菌、细菌和植物的代谢产物中提取、分离与鉴定了 200 多种天然的环庚三烯酚酮化合物,但是在天然产物中环庚三烯酚酮的核心母核结构依然十分少见[2]。常见的环庚三烯酚酮类化合物根据母核结构上取代基团的性质,取代基团上碳环的数目以及杂原子的存在与否,大体分为 9 类:环庚三烯酚酮和羟基环庚三烯酚酮(hydroxytropolone)、环庚三烯酮(tropone)、欧侧柏酚(thujaplicin)及其类似物、环庚三烯酚酮酸、简单的双环环庚三烯酚酮、含有一个环庚三烯酚酮单元的多环结构、含有两个环庚三烯酚酮单元的多环结构、含硫原子的环庚三烯酚酮、含氮原子的环庚三烯酚酮,展现了这一类化合物的结构多样性(表1)[1,9]。
2 环庚三烯酚酮类化合物的生物合成途径
随着越来越多的新环庚三烯酚酮类化合物的发现以及它们多样的生物活性被报道,吸引人们越来越关注这类化合物的生物合成途径。了解这类化合物的生物合成途径,有利于在不同物种中寻找发现新结构的环庚三烯酚酮衍生物,利于对此类化合物进行定向改造,提高特定活性衍生物的产量。在原核生物和真核生物中,环庚三烯酚酮生物合成途径各不相同。细菌使用莽草酸途径、苯乙酸代谢或 II 型聚酮合成酶(polyketide synthase,PKS)产生环庚三烯酚酮的核心骨架;而真菌利用非还原性聚酮合成酶(non-reducing polyketide synthase,nr-PKS)途径;植物利用萜类或生物碱途径来合成关键的七元环部分。尽管合成路线不同,但是在以上途径中,环庚三烯酚酮的七元环都是由六元环氧化扩环而来。
2.1 莽草酸途径和苯乙酸代谢
在细菌的代谢产物中发现了环庚三烯酚酮类化合物,引起了人们对这类化合物生物合成途径的关注。1992年,科研人员利用同位素示踪的方法在植物病原菌Burkholderia plantarii中发现,葡萄糖可经莽草酸途径合成苯乙酸,随后苯乙酸代谢为含有环庚三烯酚酮结构的化合物 tropodithietic acid(TDA)[10]。2012年,通过对合成 TDA 的关键酶基因阻断实验,证实 TDA 确实起源于莽草酸途径和苯乙酸代谢偶联的生物合成途径[11]。
双功能酶 PaaZ 是苯乙酸代谢途径中的关键酶。PaaZ的 N 端包含一个醛脱氢酶(aldehyde dehydrogenase,ALDH)结构域,C 端包含烯酰辅酶 A 水合酶(enoyl-CoA hydratase,ECH)结构域。PaaZ 的 ECH 结构域能够催化氧杂环庚三烯酮环水解断裂生成半醛结构,ALDH 结构域进一步氧化半醛结构,并在其他酶的催化下将 PAA 降解为2 分子乙酰辅酶 A 和 1 分子琥珀酰辅酶 A[12]。3,7-二羟基环庚三烯酚酮(dihydroxytropolone,DHT)是从链霉菌中分离得到的一种具有抗菌、抗癌和抗病毒活性的多羟基环庚三烯酚酮类化合物。Chen 等[13]通过异源表达,基因敲除和生物转化方法确定了 DHT 的生物合成途径。在异源宿主天蓝色链霉菌中,产生 DHT 需要 DHT 生物合成基因簇trl和位于trl基因簇之外的基因簇paa,paa编码好氧苯乙酸降解途径相关的酶。天蓝色链霉菌中存在着与 PaaZ 的 C 端ECH 结构域同源的蛋白 TrlA,但是 TrlA 缺少 ALDH 结构域,从而截断了苯乙酸分解代谢途径,为七元环中间体的形成提供更多的苯乙酸前体。TrlB 和 TrlH 促进了苯丙酮酸的从头合成,从而为链霉菌高产生 DHT 提供了丰富的前体。单加氧酶 TrlE 和 TrlCD 催化环庚三烯酮的区域选择性羟基化生成 DHT(图1)。这一研究揭示了链霉菌中分支酸和苯丙酮酸的合成、苯乙酸的分解代谢和环庚三烯酚酮的生物合成之间的天然联系。
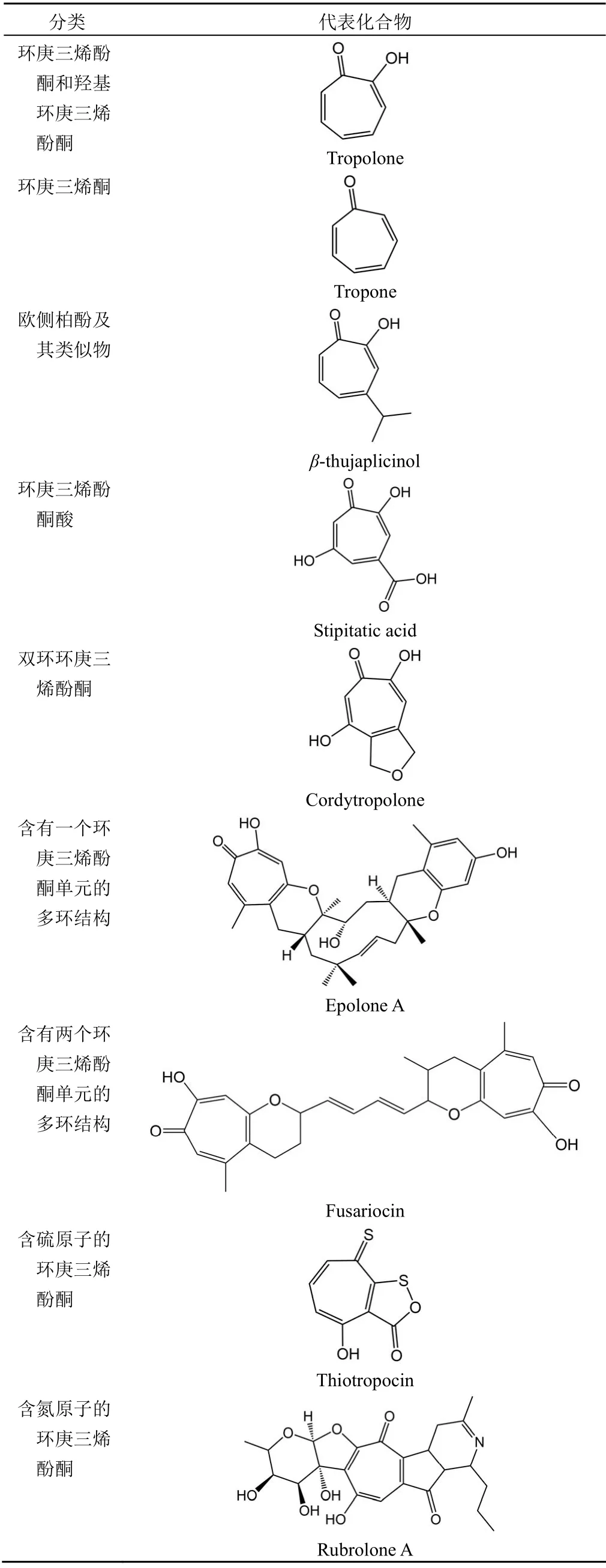
表1 环庚三烯酚酮类化合物的分类
基于对细菌产生环庚三烯酚酮类化合物生物合成机制的理解,Li 等[14]设计了一条杂合的环庚三烯酮的生物合成途径,将苯乙酸降解途径和环庚三烯酮的生物合成相结合,在大肠杆菌中进行重组。为了简化生物合成途径的构建,整条生物合成路线最大限度地利用了大肠杆菌内源基因,共分为四个模块:内源莽草酸途径、杂合的 PAA 生物合成模块、内源 PAA 分解代谢模块和异源的环庚三烯酮生物合成模块。同时,引入点突变,使 PaaZ 的 N 端醛脱氢酶结构域失活,将碳流重新导向到环庚三烯酮的合成。最终在摇瓶实验中,利用这种人工设计的生物合成途径从头合成环庚三烯酮,最佳效价为(65.2 ± 1.4)mg/L。这一研究结果,为可持续生产环庚三烯酮及其衍生物提供了潜在的策略与方向。
2.2 II 型 PKS 途径
Isatropolones、rubrolones、isarubrolones 以及 rubterolones等化合物是由放线菌产生的次级代谢产物,它们结构相似,都是具有一个环庚三烯酮环、一个四取代吡啶环、一个环戊酮、一个脱氧糖等的多环化合物。由于这一系列化合物具有广泛的生物学活性和潜在的工业应用价值,关于它们的生物合成方面的研究相继开展。
Yan 等[15]利用同位素标记的方法确定在链霉菌中rubrolones 的生物合成由 II 型 PKS 催化,核心骨架经过复杂的氧化重排形成环庚三烯酚酮结构。随后,Yan 等[16]报道了 rubrolones 的生物合成基因簇rub,通过异源表达和基因阻断实验证实了 rubrolones 生物合成的关键酶属于II 型 PKS 途径。生物信息学比较分析 rubrolones 的生物合成基因簇rub,isatropolones 的ist[17],其中都存在核心的 II 型pks基因和单加氧酶基因,并且具有很高的同源性。在rub和ist内部还存在糖基转移酶和糖合成相关的基因(图2A)。
Yan 等[16]对关键酶阻断株的代谢产物结构分析,确定了 rubrolones 的生物合成路线(图2B)。其中,对糖合成酶基因阻断时积累中间体,该中间体具有 1,5-二酮部分作为能够环化的胺受体,通过与氨水或者邻氨基苯甲酸进行非酶促的缩合和环化反应形成吡啶环,形成 rubrolones 的苷元。随后,糖合成酶催化生成糖苷[18],在糖基转移酶的作用下完成糖基化反应,生成 rubrolones。
Cai 等[17]通过异源表达,中间体结构表征确定了isatropolones 的生物合成途径,与 rubrolones 生物合成过程相似。Isatropolones 的 1,5-二酮部分能够与胺反应生成吡啶环,化合物的荧光性质随胺的结合而改变。由此,紫色的化合物 isarubrolones 是由黄色的化合物 isatropolones 与胺发生反应形成。
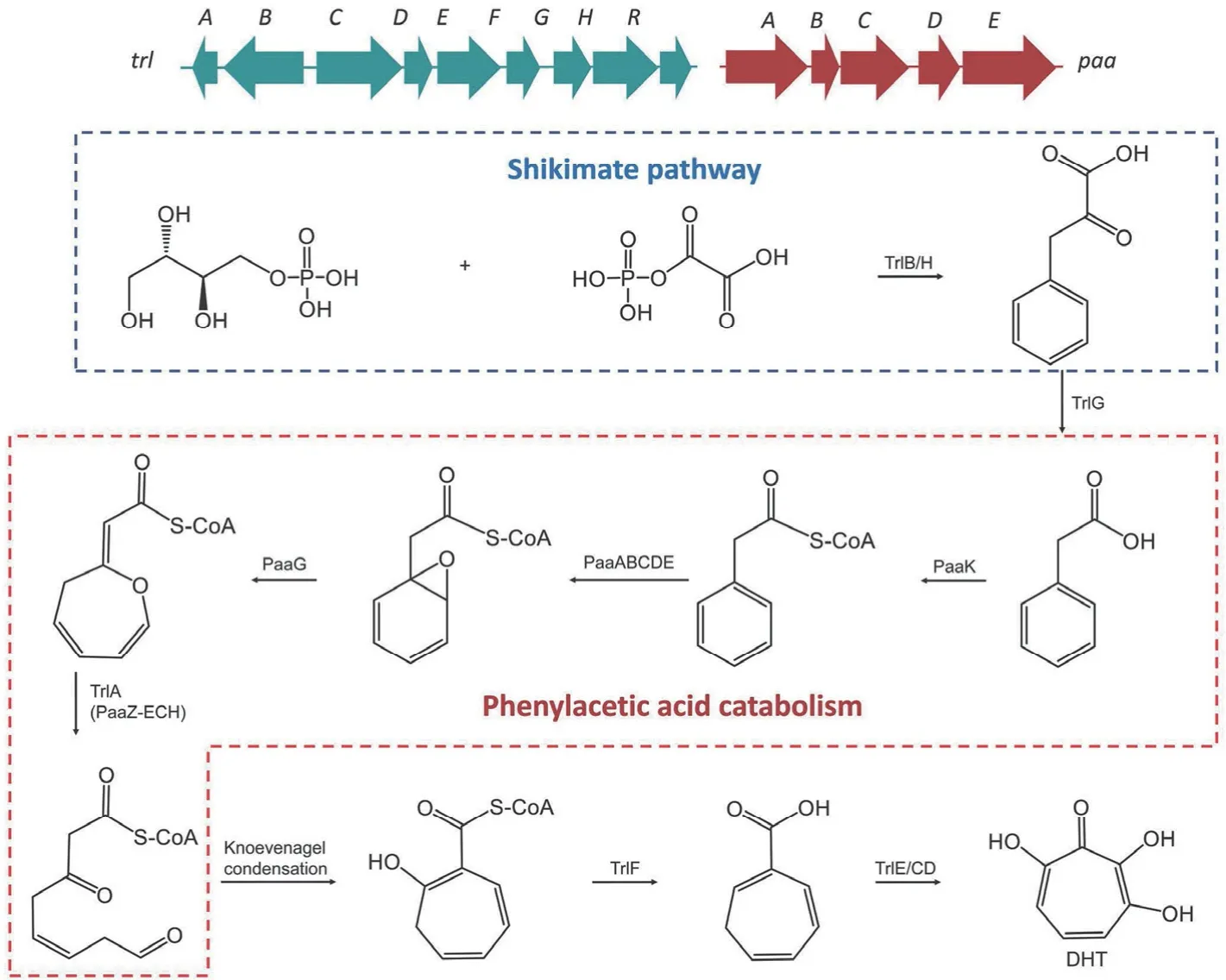
图1 3,7-二羟基环庚三烯酚酮的生物合成途径
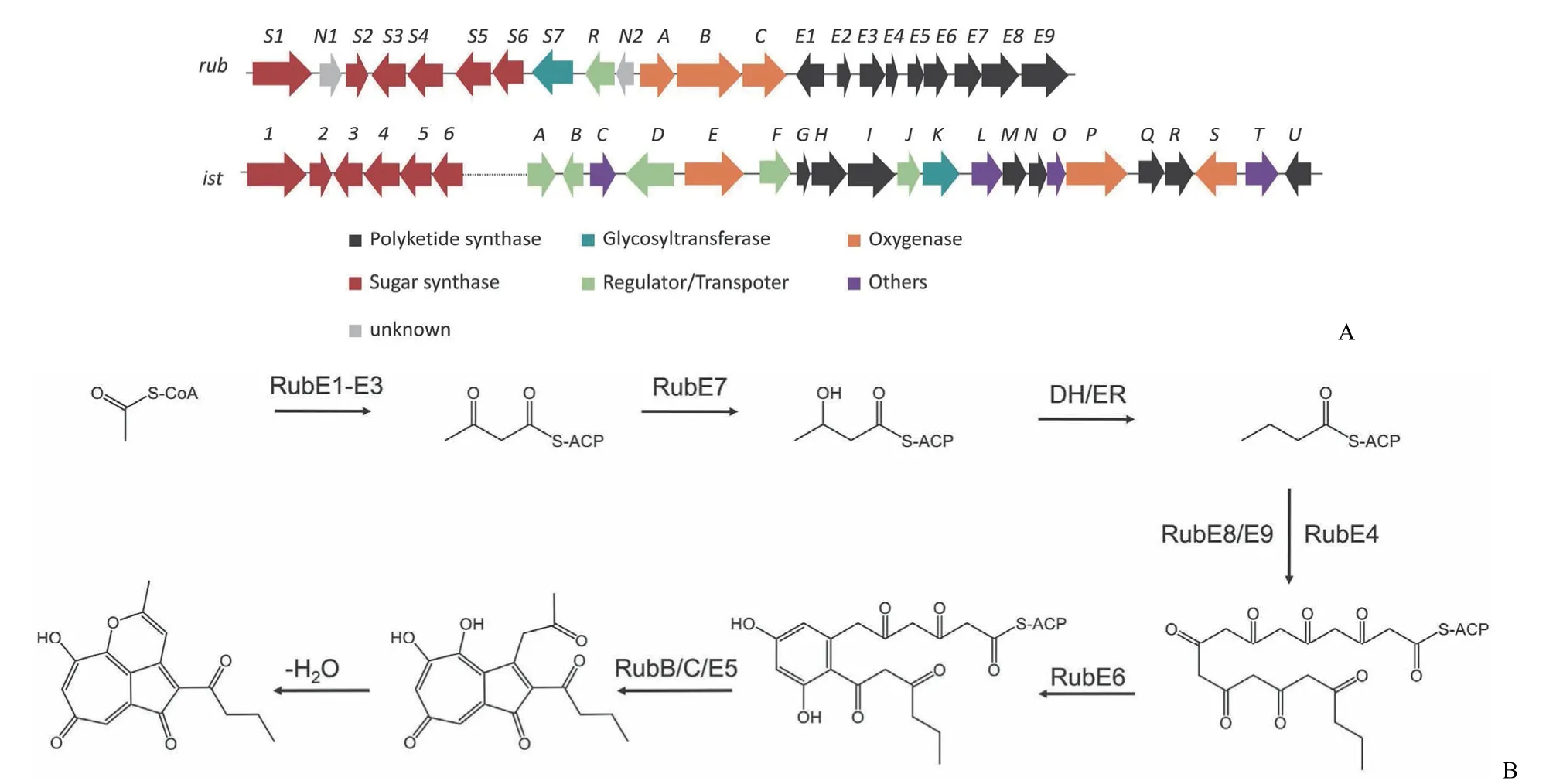
图2 II 型 PKS 途径合成环庚三烯酚酮类化合物(A:Rubrolones 生物合成基因簇 rub 和 isatropolones 生物合成基因簇ist 的比较;B:Rubrolones 环庚三烯酚酮环生物合成途径)
2.3 真菌的 nr-PKS 途径
青霉菌属来源的密挤青霉酸是第一个被发现的天然环庚三烯酚酮类化合物,同位素标记的底物饲喂实验证实密挤青霉酸的环庚三烯酮环并不来自于莽草酸途径[19],而是由乙酸盐和丙二酸盐为起始原料[20],经非还原性聚酮合酶催化生成六元苯环[21],苯环再经过一系列氧化重排扩环反应以及侧链的氧化最终生成密挤青霉酸。氧化重排包括两个过程,依赖于 FAD 的单加氧酶 TropB 先将苯环上的 C-3 位羟基化,使其脱芳香化,然后由非血红素 Fe2+依赖的双加氧酶 TropC 催化 3-甲基羟基化,完成第二次氧化扩环重排,形成七元的非苯基芳香环庚三烯酚酮环(图3)[22]。
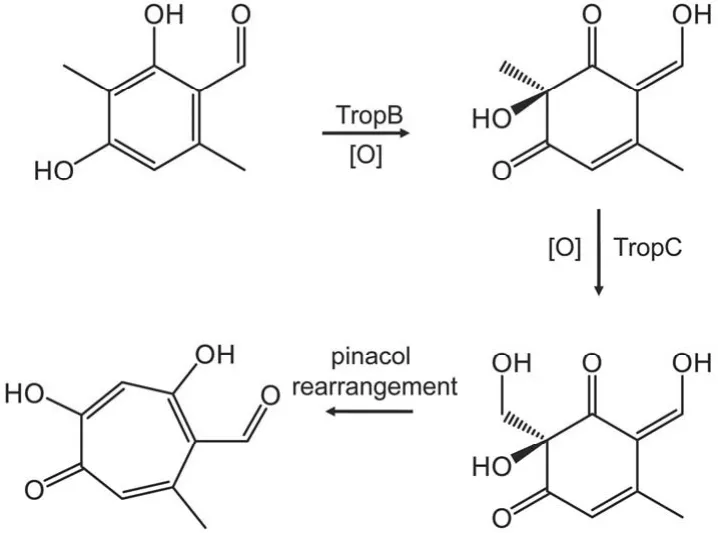
图3 密挤青霉酸生物合成中的氧化扩环反应过程
2.4 植物的萜类或生物碱途径
在植物中同样分离得到了多种天然环庚三烯酚酮类化合物,如秋水仙碱、β-thujaplicin 等。植物通过萜类和(或)生物碱途径产生环庚三烯酚酮部分,其中七元环也是由六元苯环经氧化扩环而形成。
利用同位素示踪方法研究β-thujaplicin 的生物合成过程,结果显示,β-thujaplicin 核心结构来源于柠檬烯骨架,通过选择性氧化反应和 C-C 键断裂重排形成环庚三烯酮环[23]。
在自然界中存在着大量秋水仙碱的类似物,由于它们复杂、特殊的化学结构,独特的生物功能,对这一类化合物的生物合成研究由来已久。秋水仙碱的环庚三烯酮结构来源于酪氨酸和苯丙氨酸,通过甲基化作用、氧化反应、苯酚偶联过程得到中间体,中间体六元环外部的 C-C 键断裂,进而发生重排形成七元环结构[24]。Nett 等[25]结合转录组学、代谢分析从嘉兰(Gloriosa superba)中发现了 8 个与秋水仙碱的前体N-甲酰秋水酰胺生物合成相关的酶,以及一个非经典细胞色素 P450 酶,该 P450 酶能够催化产生环庚三烯酮七元环骨架所必需的扩环反应。随后,研究人员将新发现的基因及其他必需的基因在本氏烟(Nicotiana benthamiana)中异源表达,实现了从氨基酸到N-甲酰秋水酰胺的人工生物合成,解析并重构了近乎完整的秋水仙碱生物合成通路。
3 环庚三烯酚酮类化合物的生物活性
天然的环庚三烯酚酮类化合物大多是植物或微生物的次级代谢产物,因其结构的多样性获得了多种的生物学活性,如抗菌、抗病毒、抗肿瘤、抗炎和杀虫活性等。
3.1 抑菌活性
大多数环庚三烯酚酮类化合物都具有抑菌活性,对革兰氏阳性菌和革兰氏阴性菌都有抑菌或杀菌作用,多数作用在细菌的细胞膜或细胞壁,造成细菌溶解。最早在 1938年,在环庚三烯酚酮结构还没提出之前,就已经发现β-thujaplicin对结核杆菌和其他细菌有显著的抑制活性[1]。TDA 在低微摩尔浓度下对多种革兰氏阳性菌、革兰氏阴性菌和子囊菌有明显的抑制作用[1]。荚膜多糖是细菌表面的一层黏液层,有利于免疫逃避和感染,双功能金属酶 CapF 是某些致病菌在荚膜多糖生物合成途径中重要的抗菌靶标。化合物 3-异丙烯基-环庚三烯酚酮(3-isopropenyl-tropolone)抑制 CapF催化的反应,扰乱荚膜多糖的关键前体的合成,从而达到抑制金黄色葡萄球菌的作用[26]。马铃薯疮痂病由疮痂链霉菌(Streptomyces scabies)引起,研究发现 isatropolone C 有抑制疮痂链霉菌的活性[27]。
环庚三烯酚酮类化合物对真菌同样有抑制作用。新生隐球菌(Cryptococcus neoformans)是一种常见于免疫抑制患者的病原体,研究人员通过药物筛选发现含有硫酯键的环庚三烯酚酮类化合物对隐球菌有杀菌作用,最小抑菌浓度(MIC)为 0.2 μmol/L,对肝细胞毒性小,治疗指数高,有望开发成新型抗隐球菌药物[28]。
3.2 抗病毒活性
环庚三烯酚酮类化合物的抗病毒活性主要表现为对人类免疫缺陷病毒(human immunodeficiency virus,HIV)、乙型肝炎病毒(hepatitis B virus,HBV)及丙型肝炎病毒(hepatitis C virus,HCV)的抑制作用。
HIV-1 逆转录酶核糖核酸酶 H(RNaseH)具有四种酶活性,对病毒复制至关重要,并且其催化活性需要金属离子的参与,而环庚三烯酚酮和羟基环庚三烯酚酮具有螯合金属离子的能力,能够抑制 RNase H 的活性,是潜在的抗 HIV候选药物[29]。2,7-二羟基环庚三烯酚酮能够紧密结合 Mg2+,表现出较高的金属亲和力,是 HIV-1 相关核糖核酸酶的有效和选择性抑制剂[30]。以此机制,Gao 等[31]优化设计了一系列环庚三烯酚酮类衍生物,保留其螯合金属离子的基团,这些化合物相较于β-thujaplicinol,抑制 RNase H 的活性更高。
由 HBV、HCV 感染引发的慢性肝炎、肝硬化和肝癌等疾病严重威胁着人类的健康,目前临床上治疗慢性肝炎病毒感染尚不能达到 100% 清除病毒的程度。HBV 通过逆转录病毒前基因组 RNA 来复制其基因组,而RNaseH 能够通过破坏已复制的病毒 RNA 产生双链 DNA,因此RNaseH 成为抑制 HBV 复制的靶点[32]。同样,2,7-二羟基环庚三烯酚酮因其对金属离子的螯合能力可作为抗 HBV候选药物[30]。3,7-二溴-5-(吗啉-4-甲基)环庚三烯酚酮是HCV 解旋酶的强抑制剂[33]。
单纯疱疹病毒(herpes simplex virus,HSV)-1 是一种大型双链DNA 病毒,感染了超过一半的美国人口,含有亲脂性侧链的 α-hydroxytropolones 对疱疹病毒具有很好的抑制活性[34-35]。
3.3 抗肿瘤活性
除了抗病原微生物的作用,对环庚三烯酚酮类化合物的抗肿瘤作用研究也比较广泛和深入。含有环庚三烯酚酮七元环的天然产物具有金属结合和氧化还原特性,是人类癌细胞生长的有效抑制剂。β-thujaplicinol 能够抑制畸胎癌细胞 F9的生长,影响分化进行,诱导细胞死亡[36]。Eglerisine 是一个包含环庚三烯酚酮骨架的倍半萜类化合物,对人类急性髓系白血病细胞系 Kasumi-1 具有抗增殖作用。其既不是通过凋亡,也不是通过坏死机制诱导细胞死亡,而是通过磷酸化H2AX 组蛋白,减少 S 期,增加细胞周期的 G2 期,使细胞周期在 72 h 后停止,从而造成细胞的绝对数目减少[37]。藜属植物Chenopodium albumLinn 中分离得到的一系列环庚三烯酚酮类衍生物对人肝癌细胞 HepG2 的谷草转氨酶和谷丙转氨酶水平均匀显著的保护作用,并对该细胞系具有一定的抗增殖活性[38]。对多种实体瘤及癌细胞系体外活性筛选结果表明,环庚三烯酚酮类化合物展现多样的抗肿瘤活性[39]。
3.4 抗炎活性
秋水仙碱是研究最深入的植物代谢物之一,具有抗有丝分裂、抗纤维化和抗炎的作用,已被美国食品药品监督管理局(FDA)批准为抗痛风、家族性地中海热、继发性淀粉样变性病和硬皮病的药物[2]。2,5-dihydroxycyclohepta-2,4,6-rienone(AD-4)在大鼠炎症模型中具有抗炎作用,且毒性低于对照药吲哚美辛,AD-4 显著降低透明质酸酶诱导的毛细血管通透性,推测其抗炎功能可能与改变血管透性的功能相关[40]。Rubterolones 可适度降低人单核细胞前列腺素E2(PGE2)的细胞水平,部分抑制微粒体前列腺素 E2合成酶-1(MPGES1)的活性[41]。
3.5 杀虫活性
有些环庚三烯酚酮类化合物具有杀虫活性。如从北美香柏中分离的包含环庚三烯酮类化合物的精油对热带地区储藏谷物中的害虫Callosobruchus maculatus有防治效果[42]。不同浓度β-thujaplicin 与曼氏血吸虫(Schistosoma mansoni)尾蚴共同孵育,利用透射电子显微镜观察,显示随着暴露时间的持续和暴露浓度的增加,尾蚴由超微结构变化发展为皮被和更深的实质结构变化,从而不能感染宿主,说明β-thujaplicin 对曼氏血吸虫幼虫有杀虫效果[43]。Isatropolones 是杜氏利什曼原虫(Leishmania donovani)有效的特异抑制剂,而 rubrolones 的杀虫活性较 isatropolones低,提示 isatropolones 的吡喃结构可以提高环庚三烯酚酮结构对杜氏利什曼原虫的杀虫活性[17]。秋水仙草中分离的一系列环庚三烯酚酮类生物碱对大利什曼原虫(Leishmania major)有较强的杀灭作用,且溶血活性和细胞毒性较低,具有较好的开发前景[44]。
3.6 其他生物活性
自噬是一种细胞的程序性死亡方式,负责清除冗余大分子或受损细胞器,以达到维持细胞稳态的目的。越来越多的研究表明自噬调节有望成为肿瘤、免疫系统疾病、心肌病等疾病的治疗靶点。Isarubrolones 和 isatropolones 类似物在人肝癌细胞 HepG2 中通过降低 ATG4a 水平,增加ATG7、ATG5 和 ATG4b 等泛素样酶水平,促进自噬体的形成,触发自噬过程[45]。抑制半胱氨酸蛋白酶 Atg4B 可以阻断自噬,benzotropolones 以 Atg4B 为靶点,可以显著减缓肿瘤生长并增强经典化疗的效果[46]。
来源于放线菌的 rubrolone A 和 rubrolone B 可以显著增加过氧化氢诱导损伤的新生大鼠心肌细胞的再生能力,提示 rubrolones 具有心肌保护作用[15]。β-thujaplicin 局部治疗可明显抑制小鼠的牙槽骨丢失和破骨细胞分化,具有开发成为治疗牙周炎药物的潜力[47]。
4 总结与展望
天然的环庚三烯酚酮化合物的化学结构具有多样性,并且具有抑菌、抗病毒、抗肿瘤、抗炎和杀虫等多种生物活性,是潜在候选药物和农业应用的重要来源。本文着重介绍了天然的环庚三烯酚酮类化合物的生物合成途径和生物活性。
但是,该类化合物的开发仍存在一定的瓶颈:一些活性化合物同时对有益微生物和哺乳动物有较强的细胞毒性[48];相较于结构多样的天然环庚三烯酚酮类化合物,只有少部分化合物的生物合成途径得到解析,对于生物合成过程中关键酶的功能报道仍十分有限;一些分子结构的具体形成机制也并未解析清楚,导致对于复杂的化合物如rubrolones 等尚不能被全合成[18];对不同生物活性的环庚三烯酚酮化合物的药物机制研究仍待深入,这些因素制约着该类化合物的进一步开发应用。
针对以上问题,将近期蓬勃发展的合成生物学方法应用于这一类化合物的研究可能会突破瓶颈。首先,需要不断地解析天然环庚三烯酚酮类化合物的生物合成途径,确定更多的生物合成关键酶的功能,建立并丰富遗传元器件库。在此基础上,一方面可采用基因组挖掘技术发现新的天然产物;一方面可引入工程学思想,通过对合成必需的遗传元件的重组,合成通路的合理设计,人工创造新结构的化合物。大量新结构环庚三烯酚酮类化合物的积累为进一步筛选新活性或活性高、毒性低、成药性强的化合物奠定基础,加速该类化合物的应用。

