尿酸对急性发作期痛风患者外周血中性粒细胞胞外诱捕网形成的影响及其临床意义
满达夫,侯云霞,李鸿斌
(内蒙古医科大学附属医院风湿免疫科,呼和浩特 010050;*通讯作者,E-mail:lhbwb73@126.com)
痛风是由嘌呤代谢紊乱、尿酸排泄障碍所致的一组异质性疾病,是由于单钠尿酸盐(monosodium urate,MSU)结晶在关节和软组织中积聚所致,其临床表现包括无症状高尿酸血症、急性痛风性关节炎、痛风石、慢性痛风性关节炎、尿酸性肾病和尿路尿酸盐结石等[1]。除关节损伤外,痛风患者还可合并心血管和肾脏疾病[2]。目前我国痛风的患病率在1%-3%,并呈逐年上升趋势[3,4]。尽管多数痛风患者关节炎症状会在2周内自愈,但其治疗不充分、患者依从性差是痛风管理的主要挑战。近年来国内外研究发现,血尿酸浓度增高形成高尿酸血症、尿酸沉积后形成的MSU可刺激单核巨噬细胞活化和多形核中性粒细胞(polymorphonuclear neutrophils,PMNs)活化脱颗粒引发局部炎症反应,是痛风发作的关键因素[5]。事实上,PMN激活后可释放由细胞质与颗粒的内容物及DNA组成的中性粒细胞胞外诱捕网(neutrophil extracellular traps,NETs),以消除细胞外病原体。从宿主-病原体的角度上考虑,NETs对宿主早期发挥抗感染免疫具有重要作用,然而研究表明中性粒细胞的过度活化可参与炎症和自身免疫过程,包括类风湿性关节炎、系统性红斑狼疮[6]。动物模型及体外实验表明沉积于关节腔内的MSU可激活NETs的形成,从而诱发急性痛风性关节炎到痛风石形成的一系列病理机制[7]。但是,外周血的中性粒细胞是否能在MSU诱导下激活NETs形成,参与痛风的病情活动尚未见确切报道。本研究旨在探讨MSU诱导的NETs水平是否与痛风的病情活动度和严重程度相关,即中性粒细胞对MSU的敏感性是否在急性痛风发作期与健康对照、缓解期之间存在差异。
1 材料与方法
1.1 研究对象
本研究纳入的所有研究对象来源于内蒙古医科大学附属医院,其中健康对照(healthy control,HC)组来源于体检中心25名成年男性健康志愿者,痛风(gout)组来源于风湿免疫科2017年1月至2018年1月期间住院及门诊的56名痛风性关节炎急性发作期患者,同时痛风组患者经治疗后1个月后处于缓解期(remission)作为疾病的阴性对照。纳入标准:根据2015年美国风湿病学会/欧洲抗风湿病联盟痛风分类诊断标准[8](ACR-EULAR Gout Classification Criteria),≥8分符合痛风诊断,或1977年美国风湿病协会分类标准急性痛风关节炎的分类标准[9]。排除标准:入组患者需除外其他风湿病史、骨关节病、血栓相关疾病和近期感染史。痛风组患者在接受治疗前完成外周静脉血采集和临床相关实验室检测,作为基线期数据。本研究通过内蒙古医科大学附属医院医学伦理委员会批准(批准号:KY20163202-1),所有受试者均签署知情同意书。
1.2 主要试剂与仪器

Leica DMI4000 B智能型倒置荧光显微镜(德国Leica公司),BD FACSCalibur全自动双激光四色流式细胞分析分选系统(美国BD公司),Sorvall ST 40R离心机、HeraeusTMFrescoTM21 Microcentrifuge、Heraeus Labofuge 400 R离心机购自美国Thermo Fisher Scientific公司),Bio Tek SNergy H4(美国伯腾仪器有限公司)。
1.3 方法
1.3.1 入组对象外周血中性粒细胞的分离 收取患者或健康对照的新鲜外周抗凝血5 ml,按照PolymorphprepTM密度梯度离心法分离人外周血中性粒细胞[10],吸取中性粒细胞层转移至新的离心管中,加入10 ml HBSS,上下颠倒数次,悬浮细胞,室温下400g离心10 min,弃上清。加入2 ml红细胞裂解液重悬,上下吹打混匀,300g离心5 min,弃上清,加入RPMI-1640培养基,计数,调至1×106/ml后待测纯度。
1.3.2 中性粒细胞纯度的检测 分别吸取10 μl细胞至3个洁净的1.5 ml EP管,300g离心5 min,弃上清。每管均加入200 μl PBS重悬细胞,一管加入20 μl CD16单抗作为实验组,另一管加入20 μl Mouse IgG1 kappa作为同型对照,最后一管则加入20 μl PBS作为空白对照。4 ℃避光孵育30 min,PBS洗涤2次,最后一次离心后加入200 μl PBS重悬细胞,上机分析,纯度大于95%的中性粒细胞进行后续实验。
1.3.3 体外诱导中性粒细胞形成NETs 24孔板中预先置入多聚赖氨酸处理的无菌玻璃片,按4×105个/孔接种上述实验分离出的中性粒细胞,CO2培养箱中静置培养细胞1 h。根据中性粒细胞来源不同,分为健康对照组(HC组)及痛风急性发作组分别加入等体积100 nmol/L佛波酯(PMA),125,250,500 μg/ml尿酸盐(MSU)分别诱导细胞,空白对照组(PBS组)予等体积PBS;3 h后收集细胞上清,用于检测游离cfDNA、NE浓度。
1.3.4 免疫荧光法检测NETs形成 细胞爬片固定,用1%BSA封闭30 min,用抗H3Cit、抗MPO孵育1 h,PBS洗涤后用相应二抗避光孵育1 h,之后DAPI染核1 min,洗涤后封片在荧光显微镜下成像观察。

1.3.6 病情评价指标 包括患者疼痛视觉模拟评分法[11](visual analogue scale,VAS)、痛风疾病评估问卷2.0版[12](gout assessment questionnaire,GAQ 2.0)及痛风疾病活动性评分[13](gout activity score,GAS)。
1.4 统计学处理
计数资料用频数(百分数)表示,计量资料用均数±标准差表示,根据数据的分布特点两组间的比较采用配对t检验(急性发作期和缓解期的相关数据)、独立t检验或卡方检验。变量间相关性分析采用Pearson相关分析。统计软件采用SPSS 19.0,以P<0.05认为差异有统计学意义。
2 结果
2.1 研究对象的临床特征
痛风急性发作组与健康对照组在年龄、性别、BMI、血糖和低密度脂蛋白之间的差异无统计学意义(P>0.05,见表1)。痛风急性发作组甘油三酯和血清尿酸水平高于健康对照组,差异有统计学意义(P<0.01,见表1)。
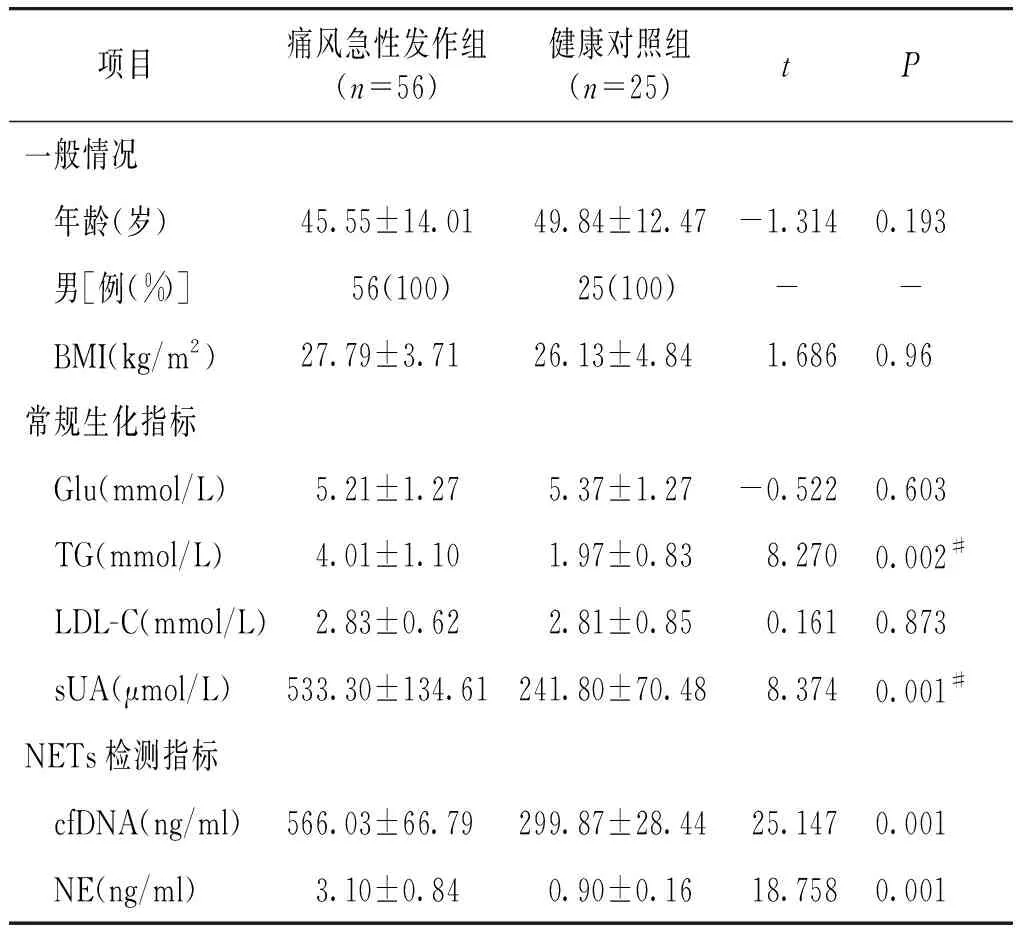
表1 入组研究对象的临床特征
2.2 中性粒细胞纯度的鉴定
根据CD16标记中性粒细胞鉴定分离纯度(见图1),FITC-CD16单抗标记分离的中性粒细胞,流式细胞术检测CD16阳性细胞纯度可达97.08%(图1红色矩形标出)。
2.3 HC组与痛风组中性粒细胞诱导形成cfDNA浓度的比较
图2为荧光显微镜NETs形成图,中性粒细胞经PMA刺激后,细胞释放至上清的cfDNA含量明显升高。痛风急性发作期组中性粒细胞经125,250,500 μg/ml尿酸盐诱导3 h,即可产生大量cfDNA,高于同一浓度下健康对照组(HC组)产生的cfDNA浓度,并且高于同一组内空白对照组(PBS组)的cfDNA浓度(P<0.01,见表2),该结果与免疫荧光染色结果一致(见图3)。

图1 流式细胞仪检测中性粒细胞纯度Figure 1 The purity of neutrophils detected by flow cytometry
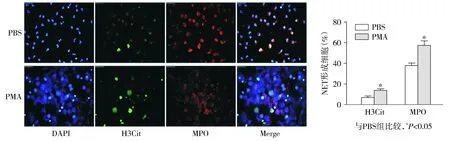
A.免疫荧光显微镜评估NETs (×400)B.NETs形成细胞的百分比图2 荧光显微镜鉴定NETs形成Figure 2 NETs formation identified by fluorescence microscopy

表2 痛风患者与健康对照细胞上清液cfDNA浓度的比较 (ng/ml)

图3 痛风患者与健康对照中性粒细胞对不同诱导剂的反应Figure 3 Neutrophil response to various inducers in patients with gout and healthy controls
2.4 急性发作期痛风患者NETs水平与临床特征的相关性分析
痛风急性发作期患者血浆中cfDNA和NE水平具有很强的正相关性(r=0.762,P<0.01)。痛风急性发作期患者血浆cfDNA和NE浓度与患者的年龄、BMI无相关性(P>0.05,见表3)。在患者的常规生化指标中,仅甘油三酯与cfDNA呈现出弱相关性(r=0.277,P<0.05)。血尿酸水平与cfDNA呈显著强正相关性(r=0.612,P<0.01),与NE水平呈中等程度正相关性(r=0.564,P<0.01)。在3个病情评价指标中,GAS和GIS与患者的NETs水平呈现出明显的强正相关性(r>0.6)。临床中常用到非特异炎症评价指标,血沉与NETs水平显示出中等程度相关(r>0.4),C反应蛋白呈现弱相关(r>0.2)。以上结果的差异均具有显著的统计学意义(P<0.05,见表3)。
2.5 急性发作期与发作缓解期NETs水平的差异
痛风急性发作期患者56例经相关治疗后1月,收集其外周血,检测cfDNA和NE水平,再次复查相关指标,构成前后对照。与急性发作期比较,缓解期除低密度脂蛋白外,各项指标均有显著改善,甘油三酯、血尿酸水平、炎性指标、病情评价指标和循环NETs浓度明显下降(P<0.05,见表4)。
为了进一步研究痛风患者血浆NETs水平与病情的相关性,我们对上述指标的变化值(Δ值)进行相关性分析。在SPSS软件中,将每位患者急性发作期的单项数值减去缓解期的数值,定义为该患者该项指标的变化值(Δ值)。

表3 痛风急性发作期患者NETs水平与临床指标的相关性分析
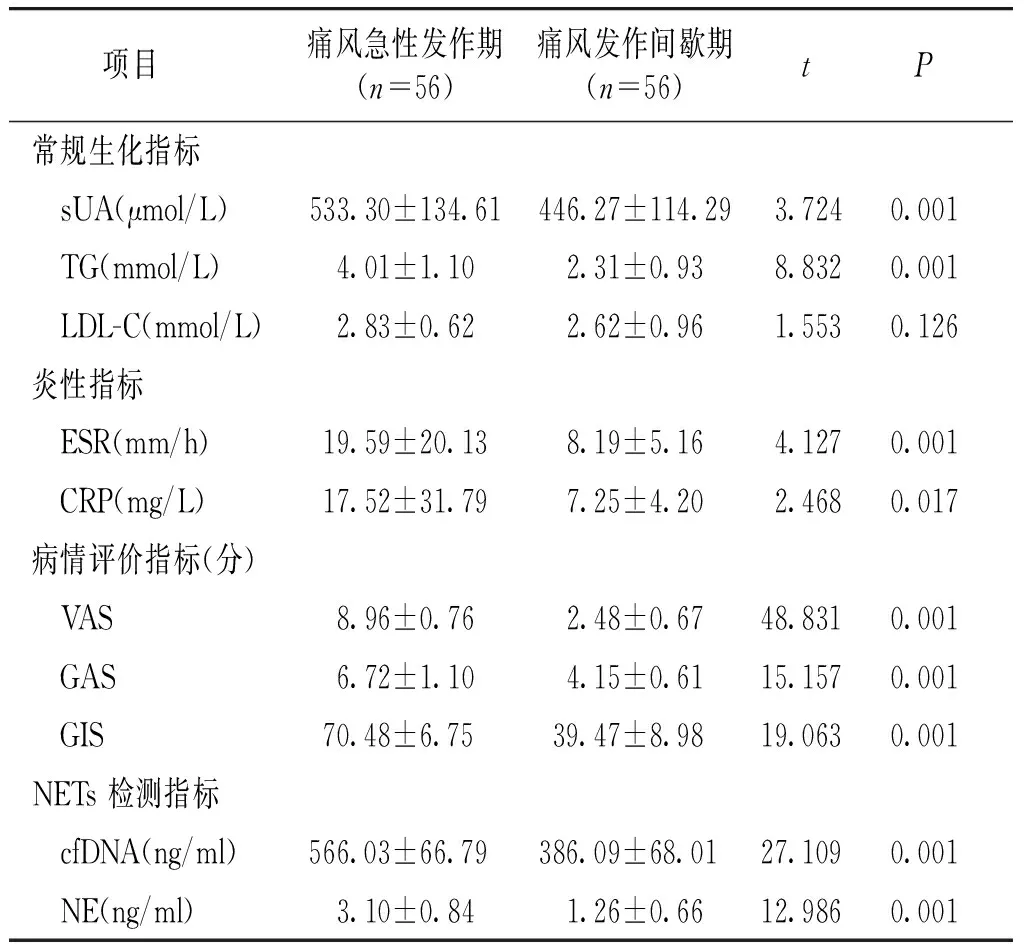
表4 急性发作期与发作缓解期临床特征的比较
每项指标Δ值之间做Pearson相关分析,结果见表5。痛风病情评价指标中,△GAS与血浆NETs的变化(ΔDNA,ΔNE)显示中等程度的正相关性(r>0.5,P<0.01)。ΔCRP与ΔESR未显示出与病情评价指标变化值之间明确的相关性,但二者之间存在中等程度正相关性(r=0.565,P<0.01)。ΔsUA与ΔGAS之间存在中等程度正相关性(r=0.580,P<0.01)。
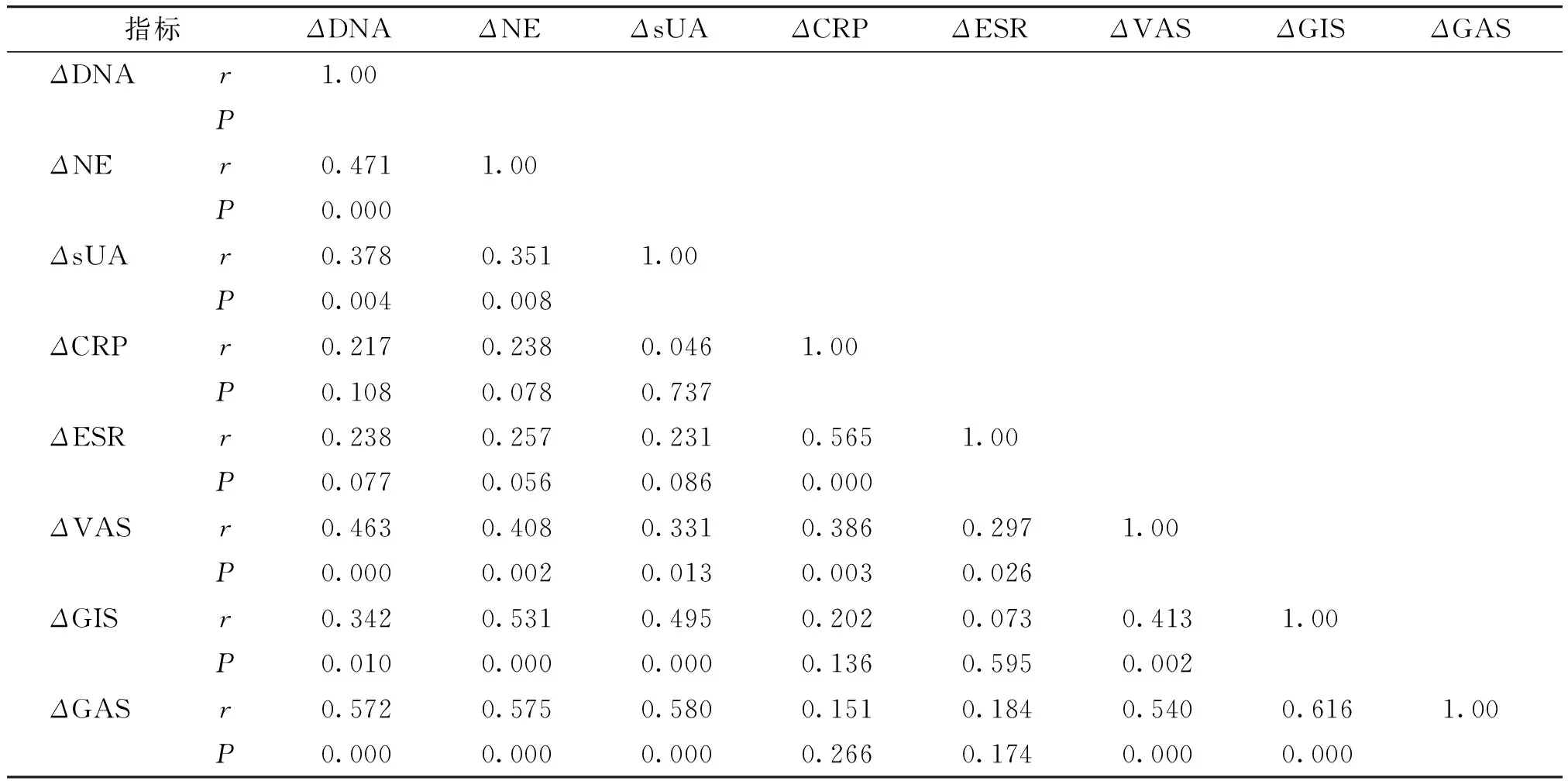
表5 观测指标值的相关性分析
3 讨论
研究表明,急性痛风性关节炎发作时,MSU晶体可诱导大量的炎症细胞(包括中性粒细胞和单核细胞)募集、浸润于晶体沉积部[10]。这些免疫细胞释放的IL-1进一步激活促炎细胞因子和趋化因子的释放,如IL-8、IL-6和CXCL8,上调内皮细胞表面的选择素和整合素,进一步增强中性粒细胞的募集。此外,MSU晶体还可激活局部浸润的PMNs,诱导其解离cfDNA,释放NE、MPO及胞浆蛋白,形成NETs[14,15]。本研究通过MSU体外诱导NETs生成实验证实痛风急性发作期患者的中性粒细胞对MSU的敏感性较健康对照、痛风缓解期患者的高,且NETs水平与疾病活动度、病情严重程度呈正相关性。
首先,通过比较痛风组和HC组的基线情况,发现两组在一般情况(年龄、性别和BMI)与常规生化指标(血糖和低密度脂蛋白)的差异均无统计学意义,而痛风组的尿酸显著高于HC组,表明两组样本具有代表性和可比性。其次,本研究利用目前国际上主流的、可靠的免疫荧光法鉴定NETs结构[16],在不同浓度梯度的MSU诱导下,痛风组的中性粒细胞较HC组产生更高浓度的cfDNA和NE,提示痛风急性发作期患者的中性粒细胞对MSU诱导产生的NETs更敏感[17]。结合临床现象,部分患者的血尿酸水平持续性或波动性升高,但未发生痛风,从高尿酸血症发展至痛风可长达数年至数十年,且有部分患者并不发生急性痛风性关节炎,称为“无症状高尿酸血症”[18]。根据本文的研究结果,可推测发生痛风患者的中性粒细胞可能在先天、后天因素的累积影响下发生缺陷,增加其对MSU的敏感性,诱导NETs的大量生成,从而导致痛风的急性发作[19]。这与既往研究结果一致[20],即体外MSU能诱导循环中性粒细胞NETs的形成。其具体机制目前尚未明确,一个假说认为关节局部的MSU小晶体可进入外周循环,活化中性粒细胞而导致NETs的形成[7];亦有可能局部炎症触发全身炎症状态,在没有MSU直接刺激下启动中性粒细胞的活化和NETs的形成。
另外,本研究发现痛风急性发作期患者外周血中NETs水平与病情活动度(GAS评分)和病情严重程度(GIS评分)呈正相关性,揭示NETs水平可用于痛风病情严重程度的评价。这符合NETs为广义的致病性DNA复合物的定义,机体的炎症状态与NETs水平相关。然而Vedder等[21]发现cfDNA水平与痛风患者疾病活动或炎症标志物无关,有可能与该研究对痛风病情活动和严重程度的评分工具与本研究不同,且该研究直接检测的循环cfDNA而不是体外MSU诱导的cfDNA水平。
在对急性发作期组和缓解组的NETs分析时,可发现缓解组的非特异炎性指标、血尿酸水平、NETs水平、病情的活动性和严重程度均较急性发作期组明显降低,提示目前的痛风急性期治疗方案可有效控制病情,使疾病进入缓解期。在各项指标变化值(值)的相关性分析中,仅有GAS与GIS之间具有高度相关性(r>0.6,P<0.01),提示GAS和GIS评分较为稳定。而GAS与NETs之间具有中等程度的相关性(r>0.5,P<0.01),说明患者外周血NETs水平在评价疾病严重程度方面稳定性较好。
本研究具有一定的局限性。首先,本研究纳入的研究对象均为男性,结果可能由性别带来的差异而产生偏倚。其次,本实验并未对高尿酸血症患者和痛风患者之间的NETs水平差异进行深入研究。最后,由于本研究检测的NETs指标(包括cfDNA和NE)均为体外MSU诱导下进行,未能阐释机体真实的循环NETs水平,对未来的临床应用仍需更多的研究支持。

