弓形虫急性感染小鼠肺组织的转录组分析
曹纹侨,李 锴,喻 云,谭青青,陆 合,2,张 静,2
刚地弓形虫是一种专性细胞内寄生的机会性致病原虫,可感染几乎所有恒温动物[1],全球约1/3的人口感染弓形虫[2]。机体的免疫状态和弓形虫感染的结局密切相关。免疫力正常的人群中,弓形虫感染多为隐性感染。但是免疫力低下或免疫力受损患者的弓形虫隐性感染可以被激活,从而引起严重的弓形虫病(toxoplasmosis)。由于弓形虫在全世界范围内的高感染率以及近年来艾滋病等的流行,使弓形虫病严重威胁到特殊人群的健康。
肺部为弓形虫病最常累及的器官之一[3]。弓形虫肺炎(Toxoplasmapneumonia)是由刚地弓形虫引起的肺部感染,是一种非典型肺炎。1963年Ludldam等[4]报道了9例肺部感染病例,其中6例为弓形虫性肺炎。弓形虫肺炎的病理表现有间质性肺炎、坏死性肺炎、肺实变和胸腔积液[5]。由于该病发展迅速,病情严重,病死率高,临床无特异表现,所以常常被误诊和漏诊,从而使患者失去有效的治疗。
已知细胞因子和细胞因子受体在宿主抗弓形虫免疫当中发挥重要作用,如IFN-γ[6]、IL-18[7]、CCL2[8]、CCR5[9]等。但是弓形虫感染肺组织后,哪些细胞因子发生了变化并影响了肺炎的发生发展目前还不明确。本研究利用高通量转录组测序和生物信息学分析,比较了感染弓形虫前后小鼠肺组织转录组的变化。通过分析筛选到两条与细胞因子相关的通路:Cytokine-cytokine receptor interaction 和Chemokine singnaling pathway信号通路。从这两条通路中显著富集的24个基因中筛选得到10个关键驱动基因,它们均是胞因子或细胞因子受体。这些关键驱动基因有望为弓形虫肺炎的诊断和治疗提供新的靶标。
1 材料与方法
1.1 材 料
1.1.1刚地弓形虫和小鼠 刚地弓形虫RH株为本实验室连续传代培养,纯化收集并保存在液氮中。BALB/c小鼠购自湖南斯莱克景达实验动物有限公司,合格证号:SCXK(湘)2019-0004。
1.1.2主要试剂和仪器 TRIZOL,美国Invitrogen 公司生产。三氯甲烷,异戊醇,异丙醇,中国西陇化工生产。DNA提取试剂盒,中国天根生化科技(北京)有限公司生产。荧光定量PCR试剂盒,中国宝生物工程(大连)有限公司生产。BGISEQ-500平台,中国华大基因生产。Bio Rad CFX96 Real-time PCR Detection system,美国伯乐公司生产。
1.2 方 法
1.2.1急性弓形虫感染小鼠模型的构建及肺组织样本采集 BALB/c小鼠6只,雌性,8周,随机分为两组,每组3只。按腹腔注射弓形虫速殖子的方法构建急性弓形虫感染小鼠模型。实验组每只小鼠接种含800个速殖子的弓形虫悬液0.2 mL,对照组注射生理盐水0.2 mL。当小鼠出现典型弓形虫感染症状时,处死小鼠。在无尽可能外源性RNA酶和DNA酶条件下,迅速取出小鼠肺组织,在生理盐水中快速洗去血液,将组织剪成黄豆大小,立即放进液氮中冻存备用。取实验组和对照组小鼠肺组织提取DNA,根据文献[10]获得弓形虫B1基因引物序列,F:5′-TCTTTAAAGCGTTCGTGGTC-3′, R:5′-GGAACTGCATCCGTTCATGAG-3′,从小鼠肺组织DNA中扩增长度为194 bp的弓形虫B1基因片段,验证弓形虫感染小鼠模型是否构建成功。
1.2.2总RNA提取 取实验组和对照组小鼠肺组织,每份样品约50 mg,在液氮保护下将肺组织研磨成粉末,采用TRIZOL-Reagent按照说明书操作提取小鼠肺组织总RNA。采用Fragment analyzer检测总RNA浓度和RNA的完整性指标:28s/18s和 RNA 质量指数(RNA quality number,RQN)。
1.2.3mRNA纯化分离及cDNA文库构建 取消化的总 RNA样品,适温变性打开其二级结构,使用oligo(dT)磁珠富集mRNA。在mRNA中加入打断试剂,将mRNA片段化。以片段化后的mRNA为模板,依次合成第一链cDNA和二链cDNA。配制反应体系,修复双链cDNA末端,并在3′末端加上A碱基,配制接头连接反应体系,使接头与cDNA连接。配制PCR反应体系,对连接产物进行扩增,并回收产物。将PCR产物变性为单链,配制环化反应体系,得到单链环形产物,消化掉未被环化的线性DNA分子,得到最终的文库。
1.2.4文库质检和高通量测序 使用Agilent 2100 Bioanalyzer 检测cDNA文库的片段大小及浓度。质检合格后,单链环状DNA分子通过滚环复制,形成一个包含200多个拷贝的DNA纳米球(DNB)将得到的DNBs采用高密度DNA纳米芯片技术,加到芯片上的网状小孔内。采用BGISEQ-500测序平台,通过联合探针锚定聚合技术(cPAS)进行测序,得到150 bp的测序读长。
1.2.5差异表达基因的筛选和功能分析 为保证结果的可靠性,在数据分析之前,使用SOAP2[11]将Raw reads过滤得到Clean reads。Clean reads的低质量碱基序列不超过20%,接头污染序列不超过5%,未知N含量过高序列不超过5%。使用HISAT2(v2.0.4)[12]将Clean reads比对到小鼠参考基因组(nm10)。使用Bowtie2(v2.2.5)[13]将Clean reads比对到参考编码基因集,使用RSEM(v1.212)[14]计算基因的表达水平。使用DESeq2(v1.4.5)[15],以|Log2fold change|≥3,Q value(adjusted p value)<0.01的标准筛选差异表达基因。使用Heat map builder[16]绘制差异基因表达量聚类热图。对差异表达基因进行GO富集分析、KEGG富集分析和KDA分析,差异显著性阈值设定为Q value<0.05。
1.2.6差异表达基因实时荧光定量PCR验证 取步骤1.2.2提取的小鼠肺组织总RNA,将其逆转录为cDNA,以cDNA为模板进行实时荧光定量PCR,引物见表1。实时荧光定量PCR反应体系构成:TB Green Premix Ex TaqⅡ(2×) 12.5 μL、上下游引物各1 μL(终浓度为0.4 μmol/L)、cDNA模板2 μL、去离子水8.5 μL。扩增循环参数:预变性95 ℃ 30 s;变性95 ℃ 5 s,退火60 ℃ 30 s,共39个循环;95 ℃ 10 s,熔解曲线:从65 ℃到95 ℃每次增加0.5 ℃。以2-△△CT计算基因的相对表达量。采用SPSS 19.0统计分析数据,两独立样本t检验,P<0.05为差异有统计学意义。
2 结 果
2.1成功构建弓形虫急性肺部感染小鼠模型 实验组小鼠在接种弓形虫后第5 d出现典型的弓形虫感染症状:颤抖,竖毛,弓背,活动量减少。实验组小鼠腹部隆起,取出的腹水中观察到大量弓形虫速殖子。弓形虫B1基因扩增的目的片段长度为194 bp,实验组小鼠肺组织均检测到弓形虫B1基因片段(图1)。
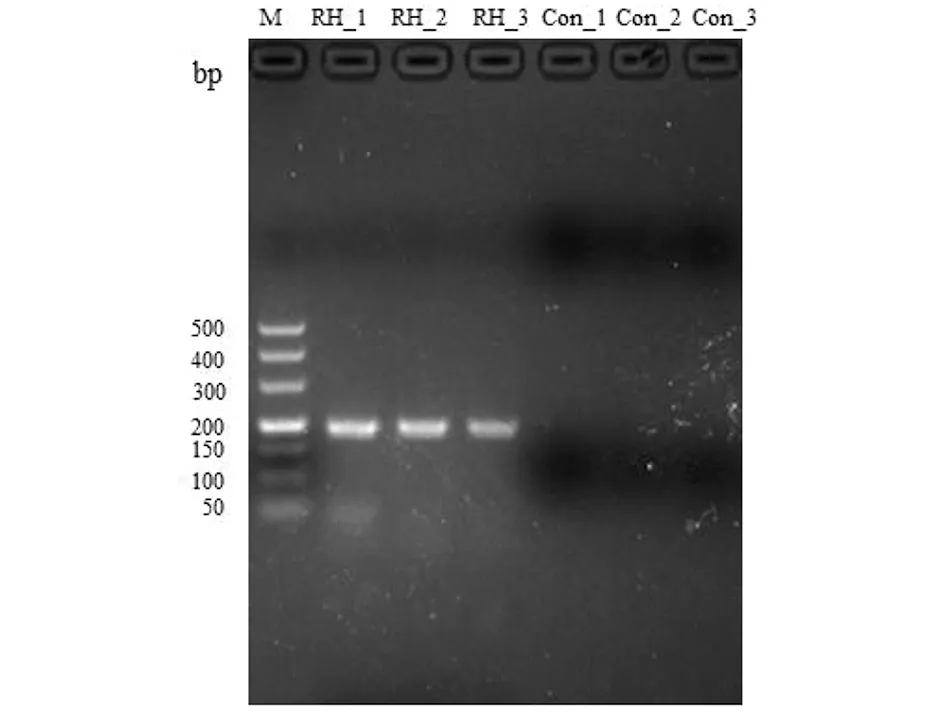
M:Maker; RH_1、RH_2、RH_3为实验组,Con_1、Con_2、Con_3为对照组。图1 小鼠肺组织弓形虫B1基因检测Fig.1 Detection of the T.gondii B1 gene in lungs of mice
2.2测序结果 所有样本RQN均>8,28 s/18 s均大于1.4,所有样本浓度均大于120 ng/μL(表2)。BGISEQ-500测序平台一共检测了6个样本,平均每个样本产出Clean reads数为45.51G,总共检测到17 828个基因。Clean reads比对到小鼠参考基因组的平均比对率为94.39%,唯一比对到小鼠参考基因组的平均比对率为85.70%。Clean reads Q20在96.86%~97.34%,Clean reads Q30在88.57%~89.94%,分别代表碱基正确识别率在90%和99.9%的碱基占总体碱基的百分比(表3)。

表1 qPCR验证基因引物Tab.1 Primers used for qPCR validation
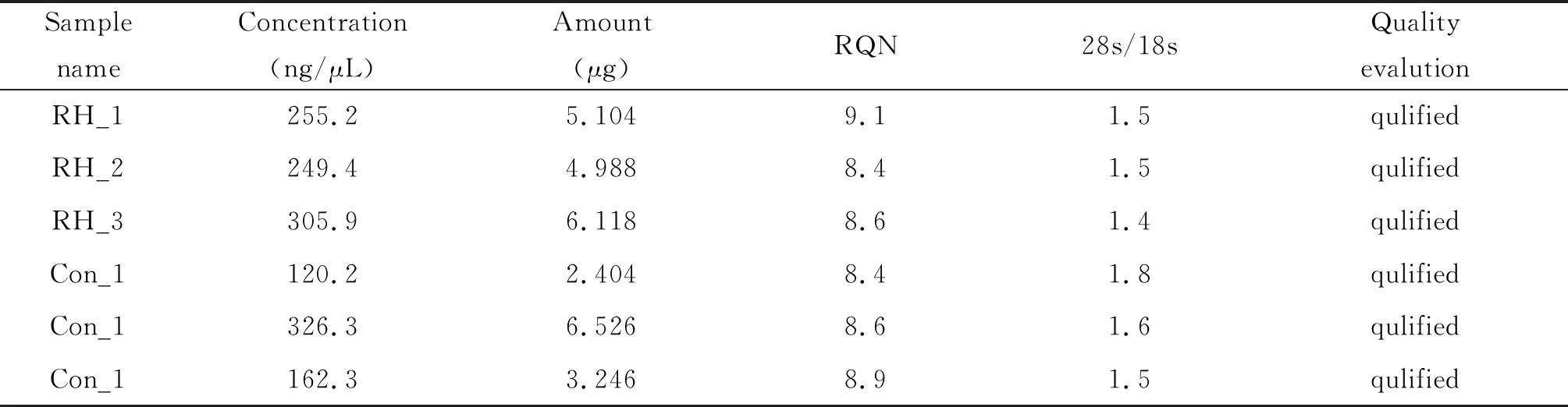
表2 总RNA质量检测Tab.2 Examination of total RNA quality

表3 高通量测序数据质量 Tab.3 High throughput RNA-seq data quality
2.3差异表达基因筛选和功能分析 根据设定的筛选条件(|Log2FC|≥3,Q value<0.01)总共挖掘到286个差异表达基因,其中上调基因234个,下调基因52个。从差异基因表达量聚类热图(图2)可以看出大部分基因和免疫系统、信号分子相互作用以及信号转导有关。说明与免疫相关的基因在宿主抵抗弓形虫感染时发挥了重要作用。

图2 总差异表达基因的表达量聚类热图Fig.2 Cluster analysis heat map of all DEGs
差异表达基因的GO注释分为生物过程(Biological process, BP)、细胞组分(Cellular component, CC)和分子功能(Molecular function, MF),每个分类下的Top 20 GO术语见图3。在每个分类的TOP 20术语中,CC下显著富集的术语有15个,MF和BP下的TOP20术语全部显著富集,(Q value<0.05即视为显著富集)。从分析结果可知,BP下的术语大多数和免疫相关如:免疫应答(immune response)、免疫系统过程(immune system process)、防御应答(defense response)、固有免疫应答(innate immune response)、炎症应答(inflammatory response)等。而MF下的术语大多数和细胞因子以及GTP酶相关,如:细胞因子活性(cytokine activity)、趋化因子活性(chemokine activity)、趋化因子受体活性(chemokine receptor activity)、CXCR3趋化因子受体结合(CXCR3 chemokine receptor binding)、CCR趋化因子受体结合(CCR chemokine receptor binding)、C-C 趋化因子结合(C-C chemokine binding)、C-C趋化因子受体活性(C-C chemokine receptor activity)、GTP酶活性(GTPase activity)、GTP结合(GTP binding)。
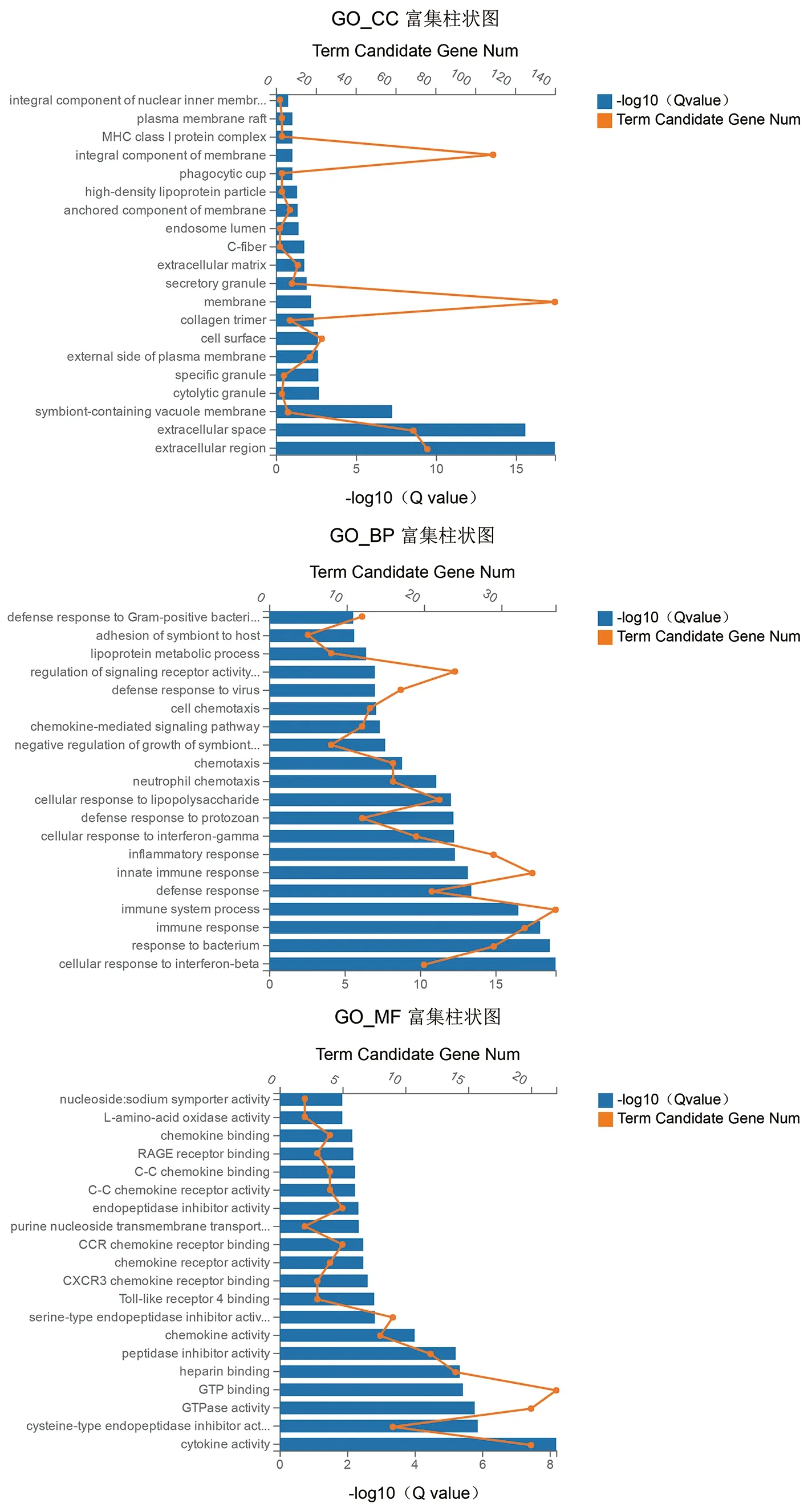
图3 GO富集分析柱状图Fig.3 GO enrichment analysis histogram
差异表达基因的KEGG富集分析结果(图4)显示,在TOP20 KEGG信号通路中显著富集的通路有13条。在小鼠肺组织中,弓形虫感染影响最显著的通路为细胞因子-细胞因子受体相互作用通路(Cytokine-cytokine receptor interaction)。综合GO和KEGG富集分析的结果,我们发现大多数改变的KEGG通路和GO条目都和免疫相关,其中特别是细胞因子和趋化因子所占比重较大。大量研究表明细胞因子和弓形虫感染存在密切的关系,同时趋化因子是细胞因子成员之一,因此我们选择了Cytokine-cytokine receptor interaction和Chemokine signaling pathway中显著富集的24个差异表达基因进行KDA分析。

图4 KEGG通路富集分析柱状图Fig.4 KEGG pathway enrichment analysis histogram
24个差异表达基因可以分为3个聚类:显著升高、升高和降低,表达量聚类热图见图5。其中绝大多数差异表达基因被上调,而表达降低的细胞因子只有4个,分别是Gng8、Adcy1、Gdf10和Ackr4。接下来,对这24个差异表达基因进行KDA分析(图6),用以在复杂的关系网络里找出起关键作用的基因,通过分析最终筛选出10个关键驱动基因,分别是Tnf、Cxcl10、Il10、Ccl2、Ifng、Cxcl9、Ccr5、Ccl4、Cxcr2和Ccl7,且都上调表达。
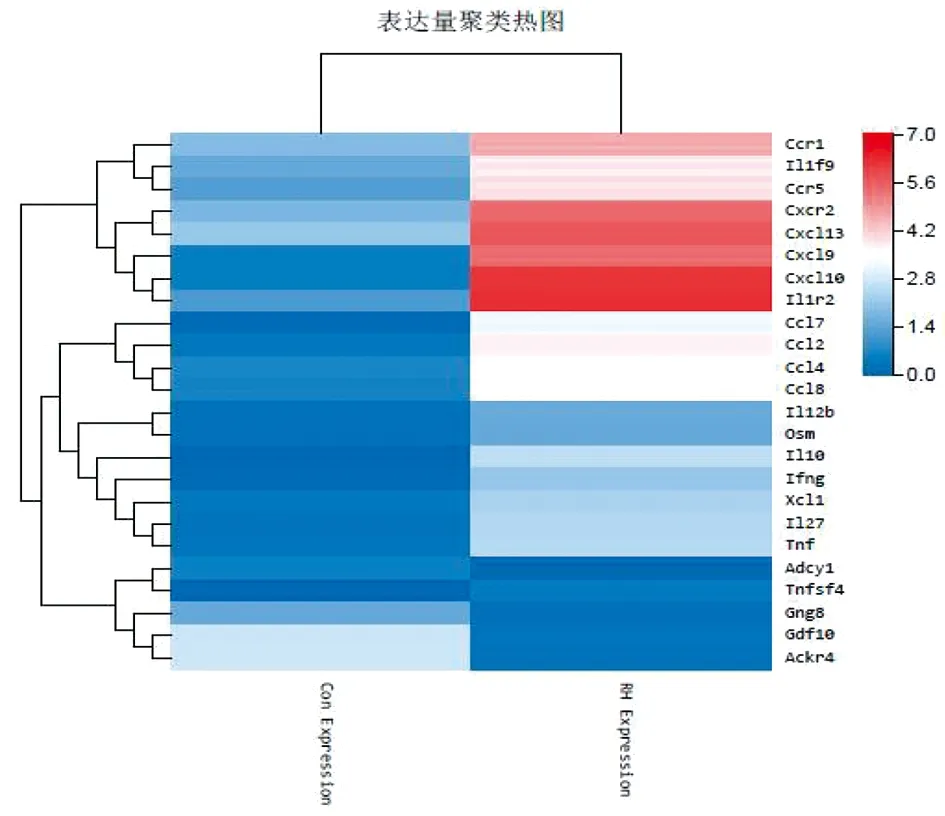
图5 24个差异表达基因的表达量聚类热图Fig.5 Cluster analysis heat map of the 24 DEGs
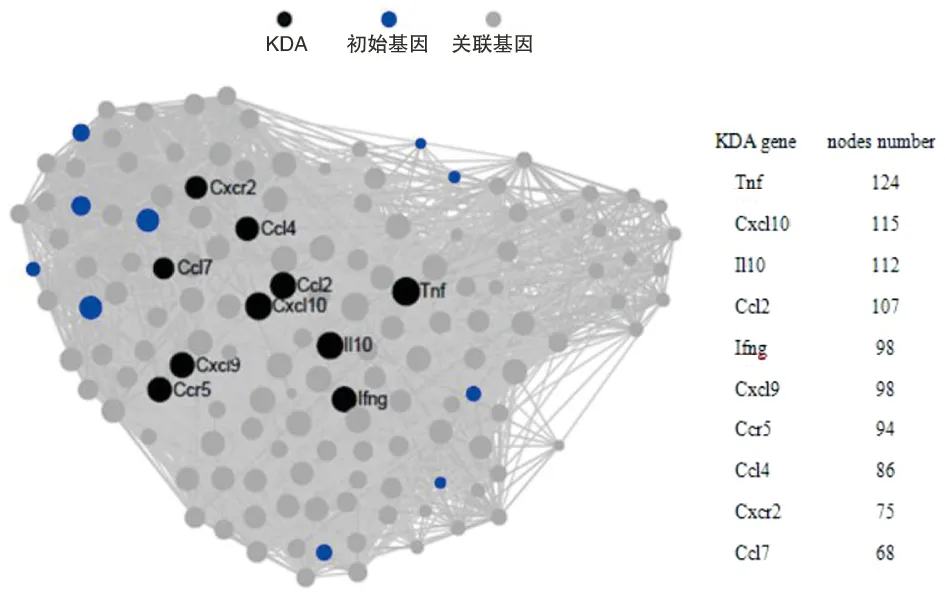
注:圆圈的大小代表该基因与其他基因的连接数(nodes number),圆圈越大表示连接数越多,该基因起到的作用越关键。图6 24个差异表达基因的KDA分析Fig.6 KDA analysis of the 24 DEGs
2.4实时荧光定量PCR验证差异表达基因 从286个差异表达基因中随机选择10个基因用于qPCR验证,其中8个为上调基因,2个为下调基因。qPCR数据经统计学分析,P值均小于0.05实验组和对照组基因的相对表达量差异具有统计学意义。结果表明qPCR和RNA-seq结果具有一致性,说明转录组测序结果可靠(图7)。
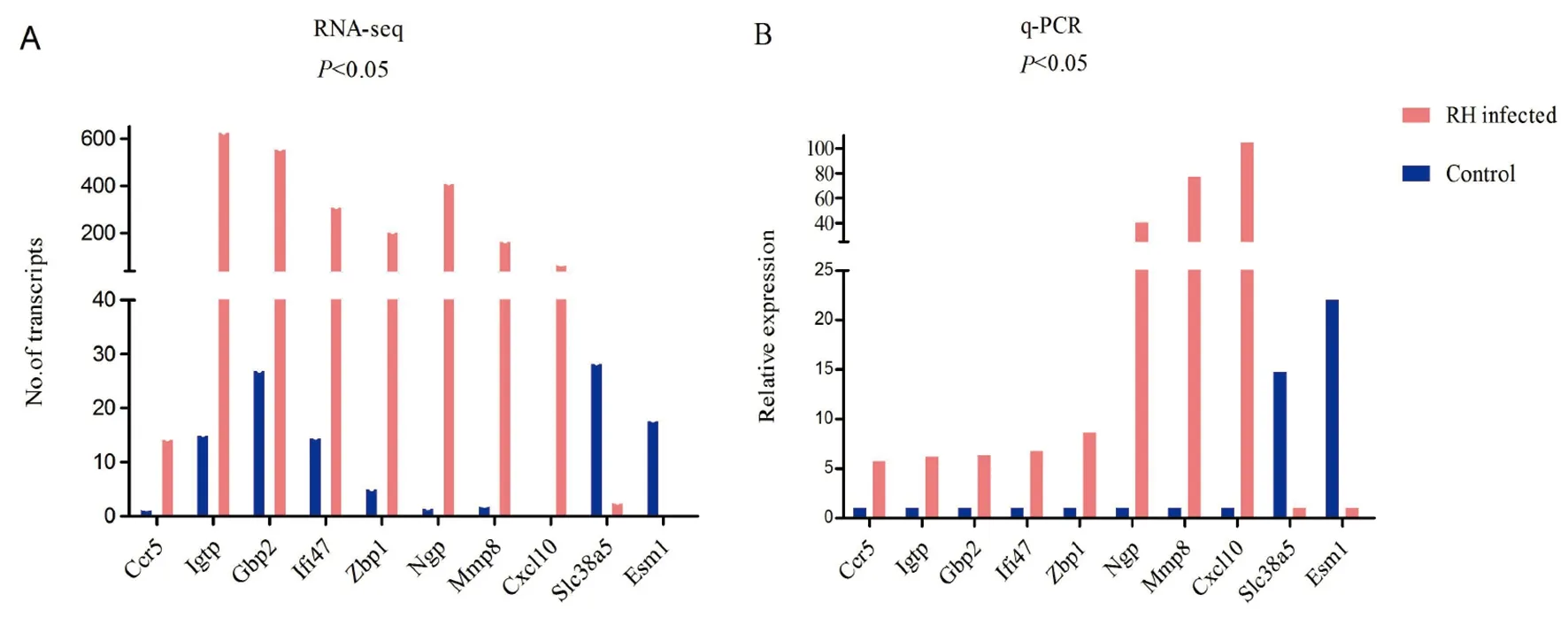
A为RNA-seq转录水平;B为qPCR相对表达量 图7 差异表达基因qPCR验证Fig.7 Identification of DEGs by qPCR
3 讨 论
细胞因子是可溶性的细胞外蛋白或糖蛋白,它们通过与目标细胞表面的特定受体结合从而发挥作用,参与先天性和适应性炎症免疫应答、细胞生长、分化、死亡等过程。本研究将细胞因子与细胞因子受体互作和趋化因子信号通路下共24个差异表达基因进行了KDA分析,筛选得到10个关键驱动基因:Tnf(Tnfa)、Cxcl10、Il10、Ccl2、Ifng、Cxcl9、Ccr5、Ccl4、Cxcr2和Ccl7,它们在弓形虫感染小鼠的肺组中均上调表达。
弓形虫感染引起Th1型免疫应答,并伴随大量促炎性细胞因子的释放,如:TNF-α和IFN-γ[17]。在本研究中TNF-α和IFN-γ均上调表达,同时还是关键驱动基因。在急性弓形虫感染时,TNF-α可以协同IFN-γ发挥抗弓形虫作用,IFN-γ也可以诱导TNF-α的释放。IFN-γ是抵抗弓形虫感染的主要的介导者[6]。在小鼠,IFN-γ可以诱导GTPases家族的IRGs和GBPs合成,IRGs和GBPs可以破坏弓形虫纳虫泡膜(PVM)[18-20],使弓形虫暴露于宿主免疫系统并将其杀死。小鼠GBPs家族含有11个成员,Gbp1-Gbp11,在本实验中除Gbp9、Gbp11外,其他基因均显著上调,而IRGs家族成员则全部显著上调。在感染弓形虫的小鼠肺组织中,IFN-γ诱导表达的GBPs和IRGs家族成员发生了显著上调,由此说明弓形虫RH株感染的小鼠肺组织中,GBPs和IRGs可能是IFN-γ诱导的主要抗弓形虫效应分子。
在本研究中,显著差异表达的趋化因子和趋化因子受体主要来自于CXC亚家族、CC亚家族以及其对应的受体家族。其中,Cxcl9、Cxcl10属于CXC亚家族,Ccl2、Ccl4和Ccl7属于CC亚家族,Cxcr2属于CXC亚家族受体,Ccr5属于CC亚家族受体。Cxcl9和Cxcl10可在IFN-γ的诱导下大量表达,两者的受体都是Cxcr3。在GO 富集分析的MF板块,Cxcr3受体结合(Cxcr3 chemokine receptor binding)被显著富集到。在弓形虫慢性感染的小鼠脑组织中,Cxcl9和Cxcl10的水平显著升高[21],Cxcl9可以募集T细胞到感染灶,从而阻断慢性感染被激活[22]。在小鼠弓形虫眼病模型中Cxcl10是维持T细胞免疫应答的重要细胞因子[23]。同时在弓形虫感染的人血清以及猪器官中Cxcl9、Cxcl10也显著升高[24-25]。由此可见,在弓形虫感染后的大多数哺乳动物体中Cxcl9、Cxcl10都会上调表达,发挥募集T细胞和维持T细胞免疫应答的作用。Ccl2和Ccl7具有趋化单核细胞到达感染灶以清除外来病原生物的作用。有研究表明,人外周血单个核细胞感染弓形虫后,转录组测序发现Ccl2显著上调,同时检测到Ccl2大量合成和释放[8]。虽然目前暂无Ccl7与弓形虫相关的研究,但是小鼠若缺陷Ccl7的受体Ccr1,小鼠对弓形虫的易感性和死亡率都会增加[26]。Cxcr2和Ccr5作为10个关键驱动基因中仅有的2个趋化因子受体基因,大量的研究表明它们发挥了重要的抗弓形虫效应。Cxcr2缺陷小鼠,在急性弓形虫感染早期,腹腔中性粒细胞显著减少;在慢性感染时则脑组织包囊显著增加,同时小鼠体内促炎性细胞因子IFN-γ、TNF-α水平也显著降低[27]。Ccl4是Ccr5的天然配体之一,在本研究中CD4、CD5均为关键驱动基因。NK细胞是弓形虫感染早期IFN-γ的主要来源,而Ccr5是NK细胞表面发挥趋化NK细胞到感染灶的主要趋化因子受体。在Ccr5基因缺陷的小鼠体内,弓形虫感染灶周围的NK细胞显著减少,体内虫荷量增加,肠道和肝脏损伤加重,另外还出现了严重的脂肪代谢紊乱,最终导致小鼠死于虫血症[28]。
弓形虫感染宿主后诱导机体释放了大量的促炎细胞因子,产生了强烈的免疫反应,但是大量的炎性细胞因子可以造成组织和器官严重的病理损伤。此时机体会释放许多的抗炎性细胞因子如IL-10、IL-27和TGF-β,以维持体内的免疫平衡。IL-10缺陷小鼠因不能中和IFN-γ引起的炎性作用,在急性感染期常由于严重的组织病理损伤而死亡[29]。在本研究中IL-10显著上调表达,同时还是关键驱动基因,说明IL-10可能是弓形虫肺部感染负调控的主要效应分子。
在弓形虫感染的小鼠肺组织中,众多与免疫相关的基因发生了上调,其中细胞因子和细胞因子受体变化最为显著。本研究通过生物信息学分析,从Cytokine-cytokine receptor interaction和Chemokine signaling pathway 2条通路中,筛选到10个关键驱动基因:Tnf、Cxcl10、Il10、Ccl2、Ifng、Cxcl9、Ccr5、Ccl4、Cxcr2和Ccl7,这些基因在弓形虫感染肺组织中的作用还有待进一步深入研究。
利益冲突:无

