腹腔镜辅助经肛全直肠系膜切除术后患者排便及排尿功能的影响因素分析
赵伟伟,孙清森,孟小晶
(沧州市人民医院胃肠疝外科,河北 沧州,061000)
低位直肠癌病灶解剖位置特殊,在部分患者如肥胖、盆腔狭窄者,保肛手术难度较大,腹腔镜经肛全直肠系膜切除术(transanal total mesorectal excision,TaTME)的出现降低了全直肠系膜切除术的手术难度[1],TaTME术后通常采用超低位或低位吻合,加上术中对盆腔神经的损伤,对患者术后排便功能具有一定影响,尤其低位前切除综合征(low anterior resection syndrome,LARS)及排尿功能障碍的发生,对患者预后产生不良影响。有研究指出,低位直肠癌患者围术期的放化疗不论是长程放化疗抑或短程放疗均会影响术后排便及排尿功能[2-3]。2016年10月至2017年10月我院经腹腔镜TaTME治疗85例低位直肠癌患者,现将其临床资料进行回顾性分析,以探讨影响患者术后排便及排尿功能的影响因素,现将结果报道如下。
1 资料与方法
1.1 临床资料 采用回顾性研究分析85例行腹腔镜TaTME低位直肠癌患者的临床资料。患者35~80岁,平均(60.3±11.4)岁;男43例,女42例;肿瘤TNM分期Ⅰ期40例,Ⅱ期11例,Ⅲ期34例;病理学分期T1~2期37例,T3期48例。纳入标准:(1)术前病理学检查确诊为直肠癌,且为黏液腺癌或腺癌;(2)肿瘤下缘距肛缘<5 cm;(3)术前CT/MRI确认肿瘤未侵及邻近器官且无远处转移;(4)患者签订知情同意书。排除标准:(1)术后肿瘤复发、远处转移;(2)术前肛门功能差或失禁;(3)拒绝随访填写问卷;(4)术前存在排尿功能障碍。本研究经本院伦理委员会批准。
1.2 方法
1.2.1 样本量计算方法 本研究根据低位直肠癌患者腹腔镜辅助TaTME术后患者排便及排尿功能影响因素数量进行样本的估计,根据多因素分析样本量估计的经验公式:样本量(N)=研究因素数量(n)×5~10倍,本研究纳入多因素分析的研究因素有8项,计算后可知需求的最小样本量为80例,根据本院实际情况及脱落情况,本研究共选取85例患者作为研究对象。
1.2.2 手术方法 患者均行腹腔镜TaTME治疗。(1)入室后患者取截石位,常规全麻、消毒术区,标记打孔点后采用五孔法建立气腹,主操作孔为患者右下腹的12 mm Trocar,观察孔为脐内10 mm Trocar,辅助操作孔为左腹、右腹3枚5 mm Trocar,充入CO2建立气腹,压力维持在14 mmHg。(2)建立气腹后常规进入腹腔探查,观察腹腔内有无腹水、脏器有无明显异常、肠系膜淋巴结有无明显肿大、肿瘤病灶部位是否位于腹膜返折下方无法视及。探查无明显异常后采用中央入路切开乙状结肠系膜后方腹膜融合部,下至直肠膀胱陷凹,彻底清扫肠系膜根部的淋巴结组织及脂肪组织,结扎肠系膜下静脉、动脉后切断,游离直肠系膜至盆底。游离Toldt间隙,用纱布覆盖生殖系统血管及输尿管,避免损伤;然后沿乙状结肠左侧根部腹膜融合部及降结肠旁侧沟切开,游离近端结肠。根据需要游离降结肠脾区,分离直肠时采用全系膜切除并延长至盆腔底部,与对侧游离面相会合。分离直肠前壁,离断邓氏筋膜后叶,充分分离直肠至齿状线水平。(3)会阴部充分消毒,充分扩肛后用稀释碘伏溶液冲洗直肠肠腔后放置Lone-Star肛门拉钩。对于肿瘤部位较低的患者,直视下环形切开直肠壁,并向上游离进入直肠内外括约肌间隙后放置经肛操作平台,余者直接放置平台;距肿瘤下缘1~2 cm处荷包缝合闭合肠腔,碘伏冲洗,连接灌注管道,维持气腹压力在14 mmHg,并连接压力缓冲装置。(4)经肛操作与腹腔镜操作汇合后根据肿瘤直径决定直肠残端的切除及运送方式,切除病灶手工吻合肠管后常规预防性末端回肠造口,术后3个月还纳。
1.2.3 新辅助放化疗 参考《中国结直肠癌诊疗规范(2019年版)》中关于结直肠癌新辅助放化疗的相关共识,对满足条件的患者进行新辅助放化疗。新辅助放化疗主要针对Ⅱ~Ⅲ期患者,本研究中45例患者接受术前放疗,放化疗结束后6~8周进行手术治疗。
1.3 观察指标及评价标准 观察指标:(1)手术及术后情况:术中出血量、术后吻合口距肛缘距离、肿瘤直径;(2)随访情况:术后1年时LARS发生率、排尿功能障碍发生率;(3)分析影响低位直肠癌患者腹腔镜TaTME术后排便及排尿功能的相关因素:性别、体质量指数、肿瘤直径、术后吻合口距肛缘距离、肿瘤T分期、肿瘤N分期、是否同步放化疗、术中出血量。评价标准:采用LARS量表评估术后1年排便功能[4],该量表包括5个独立条目(排气失禁、排便次数、稀便失禁、排便急迫感、里急后重感),根据症状程度或频率对每个条目赋予分值总分42分。0~20分:无LARS,肛门排便功能良好;21~29分:轻度LARS,患者有轻度的肛门排便功能障碍;30~42分:重度LARS,患者有重度的肛门排便功能障碍,分值越高表示患者症状越严重。内容效度指数为0.91,Cronbach α系数为0.82,具有较好的效度与信度。采用Saito等制作的分级方法对术后1年排尿功能进行评估[5],分为Ⅰ、Ⅱ、Ⅲ、Ⅳ四个等级,其中Ⅳ级(因尿潴留及尿失禁需进行导尿治疗)及Ⅲ级(残余尿量之差>50 mL)为排尿功能障碍。
1.4 统计学处理 采用SPSS 22.0软件进行数据分析,计量资料以均数±标准差表示,组间比较采用两独立样本t检验;计数资料以[n(%)]表示,组间比较采用χ2检验,单因素与多因素分析采用Logistic回归模型,P<0.05为差异有统计学意义。
2 结 果
2.1 手术及术后情况 85例低位直肠癌患者均成功完成腹腔镜TaTME,无中转开腹。术后随访12~24个月,平均(20.4±3.8)个月;术中出血量平均(69.4±27.1)mL,术后吻合口距肛缘距离平均(2.5±0.5)cm,肿瘤直径平均(3.9±1.6)cm。
2.2 随访结果 85例患者均完成术后随访,术后1年填写LARS量表并进行排尿功能评估。LARS发生率为43.53%(37/85),轻度LARS发生率为22.35%(19/85),重度21.18%(18/85)。无LARS组的LARS量表评分为(12.3±3.5)分,轻度LARS组的LARS量表评分为(24.6±4.8)分,重度LARS组的LARS量表评分为(38.3±6.2)分。排尿功能Ⅰ级54例(63.53%),Ⅱ级15例(17.65%),Ⅲ级12例(14.12%),Ⅳ4例(4.71%),排尿功能障碍16例(18.82%)。
2.3 低位直肠癌患者术后发生LARS及排尿功能障碍的单因素分析 单因素分析结果显示,术后吻合口距肛缘距离、肿瘤直径及同步放化疗是影响患者TaTME术后排便功能的相关因素(P<0.05),体质量指数、同步放化疗及术中出血量是排尿功能障碍发生的相关因素(P<0.05)。见表1。
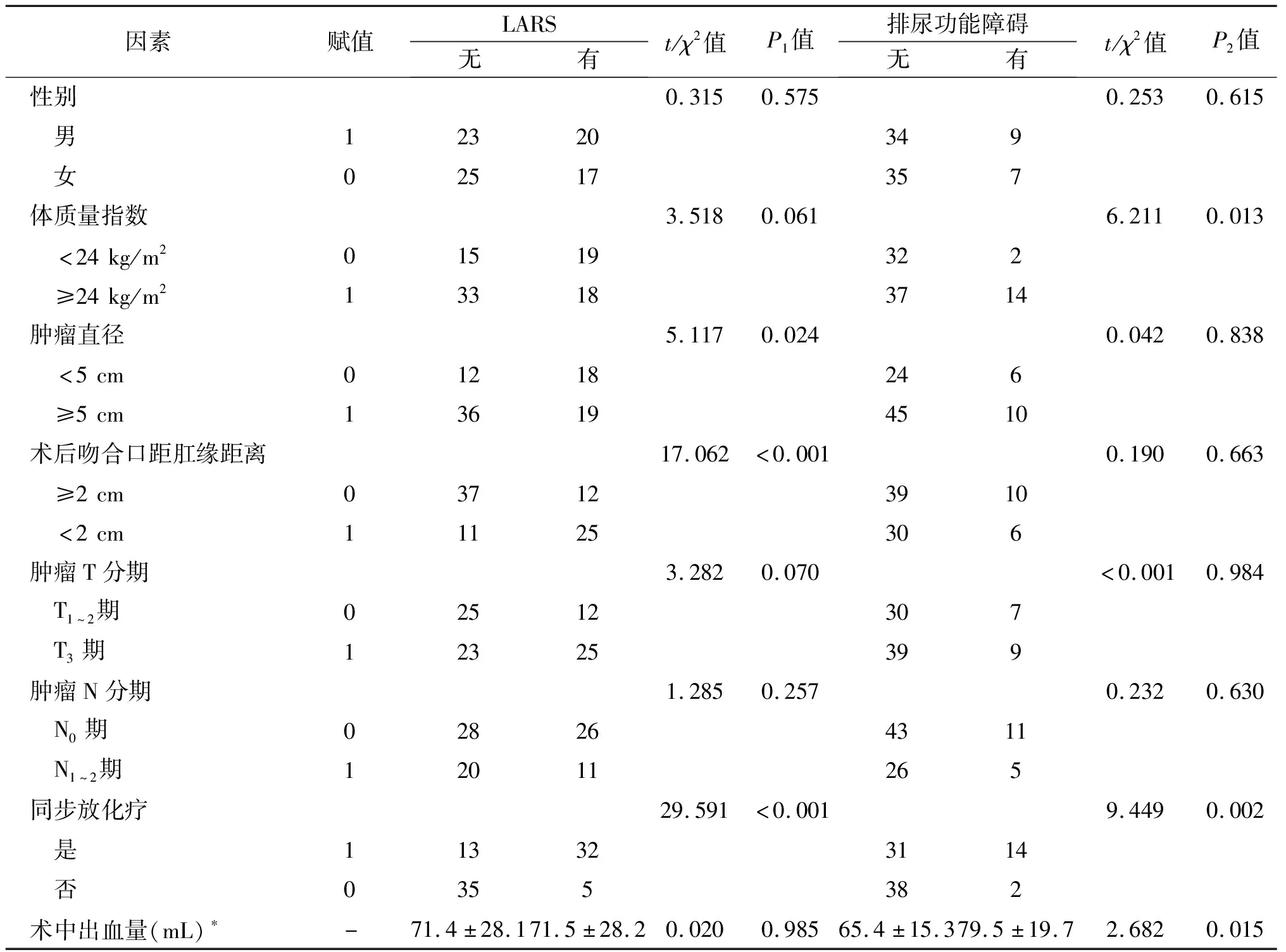
表1 低位直肠癌患者术后发生LARS及排尿功能障碍的单因素分析
2.4 低位直肠癌患者术后发生LARS的多因素分析 将表1中P1<0.05的变量作为自变量,是否发生LARS作为因变量(具体赋值见表1)进行多变量Logistic回归分析,结果显示,术后吻合口距肛缘<2 cm、同步放化疗是影响患者术后排便功能的独立危险因素(P<0.05)。见表2。
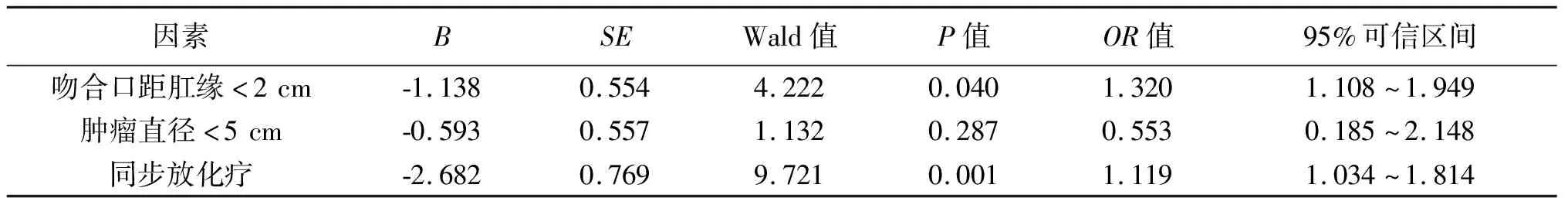
表2 低位直肠癌患者术后发生LARS的多因素分析
2.5 低位直肠癌患者术后发生排尿功能障碍的多因素分析 将表1中P2<0.1的变量作为自变量,是否发生排尿功能障碍作为因变量(具体赋值见表1)进行多变量Logistic回归分析,结果显示,术中出血量不是影响患者术后排尿功能障碍的独立危险因素,体质量指数≥24 kg/m2、同步放化疗是影响患者术后排尿功能的独立危险因素(P<0.05)。见表3。
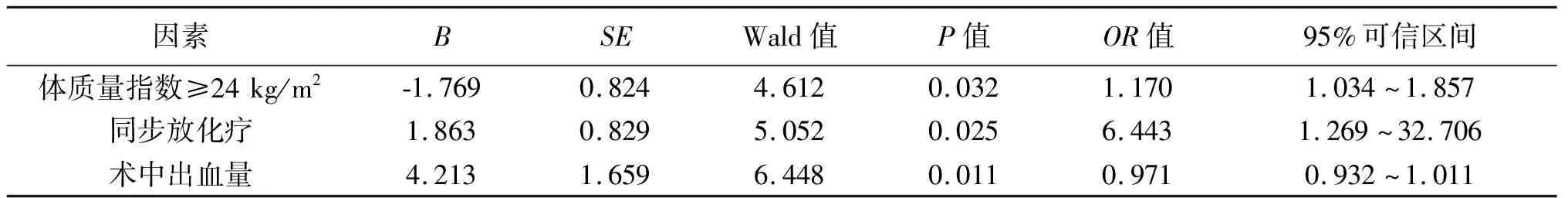
表3 低位直肠癌患者术后发生排尿功能障碍的多因素分析
3 讨 论
3.1 TaTME术后LARS与排尿功能障碍的发生情况 既往研究显示[6],低位直肠癌术后LARS发生率为64%~71%,排尿功能障碍发生率为40%~60%。随着低位直肠癌手术治疗方法、化疗方式及各种手术器械的推广使用,在低位直肠癌手术中保留盆腔自主神经已成为共识,腹腔镜TaTME降低了原本全直肠系膜切除术的手术难度,已在临床中普遍使用,多用于治疗低位及中位直肠癌,但术后仍有部分患者出现排尿及排便功能障碍。由于经肛放置操作台时需进行扩肛、游离直肠内外括约肌,消化道吻合时采用超低位或低位吻合,对患者排便及贮便功能产生严重影响,虽然提高了保肛率但也导致术后发生LARS的风险升高[7-8]。此外解剖层次不清、淋巴结清扫范围不当、出血及肥胖等原因造成的术野不清、手术区域炎症反应及吻合口漏、术后放疗等因素均可影响患者排尿功能,引起尿潴留等严重并发症。本研究采用了LARS量表对低位直肠癌患者术后排便功能进行评价,采用Saito等制作的分级方法对排尿功能进行评价,结果显示85例患者中37例术后发生LARS,发生率43.53%,其中18例为重度LARS,发生率为21.18%;重度LARS占全部LARS的48.65%(18/37);排尿功能障碍发生率为18.82%(16/85)。本研究中LARS、排尿功能障碍发生率与文献报道相似[9-10],但重度LARS占比略高于既往研究,考虑与本研究中样本量较小、患者构成比不同有关。
3.2 TaTME术后发生LARS、排尿功能障碍的因素分析 目前多项研究证实[11-12],LARS的发生主要与全直肠系膜切除术、肿瘤部位、术中操作损伤、同步放化疗等因素相关,而排尿功能障碍的发生与性别、盆腔神经损伤、手术方式(尤其Miles术)及术前排尿功能障碍有关,一般认为术前放疗可导致患者盆腔组织纤维化的同时引起盆腔神经脱髓鞘,对自主神经功能产生不良影响,增加术后LARS及排尿功能障碍的发生风险。有研究显示[13],采用新辅助放化疗时由于术前患者小肠蠕动度较术后更大,且术前小肠未坠入盆腔,因此放疗导致的不良反应发生风险更低。但有研究指出[12],结直肠癌患者进行新辅助放化疗后,LARS的发生风险升高,且新辅助放化疗是LARS发生的独立危险因素。而本研究单因素分析结果显示,同步放化疗是低位直肠癌TaTME术后排便功能及排尿功能的危险因素,分析后认为盆腔放疗可导致阴部神经、括约肌纤维化,降低了肌肉及神经对刺激的反应敏感程度,同时放疗还使盆腔神经脱髓鞘,影响自主神经功能。因此笔者认为放疗时应在保证足够照射的基础上保护肿瘤远侧肛管及部分内外括约肌,可使用神经营养性药物进行辅助治疗。目前已有研究表明[14-15],TaTME易致患者肛门括约肌损伤,同时经肛操作时间越长,盆底功能受损越重,术后风险越高。本研究结果显示,术中出血量与术后发生LARS无明显相关性,术后吻合口距肛缘距离、肿瘤直径与术后发生LARS相关。术中出血量、体质量指数与术后排尿功能障碍相关,术中出血量过大、肥胖可能引起术野能见度降低,导致损伤盆腔自主神经,进而引起术后排尿功能障碍。肿瘤直径越大说明对患者正常组织侵犯越多,手术切除时损伤范围更大。此外,肿瘤直径较大可造成手术部位空间狭窄[16],经肛荷包缝合时位置更低,游离直肠系膜下端时为保证固有筋膜完整导致盆底神经丛损伤,但肿瘤直径受术前影像学检查准确性、TNM分期等因素混淆,且术中造成的损伤可能在术后短时间内恢复完全,术中出血量可受术者经验、清扫范围等因素混淆,在矫正混淆因素后多因素分析结果显示肿瘤直径不是低位直肠癌患者术后发生LARS的独立危险因素,术中出血量亦非术后排尿功能障碍的独立危险因素。术后吻合口距肛缘距离越近,发生LARS的风险越高,距肛缘约2 cm处为齿状线所在位置,吻合口低于齿状线表明手术已损伤肛管,因此术后患者排便功能受损,多因素分析结果显示,吻合口距肛缘<2 cm是低位直肠癌术后发生LARS的独立危险因素。
综上所述,术后吻合口距肛缘<2 cm及同步放化疗是影响患者腹腔镜辅助TaTME术后排便功能的独立危险因素,体质量指数≥24 kg/m2及同步放化疗是腹腔镜辅助TaTME术后排尿功能障碍的独立危险因素,治疗过程中需密切控制上述因素,以减少对患者的影响。

