磁共振波谱成像检测肝内脂肪浸润水平诊断非酒精性脂肪肝的价值
刘小玲 阮君 朱敬松
近几年NAFLD呈迅速增长且低龄化发病趋势,香港、上海等区成人患病率高达15%左右,且10%~30%的患者10年内可能进展为肝硬化[1-2]。目前肝穿刺活检虽是诊断NAFLD的金标准,但属有创检查,临床极少被采用;而超声和CT均属间接诊断,不能直接探测肝内脂肪含量并行数值量化[3]。磁共振成像已成为了判断脂肪变性程度的关键手段,但目前国内外研究多侧重于分析MRS定量诊断(水峰、脂峰峰值及波峰下面积)脂肪肝的价值,关于利用MRS检测肝内脂肪浸润值(FF值)对NAFLD严重程度的预测价值,相关报道较少[4-5]。因此,本文旨在探讨MRS检测FF值诊断NAFLD的价值。
资料与方法
一、 一般资料
2016年12月至2019年12月郑州大学第二附属医院收治的NAFLD患者138例,男80例,女58例;年龄18~75岁,平均年龄为(46.7±12.6)岁。NAFLD诊断符合相关标准[6];所有患者年龄≥18岁;腹部超声或CT示脂肪肝;临床资料完整。排除标准:①存在MRS检查禁忌证,如幽闭恐惧症、植入心脏起搏器、存在金属植入物、怀孕等;②合并地中海贫血、肝血色素沉着症或既往有输血史;③因患者呼吸伪影导致出现不能解释的波谱;④甲状腺功能减退症、炎症性肠病及恶性肿瘤;⑤服用他莫昔芬、氨甲蝶呤、丙戊酸钠、糖皮质激素等药物所致脂肪肝;⑥伴糖尿病急性并发症、血液病、重症感染等机体代谢状况严重紊乱的特殊情况。参考相关标准[7]判断NAFLD严重程度,138例患者中轻度64例,中度22例,重度52例。
二、CT检查方法
CT采用日本Toshiba公司 Aquilion 64层螺旋CT予以腹部常规平扫。CT诊断NAFLD的主要依据为肝脏密度普遍降低,CT肝/脾<1.0,其中CT肝/脾<1.0且>0.7者判断为轻度NAFLD,CT肝/脾≤0.7且>0.5者判断为中度NAFLD,CT肝/脾≤0.5者为判断为重度NAFLD[9]。
三、MRS检查方法
于CT检查后3 d内,采用德国西门子公司Siemens Avanto 1.5T超导磁共振扫描仪行腹部MRI单体素氢质子磁共振波谱成像(1H-MRS)扫描。嘱受检者MRI检查当天尽可能少量饮食,促使胃肠蠕动伪影减少,检查前训练受检者呼吸,选择仰卧位、头先进体位,线圈选择体部8通道柔线圈,将腹带束于腹部,降低呼吸幅度。1H-MRS采用单体素SVS-135序列,设置成像参数,扫描野(FOV)20 mm×20 mm×20 mm,重复时间(TR)1 500 ms,回波时间(TE)135 ms,翻转角90°。选择消水抑制,注意选取肝内体素时应远离肝脏边缘,并避开胆管、血管等结构。图像后处理应用其自带B15软件包,经Spectroscopy、交互式处理、添加水峰(water峰,确保峰值达4.7×10-6)、添加脂峰(lip峰,维持峰值为1.33×10-6)、去掉水参考处理流程后,点击Automatic行曲线拟合计算,获取水峰和脂峰峰下面积(Iwater、Ifat) ,通过创建代谢物表格、添加参照代谢物组合lip+water(值为1.0),最终获得FF值。FF值=Ifat/(Iwater+Ifat)。
四、统计学分析

结 果
一、不同程度的NAFLD患者MRS波谱谱线分析
138例NAFLD患者均顺利完成MRS检测。所有患者MRS谱线water峰和lip峰均呈现双峰表现,其余物质与直线接近(图1);其中轻度和中度患者均呈前高后低双峰表现,即高water峰、低lip峰,而重度患者呈前低后高双峰表现,即低water峰、高lip峰。
二、不同程度的NAFLD患者FF值分析
138例NAFLD患者FF值为32.9±8.5,其中轻度、中度、重度NAFLD患者FF值分别为28.4±6.6、32.2±8.7、38.8±10.7。其中,轻度NAFLD患者FF值显著低于中度、重度NAFLD患者(t=2.141、6.420,P=0.035、0.000),中度NAFLD患者FF值显著低于重度NAFLD患者(t=2.555,P=0.013)。FF值与NAFLD严重程度呈高度正相关(秩相关系数rs=0.838,P<0.001)。
三、 NAFLD患者FF值与肝/脾CT比值的关系
NAFLD患者FF值与CT肝/脾呈负相关 (r=-0.920,P<0.001,图2) 。
讨 论
有报道表明,肝细胞脂肪变性是诱导不明原因肝硬化的关键因素,4%~5% 的患者最终进展至肝硬化[8-10]。另有研究显示,NAFLD患者患心血管疾病的风险也与肝细胞脂肪变性密切相关[11]。因此,寻找一种可靠的评价NAFLD患者肝细胞脂肪变性情况的指标尤为重要。以往报道显示,常规形体指标如体质量指数、腰围等与NAFLD严重程度仅呈弱中等程度相关,在预示NAFLD严重程度方面存在一定局限性;而常规血生化指标与NAFLD严重程度呈低度相关性及无相关性,因此认为其无法对NAFLD严重程度进行预测及评价[12]。近年来,MRS被证实在阿尔茨海默症、早期肝性脑病、肝硬化等疾病诊断及预后判断中发挥着重要作用[13-14]。
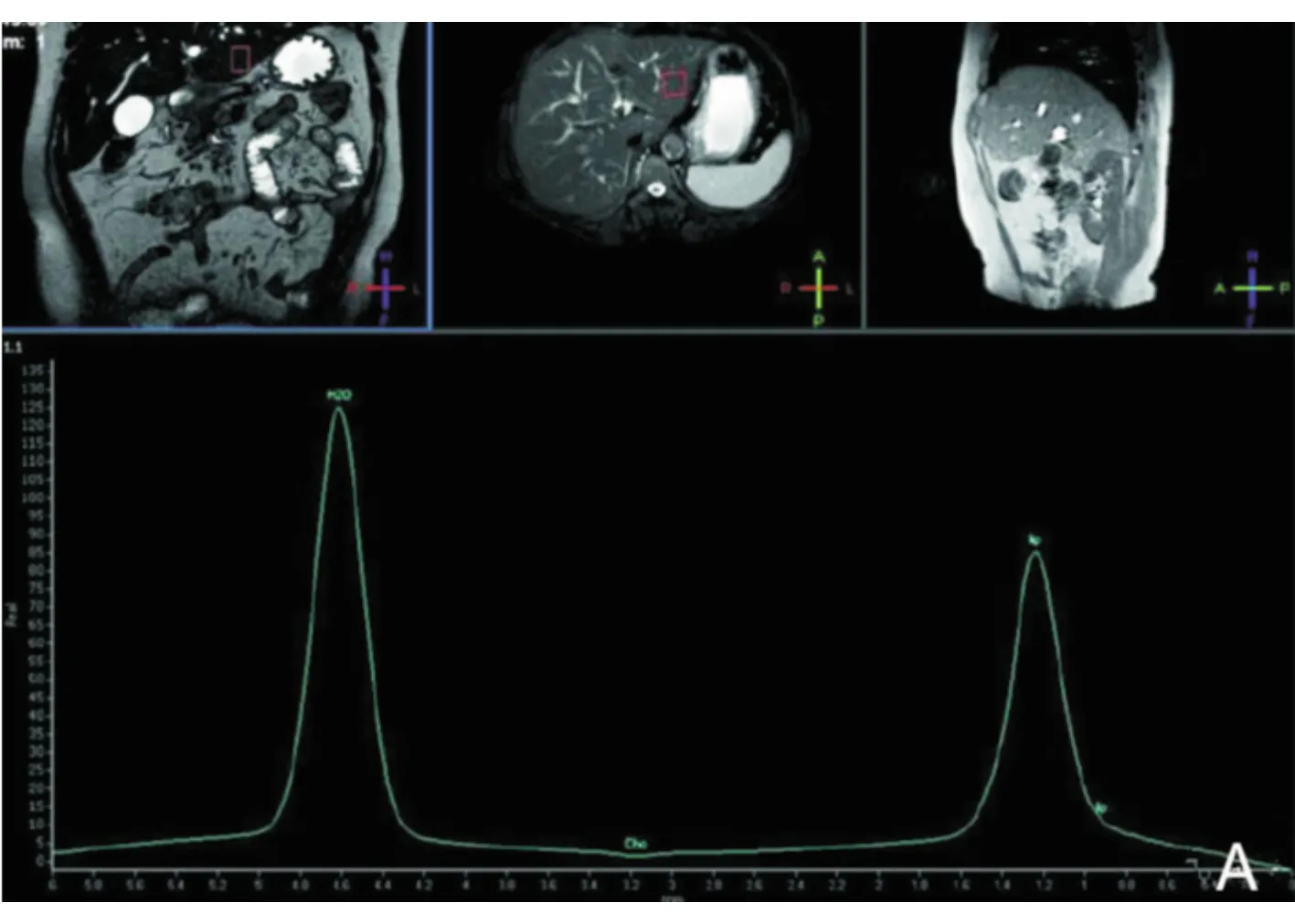
MRS谱线water峰和lip峰均呈现双峰表现,即在4.6×10-6处可见高尖状water峰,在1.2×10-6处可见高耸状lip峰
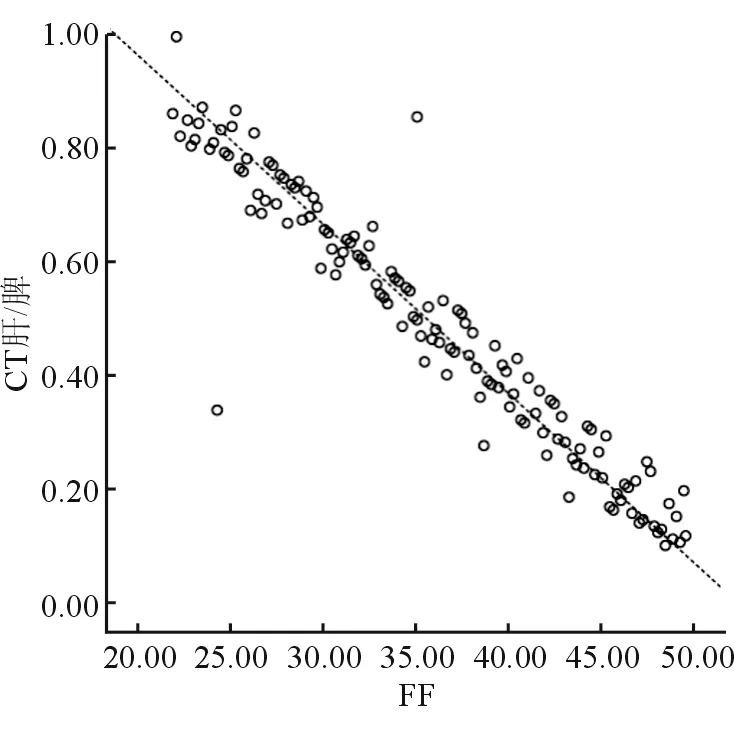
图2 NAFLD患者FF值与CT肝/脾的线性相关图
本研究结论显示,轻度NAFLD者FF值明显低于中度、重度NAFLD者,中度NAFLD者FF值明显低于重度NAFLD者,证实随着FF值的上升,患者病情越严重。通过进一步研究,发现NAFLD者FF值与CT肝/脾呈负相关。综合上述结果,推断FF值同样可对NAFLD严重程度进行评价。以往报道认为,CT肝/脾虽是评价NAFLD较为成熟的影像学方法,但由于CT辐射剂量较大,无法对肝内脂肪含量进行测量,故无法提供肝内脂肪变化数值,评估患者预后方面受限。而利用MRS获取FF值,可评估肝内脂肪含量,进一步得出在NAFLD严重程度评价方面FF值明显优于CT肝/脾。瞿欢佳等[15]通过对124例NAFLD、慢性乙型肝炎及乙型肝炎合并脂肪肝患者进行系统研究,发现MRS可诊断肝脏脂肪变程度,且不受患者性别、年龄、乙型肝炎病毒感染等因素的影响,与人体质量指数、脂质代谢存在一定相关性。李斯婕等[16]报道显示,利用MRS对肝内脂肪含量进行检测,获取FF值,对判断NAFLD患者病情严重程度具有一定价值,与本结论相符。但有报道认为,MRS对少量脂肪的敏感性更高,随着脂肪含量的不断增多,噪声随之增大,故认为MRS可能更适合轻度脂肪肝的量化评估,有待今后深入探讨[17]。笔者认为,随着NAFLD患者病情的逐渐加重,肝脏密度减低,CT肝/脾不断下降,FF值逐渐增大。但MRS波谱质量决定FF值的准确性,而感兴趣区位置选择、场强均匀性、饱和带设置与MRS波谱质量密切相关。因此,临床上应确保感兴趣区与肝边缘相距1 cm以上,同时应注意感兴趣区至肝上、下缘的距离应大于设定体素高度,预防实际所测体素低于设定体素而致使扫描失败;另外,体素内应注意只包含肝组织,尽可能避免出现粗大胆管和血管,采用“井”字形对饱和带进行充分保护,于扫描前确保自动匀场。MRS采集耗时相对较长,易受患者运动干扰,尤其是腹部,呼吸运动可促使体素失配准及波谱共振的线宽增宽,故临床上可借助运动矫正序列减轻运动对MRS的不良影响。
综上,利用MRS获取FF值,在NAFLD严重程度评价上明显优于CT肝/脾,临床应用积极推广。但考虑本研究未纳入正常无NAFLD者进行对照分析,故今后需进一步深入研究。

