氟西汀影响HepG2细胞增殖和凋亡的机制
刘晓慧 马丽霞 张晶
肝细胞癌是世界上最常见恶性肿瘤之一,是全球第二大与癌症相关的死亡原因[1]。氟西汀是一种选择性5-羟色胺再摄取抑制剂,在临床上广泛应用于抗抑郁治疗[2]。越来越多的证据表明,氟西汀能够抑制多种肿瘤生长,诱导肝癌细胞的凋亡[3-7]。本实验探讨氟西汀对HepG2细胞增殖及凋亡影响的分子机制,为氟西汀应用于肝细胞癌治疗提供依据。
材料与方法
一、主要材料与仪器
人肝癌细胞系HepG2细胞购自美国ATCC公司;氟西汀购自美国Sigma公司;细胞周期检测试剂盒购自北京康为世纪生物科技有限公司;RNA提取试剂盒购自美国Gibco公司;TAKARA 反转录试剂盒、SYBR Premix ExTaqTM购自大连宝生物工程有限公司;兔抗人Bcl-2单抗、Bax单抗购自美国Cell signaling公司;兔抗人Caspase-3多抗、兔抗人β-actin单抗购自美国abcam公司;辣根过氧化物酶标抗兔二抗购自北京中山金桥有限公司。
二、流式细胞术检测氟西汀对HepG2细胞周期的影响
应用含有10%胎牛血清的DMEM培养基将HepG2细胞培养至最佳状态,将处于对数生长期的HepG2细胞吹打成单个细胞,细胞计数后取2×105个细胞铺种于6孔板中,培养体系为2 mL。孵育24 h细胞贴壁生长后,弃去原培养基,换为2 mL无血清DMEM培养基,同时培养基内给予不同浓度氟西汀,未加药组为对照组,孵育24 h后收集细胞,应用碘化丙啶染色方法制成流式标本,上机检测细胞周期。
三、荧光定量PCR法检测Bcl-2、Bax mRNA表达
(一)细胞培养及处理 将处于对数生长的HepG2细胞吹打成单个细胞,细胞计数后取2×105个细胞铺种于6孔板中,培养体系为2 mL。孵育24 h细胞贴壁生长后,弃去原培养基,换为2 mL无血清DMEM培养基,同时培养基内给予12.5 μmoL氟西汀,未加药组为对照组,分别孵育6 h、12 h、24 h。
(二)实时荧光定量反转录PCR 使用RNA提取试剂盒从培养的细胞中提取总RNA,紫外分光光度法测定总RNA含量,然后采用20 μL的反转录体系,反转录成cDNA, 最后用EASY Dilution将cDNA液按100、101、102、103梯度稀释后,各取2 μL稀释好的cDNA进行Real-time PCR,检测目的基因的扩增效率和管家基因(GAPDH)的扩增效率一致。PCR引物序列如下:Bcl-2上游(5′-3′)gAgAAATCAAACAg-AggCCg,下游(5′-3′)CTgAgTACCTgAACC-ggCA;Bax上游 (5′-3′)TgACCTCACTgTgACCTTgACT,下游(5′-3′)TgAgCAATTCCAgAggCAgT。
四、蛋白质印迹法检测Bcl-2、Bax、caspase-3蛋白表达水平
根据蛋白提取试剂盒说明书步骤提取蛋白质,BCA法测定蛋白质浓度。配置12%SDS-PAGE分离胶,分离等量的蛋白质,然后将其转移至PVDF膜上。在10 mL 5%脱脂奶粉中加入10 μL(1∶1 000)一抗(分别为兔抗人Bcl-2单抗,兔抗人Bax单抗,兔抗人caspase-3多抗,兔抗人β-actin单抗),放摇床上4℃轻摇过夜。过夜后,取出PVDF膜,用1×TBST室温摇床洗3次,每次30 min。将PVDF膜放入相对应的辣根过氧化物酶标记的羊抗兔IgG抗体(1∶2 000),放摇床上,4℃轻摇2 h;用1×TBST室温摇床洗3次,每次30 min。将ECL发光试剂A 500 μL与试剂B 500 μL混合后,均匀将PVDF膜浸透,将其包于保鲜膜中,反应5 min。在暗室内取出胶片,放在被保鲜膜覆盖的PVDF膜上,盖上X-线片夹板,根据条带亮度调整曝光时间。取出胶片,常规显影、定影。胶片经扫描后,用Bio-Rad图像分析系统分析条带灰度值,比较各组目的蛋白/内参蛋白的表达量。
五、统计学分析

结 果
一、氟西汀对HepG2细胞周期影响
氟西汀以浓度依赖方式使HepG2细胞停滞于G2/M期。对照组G2/M期细胞与5 μmoL实验组G2/M期细胞相比差异无统计学意义(t=,P>0.05)。10 μmoL组和12.5 μmoL组G2/M期细胞与对照组比较,差异均有统计学意义(均P<0.05)。各组HepG2细胞不同细胞周期的细胞比例见表1。
二、HepG2细胞不同时间点Bcl-2、Bax的mRNA表达
荧光定量PCR法检测12.5 μmoL氟西汀处理HepG2细胞0、6、12和24 h后Bcl-2、Bax的mRNA相对表达量并记录CT值,计算2-△△CT值。结果显示随着氟西汀孵育时间延长,HepG2细胞Bcl-2的mRNA表达逐渐降低,各组与对照组相比,差异均有统计学意义(均P<0.05);而随着氟西汀孵育时间延长,HepG2细胞Bax的mRNA表达各组与对照组相比,差异均无统计学意义(均P>0.05),见表2。
三、氟西汀处理HepG2细胞不同时间点Bax、Bcl-2及caspase-3的蛋白表达
12.5 μmoL氟西汀处理HepG2细胞0、6、12和24 h后Bcl-2蛋白表达在12 h开始下降,Bax蛋白表达与对照组相比无明显变化,Bax/Bcl-2在12 h及24 h蛋白表达明显低于对照组(均P<0.01),caspase-3蛋白表达在12 h开始增多,12 h及24 h蛋白表达均高于对照组(均P<0.05),见图1,表3。
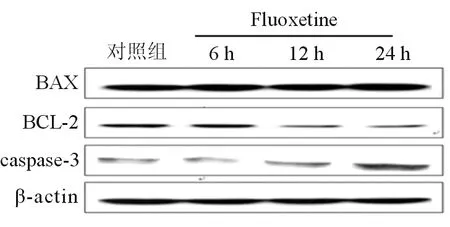
图1 蛋白质印迹检测Bax、Bcl-2、Caspase-3蛋白表达
讨 论
研究表明,氟西汀抑制人肝癌细胞系HepG2增殖可能与影响细胞周期进程有关,诱导HepG2细胞凋亡则可能是通过线粒体途径实现的。
氟西汀以浓度依赖方式使HepG2细胞停滞于G2/M期,G2/M期是DNA合成和有丝分裂的准备期,在细胞周期进程中有至关重要的作用。本研究发现,G2/M期细胞随着氟西汀浓度增大而增加,因此氟西汀抑制体外培养的HepG2增殖,可能与氟西汀使HepG2在细胞周期G2/M期积累停滞有关。
细胞凋亡是由多种基因控制的程序性死亡,线粒体在细胞凋亡中发挥举足轻重的作用。线粒体凋亡途径是细胞凋亡信号传导的重要通路,受Bcl-2家族蛋白成员调节[8]。Bcl-2是一种抗凋亡蛋白,通过阻止细胞色素C从线粒体释放到细胞质中或与细胞凋亡激活因子结合来调节细胞凋亡[9]。Bax是与Bcl-2功能相反的一个基因,能促进细胞凋亡。Bax/Bcl-2比值对决定细胞是否进入凋亡状态有重要意义[10]。
在线粒体凋亡通路中,DNA损伤、代谢紊乱、药物诱导等因素可导致线粒体内外膜通透性增加,释放线粒体凋亡蛋白,包括细胞色素C、凋亡诱导因子等。细胞色素C与凋亡蛋白酶激活因子结合,形成复合物,可促进caspase-9前体的自身活化,活化的caspase-9激活caspase-3,导致细胞凋亡,caspase-3的活化是线粒体凋亡信号通路的关键环节[11,12]。本研究结果显示,随着氟西汀处理时间延长,bcl-2 mRNA和蛋白表达降低,而Bax mRNA和蛋白表达无明显变化,Bax/Bcl-2及活化的casepase-3蛋白表达增多,说明氟西汀可通过线粒体途径诱导HepG2细胞凋亡。
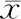
表1 各组HepG2细胞不同细胞周期的细胞比例(%,±s)
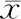
表2 氟西汀对HepG2细胞Bcl-2、Bax mRNA表达的影响(±s)
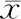
表3 Bax/Bcl-2、Caspase-3蛋白表达水平灰度比值结果(±s)
本实验明确了氟西汀体外的抗肝细胞癌作用,阐明了氟西汀可能是通过影响细胞周期进程和下调Bcl-2表达、激活caspase-3,抑制肝癌细胞系HepG2增殖并诱导其凋亡。后期可通过体内实验进一步研究氟西汀的肝癌抑制作用。

