直接进样-超高效液相色谱-串联质谱法测定水中乙草胺
黄允河,吴春玲,张立亚
(杭州市水务集团有限公司,浙江杭州 310014)
乙草胺是一种酰胺类农药,是我国使用量最大的除草剂之一,广泛应用于玉米、棉花、豆类等多种农作物。乙草胺不仅具有直接毒性,还具有不易光解、易残留等特点[1]。残留于土壤的乙草胺则通过降雨、径流等方式进入地表水、地下水等水体中,造成水源污染,并对饮用水安全造成威胁[2]。在全国重点城市水源水和出厂水乙草胺残留调查中,水源水中检出率达66.9%,而水厂处理对乙草胺的去除效果有限[3]。国家卫生健康委员会20201948-Q-361项目中对《生活饮用水卫生标准》进行了修订,在饮用水标准中增加了乙草胺指标[4]。
目前,水中乙草胺的检测方法主要有液液微萃取-气相色谱法、固相萃取-气相色谱-串联质谱法、固相膜萃取-气相色谱-串联质谱法、固相萃取-液相色谱法等[5-8]。这些检测方法均需进行萃取富集后才能达到较高的灵敏度,前处理过程复杂,处理时间长。
本文建立了直接进样-超高效液相色谱-串联质谱法测定水源水和生活饮用水中乙草胺。该方法前处理简单,具有快速、简便、稳定等特点,为生活饮用水的安全把关提供技术保障。
1 试验部分
1.1 仪器与试剂
ACQUITY UPLC H Class/XEVO TQ-Smicro 超高效液相色谱-串联质谱仪(美国Waters公司);Milli-Q超纯水仪(美国Millipore公司);0.22 μm针式聚偏氟乙烯(PVDF)滤膜(天津津腾公司)。
乙草胺标准溶液,1 000 mg/L(北京坛墨质检);乙腈,色谱纯(Fisher Scientific);甲醇,色谱纯(Fisher Scientific);甲酸,LC-MS级(Fisher Scientific);次氯酸钠(宁波万华化学有限公司);抗坏血酸(国药)。
1.2 色谱条件
色谱柱:ACQUITY UPLC BEH C18 (2.1 mm × 50 mm, 1.7 μm);柱温为30 ℃;进样量为5 μL;流速为0.25 mL/min;流动相A 0.05%甲酸水溶液,流动相B乙腈,梯度洗脱程序如表1所示。

表1 梯度洗脱程序Tab.1 Gradient Elution Program
1.3 质谱条件
离子源:电喷雾离子源(ESI+);离子源温度为120 ℃;毛细管电压为3.5 kV;脱溶剂气温度为350 ℃;脱溶剂气流量为400 L/h。扫描方式:多反应离子检测(MRM)。表2为乙草胺的MRM参数。

表2 乙草胺的MRM参数Tab.2 MRM Conditions of Acetochlor
1.4 标准溶液的配制
将1 000 mg/L的乙草胺标准溶液用甲醇稀释至1.0 mg/L的标准使用溶液。然后,将此标准使用溶液用甲醇水溶液(1+1)逐级稀释成浓度分别为0.10、0.20、0.50、1.00、2.00、5.00 μg/L的标准系列溶液。
1.5 水样前处理
水样经0.22 μm 针式PVDF滤膜过滤后,加入等体积的甲醇,直接进超高效液相色谱-串联质谱仪进行测定。
2 结果与讨论
2.1 质谱条件的优化
用乙腈水溶液(1+1)配制100 μg/L的乙草胺标准溶液,直接灌注于质谱,在ESI正离子模式下,进行母离子全扫描,调节灌注流速、毛细管电压使母离子m/z 270信号稳定。然后进行系统调谐,优化锥孔电压、碰撞能量等质谱参数,找到丰度最高、干扰最小的两个子离子,分别为270>224和270>148,将其作为多反应离子检测的监测离子。
2.2 色谱条件的优化
比较了乙腈和甲醇两种有机相与水溶液组成的流动相体系对样品的分离效果。结果显示,在相同条件下,以乙腈-水体系为流动相时,保留时间较短,峰型较好,且灵敏度较甲醇-水体系高。因此,有机相选择乙腈作为流动相。
在液相色谱-串联质谱分析中,流动相常加入适量的添加剂提高离子化效率。正离子模式检测时,以甲酸为常用添加剂,考察了纯水、0.05%甲酸水(V/V)、0.1%甲酸水(V/V)作为流动相时对乙草胺检测的影响。结果表明,在纯水中加入适量甲酸后,乙草胺灵敏度明显增强,随着甲酸浓度的加大,0.1%甲酸水流动相的乙草胺响应信号较0.05%甲酸水流动相已有所下降。因此,选择在水相中加入0.05%甲酸。
在最优试验条件下,乙草胺的色谱图如图1所示,保留时间在2.50 min。

图1 乙草胺特征离子质量色谱图(270>224)Fig.1 Characteristic Ion Mass Chromatogram of Acetochlor
2.3 方法线性关系和检出限
取1.4中配制的标准系列溶液,在最优试验条件下对其进行测定,并以峰面积和浓度绘制标准曲线。结果显示,乙草胺的质量浓度在0.10~5.00 μg/L时呈现良好的线性关系,相关系数为0.999 8。
依据《环境监测分析方法标准制修技术导则》(HJ 168—2010)中方法检出限指标的确定方法[9],当空白试验中未检测出目标物质时,对浓度值为估计方法检出限2~5倍的样品进行7次平行测定后,计算方法检出限(LOD),以4倍检出限作为方法定量限(LOQ),结果如表4所示。乙草胺检出限为0.02 μg/L,定量限为0.08 μg/L。
2.4 干扰
饮用水在生产过程中常添加次氯酸钠等消毒剂对水样进行消毒,这些消毒剂可氧化水中痕量的有机物。考察了水中余氯对本方法测定水中乙草胺的影响,通过在实际水样中添加不同体积的次氯酸钠溶液,配制成总氯分别为0.30、1.20、3.00 mg/L的水样,取一份实际水样加入抗坏血酸进行脱氯。在水样中加入0.20 μg/L乙草胺,不同时间后进行测定。分析结果表明,在24 h检测时间内,饮用水中余氯未对乙草胺的测定产生影响。

表3 乙草胺的回归方程Tab.3 Regression Equations of Acetochlor

表4 乙草胺的检出限和定量限Tab.4 Limit of Detection (LOD) and Limit of Quantitative (LOQ) of Acetochlor

表5 不同浓度余氯水样的乙草胺测定结果Tab.5 Results of Acetochlor with Different Concentration of Residual Chlorine in Water
2.5 方法准确度
为验证方法准确度,进行了实际样品加标试验。在地下水、地表水、出厂水、管网水、样品中分别添加了低(0.20 μg/L)、中(1.00 μg/L)、高(4.00 μg/L)3种浓度的标准物质,每个浓度水平平行测定6次,加标回收率及相对标准偏差(RSD)结果如表6所示。分析结果表明,本方法平均加标回收率为93.8%~105%,相对标准偏差在1.6%~5.9%,可满足实际检测要求。
2.6 实际水样测定
采用本文建立的方法,对钱塘江、千岛湖、苕溪3个地表水、杭州市不同区域内各2个地下水、出厂水、管网水共9个水样进行了分析,均未有乙草胺的检出。
3 结论
本试验建立了直接进样-超高效液相色谱-串联质谱法测定水源水和生活饮用水中乙草胺的检测方法。水样经过滤后可直接进样,操作简便,5 min内可完成测定,分析速度快,方法检出限为0.02 μg/L,加标回收率在93.8%~105%,灵敏度和准确度均可满足水中痕量乙草胺的分析测定,适用于水源水和生活饮用水中乙草胺的常规检测。
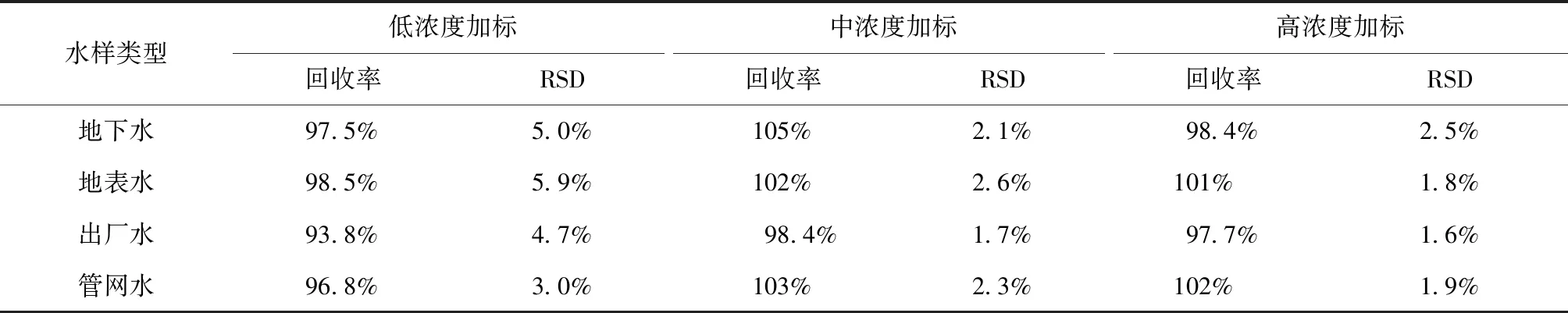
表6 不同水样的加标回收率和精密度 (n=6)Tab.6 Recovery and Precision of Different Water Samples (n=6)

