微小膜壳绦虫感染对ICR小鼠小肠干细胞相关基因mRNA表达的影响*
杨汉蕾,赵敬,张科,鄢宇航,门万琪,皮焕婷,牟荣*
(1.贵州医科大学 基础医学院 人体寄生虫学教研室,贵州 贵阳 550004;2.贵州医科大学 现代病原生物学特色重点实验室,贵州 贵阳 550004;3.贵州医科大学 临床医学院,贵州 贵阳 550004)
微小膜壳绦虫(Hymenolepisnana,H.nana)是人类常见感染的绦虫,其成虫可寄生于人或鼠类小肠[1],能够在一个宿主中完成整个生命周期,因此能够自体感染[2]。近年来,有研究发现肠道寄生蠕虫在破坏小肠组织完整性的同时也产生积极的损伤修复作用[3-4]。由小肠的稳态机制提示小肠干细胞在维持肠道正常生理功能及组织结构的重要作用[5],但关于肠道寄生蠕虫感染与小肠干细胞的关系研究并不多见,因此本研究在前人的研究基础上筛选出几个肠干细胞相关基因,G蛋白偶联受体5基因(leucine-rich repeat-containing G-protein coupled receptor5,Lgr5)[6]、Bmi1多梳复合蛋白基因(Bmi1 proto-oncogene polycomb ring finger,Bmi1)[7]、Msi1武藏RNA结合蛋白基因(musashi RNA-binding protein 1,Msi1)等干细胞标记物[8]及淋巴细胞抗原6复合物基因(lymphocyte antigen 6 complex locus A,Ly6a)[9-10]。Lgr5蛋白在体内分布广泛,如脑、眼、脊髓、卵巢及胃肠道等都有一定的表达[11];Lgr5在器官、胚胎和其他一些生理过程中,以及成体干细胞的自我更新和维持中起着非常重要的作用,其在小肠和结肠隐窝基底柱状上皮细胞中特异性表达,基因编码产物为阳性的细胞,可以分化产生肠上皮所有的细胞类群[12];经研究证实Lgr5为小肠和结直肠干细胞标记基因,表达量的增加能够促进胃肠黏膜的自我更新能力[6]。Bmil是最早发现的+4位肠干细胞标记基因,是Polycomb基因家族的一部分,该基因在胎盘、大脑及心脏中广泛表达,对干细胞的自我更新以及肿瘤的发生起着重要作用[13-14];通过谱系追踪技术证明,Bmi1能标记少量慢速增殖的+4位肠干细胞,这些细胞可增殖、扩张及自我更新,形成所有已分化的小肠上皮细胞谱系[7];有研究认为Bmil干细胞诱导肠上皮损伤后修复[15]。Msil是一种进化十分保守的RNA结合蛋白,在维持干细胞自我更新、分化和肿瘤发生方面起着重要作用[16];在哺乳动物小肠中,Msi1在距隐窝基底部4~6个细胞处表达,与公认的小肠干细胞位置相符,Msil在哺乳动物体内参与了包括维持干细胞内稳态、细胞分化及肿瘤形成等一系列的调控[17],因此Msil也可以作为小肠干细胞的标志物。Ly6a编码的干细胞抗原-1(stem cell antigen-1,Sca-1)在化学性结肠炎模型的研究中被证明起动态调节作用,相比于正常肠组织,Sca-1表达并不明显,而在损伤肠组织中,肠上皮修复相关的肿胀区域Sca-1表达水平显著增高[18];此外,当损伤部位仅在绒毛而不涉及隐窝时,Ly6a表达并不上调[3];因此,Ly6a一般被当做肠道隐窝损伤的特异性标志物。本实验拟在建立H.nana实验感染动物模型的基础上,采用实时荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction,qRT-PCR)技术检测感染H.nana的ICR小鼠肠组织干细胞相关基因Lgr5、Bmi1、Msi1及Ly6a的表达,为探索H.nana感染所致宿主肠壁损伤后的修复机制提供有意义的基础资料。
1 材料与方法
1.1 材料
1.1.1虫体来源和实验动物 虫体采自贵阳花溪山区野生小鼠,经形态学观察和分子生物学鉴定,确定采集虫体为H.nana,收集成虫孕节及虫卵。6周龄美国癌症研究所(institute of cancer research,ICR)雌鼠60只,购自贵州医科大学实验动物中心,体质量26~28 g,体健,经粪检和间接凝集实验证实无寄生虫感染;称重后隔离饲养观察3 d,无健康问题后可作实验用;实验期间小鼠严格隔离饲养,水瓶与鼠粮不能交叉污染,每周清洗更换3次饲养笼及饲料、垫料。
1.1.2主要试剂和仪器 Trizol(美国invitrogen),qRT-PCR引物(上海生工生物工程有限公司合成);Nikon科研级成像系统(日本Nikon,Nikon DS-RI2),ABI7300 荧光定量PCR仪(美国 ABI,7300),生物组织切片机(德国徕卡,RM2016)。
1.2 方法
1.2.1H.nana形态学鉴定及分子生物学鉴定 取出野生小鼠小肠内获取的的虫体置于培养皿,生理盐水冲洗3次,取载玻片滴入生理盐水,用棉签将虫体挑到玻片上,使虫体舒展开,置于400倍显微镜下观察成虫及虫卵的形态;根据GenBank中记录的COX1全基因序列设计保守引物[19-20],提取虫总DNA,以其为模板利用保守引物扩增PCOX1,引物序列:PCOX1 Forward Primer为5′-ACCGCGTCGTGTGTGTATTT-3′,PCOX1 Reverse Primer为5′-ACATGCAACTGGGCTCATACG-3′,扩增产物预测大小202 bp。使用1%的琼脂糖凝胶电泳35 min,凝胶成像系统拍照。将PCR 产物送上海生工公司进行测序,然后将测得序列与GenBank中记录的COX1序列进行blast比对分析。
1.2.2实验动物感染、分组及标本采集 60只ICR小鼠随机均分为实验组和对照组,H.nana虫卵淘洗定量后,实验组ICR小鼠灌胃500个虫卵,对照组小鼠灌胃等量生理盐水。感染后第1天开始,每天分别随机处死实验组小鼠和对照组小鼠各3只,取距离回盲部6~8 cm处小肠组织,同时记录实验组小鼠小肠组织内虫体检获情况并计算虫体检获率[虫体检获率=(当天检获虫体的小鼠数/3)×100%],共10 d。
1.2.3小鼠小肠目的基因的qRT-PCR检测 利用 Primer 5.0 和 DNA Club 软件根据Lgr5、Bmi1、Msi1及Ly6a各基因的 cDNA 序列设计 qRT-PCR特异性引物,同时以GAPDH基因为内参基因(引物序列见表 3),交由上海生工生物公司合成。反应体系为SYBR Premix Ex Taq Ⅱ(2×)10 μL,上游引物 0.8 μL,下游引物 0.8 μL,ROX Reference DyeⅠ(50×)0.4 μL,c DNA 1.0 μL,ddH2O 7.0 μL。反应条件为95 ℃预变性30 s、95 ℃变性5 s及60 ℃退火34 s,共40个循环,最后72 ℃延伸30 s。采用2-ΔΔCT法计算各目的基因的相对表达量。

表1 qRT-PCR 引物及产物大小Tab.1 Primers used in qRT-PCR
1.3 统计学分析
2 结果
2.1 H.nana形态学鉴定及分子生物学虫种鉴定
显微镜下观察野生小鼠小肠内获得的虫体,可见虫体头节有4个吸盘以及一个可自由伸缩的顶突;划破孕节使虫卵逸出,可见虫卵卵壳较薄,胚膜两端凸起发出丝状物,内有一六钩蚴(图1)。提取该虫总DNA,以其为模板利用保守引物扩增PCOX1,结果在200 bp处有一特异性条带,与202 bp的预期结果大致相符(图2);PCOX1序列与 GenBank 中登录的COX1参考株核苷酸序列同源性为99%(图3)。
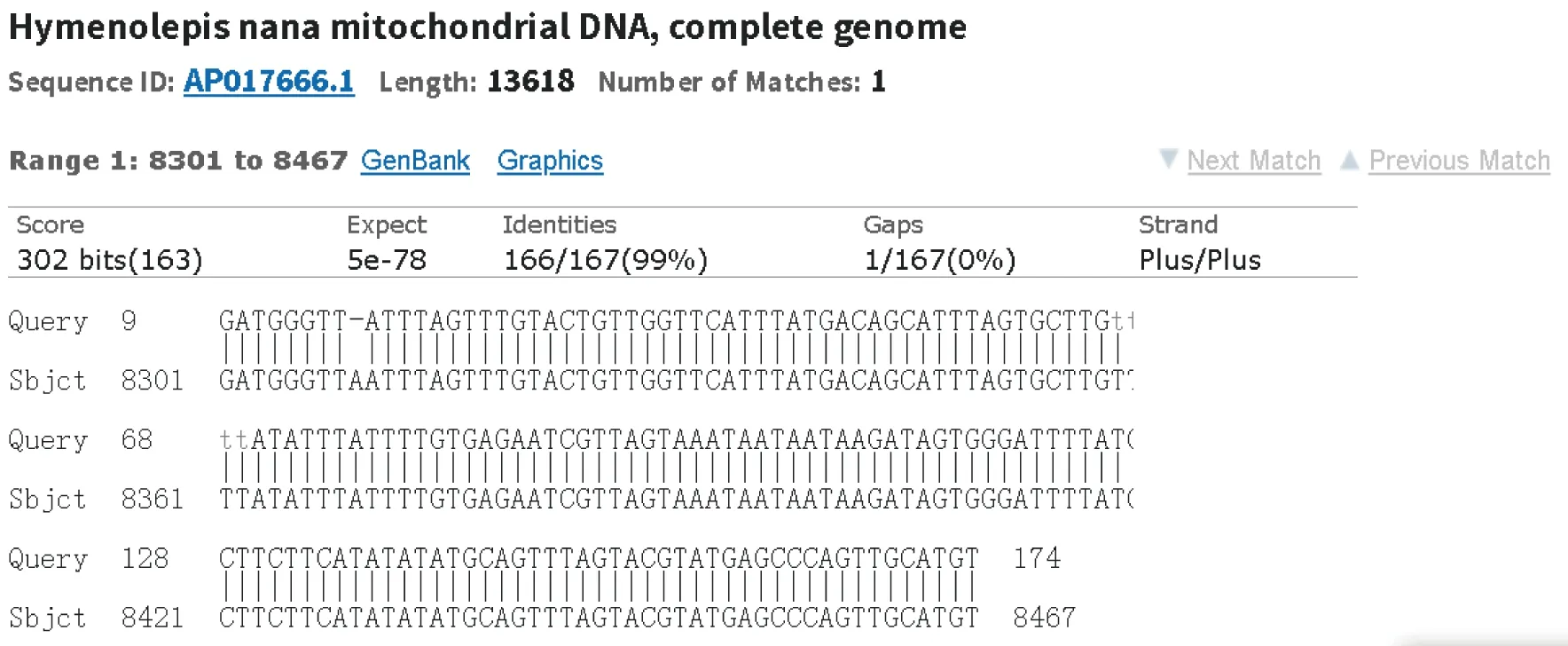
图3 COX1基因扩增产物同源性分析结果Fig.3 Homology analysis of COX1 amplified products
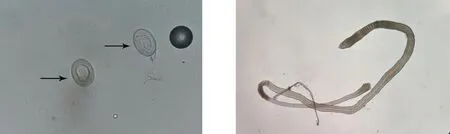
虫卵(400×) 成虫(40×)注:箭头所示为虫卵。图1 野生小鼠体内检获H.nana虫卵及成虫的形态学特征(粪便生理盐水涂片)Fig.1 Morphological characteristic of H.nana worms from wild mice(fecal physiological saline smear)
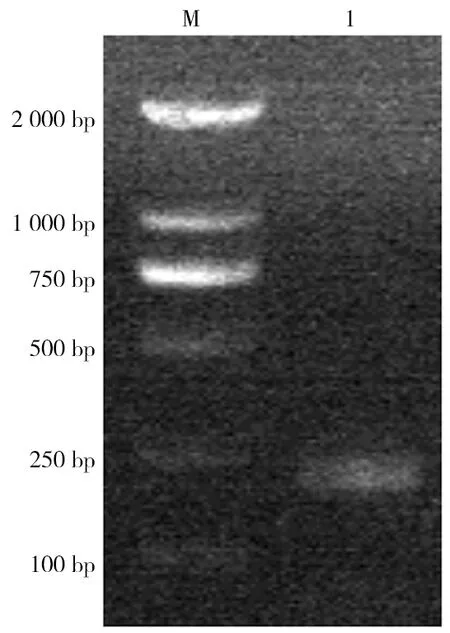
注:M为DNA分子质量标准,1为COX1核酸扩增产物。图2 COX1基因扩增产物电泳结果Fig.2 Electrophoretogram of COX1 amplification products
2.2 H.nana虫卵实验感染小鼠
感染后第7~10天,实验组小鼠距离回盲部6~12 cm处小肠内均检获白色细小虫体,镜下可分辨出有4吸盘的头节和颈部(图4),虫体检获率100%;实验组小鼠小肠内均未检获虫体。
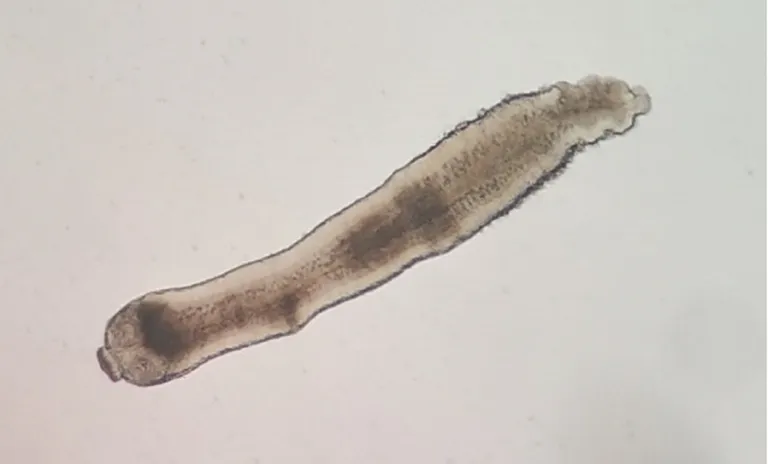
图4 H.nana感染小鼠后第7天小鼠小肠内检获的虫体(生理盐水涂片,×40)Fig.4 The worm in the small intestine of mice infected with H.nana on the 7th day(Saline smear,×40)
2.3 qRT-PCR检测ICR小鼠小肠组织干细胞相关基因mRNA的相对表达
感染H.nana后第1~10天,实验组和对照组ICR小鼠干细胞相关基因mRNA的相对表达量结果显示,与对照组相比,实验组ICR小鼠Lgr5 mRNA在感染后第1天(即H.nana似囊尾蚴期)有一过性的高表达(P<0.05)、感染后第5~8天即H.nana成虫期表达明显下调(P<0.01);与对照组相比,实验组ICR小鼠Bmi1 mRNA在感染后第1天(即H.nana似囊尾蚴期)有一过性的高表达(P<0.05)、感染后第6~8天即H.nana成虫期表达下降(P<0.05);实验组ICR小鼠Msi1 mRNA在感染后第一天表达有一过性上升但差异无统计学意义(P>0.05),第2~3天和第6~10天即H.nana似囊尾蚴期和成虫期表达均下调(P<0.05);与对照组相比,实验组ICR小鼠Ly6amRNA在感染后第2天(即H.nana似囊尾蚴期)表达呈一过性下降(P<0.05)、感染后第6~10天(即成虫期)表达明显上升(P<0.01)。见图5。
3 讨论
H.nana是一种古老的人兽共患寄生虫,虫体顶突上有一圈单层排列的小钩,该结构帮助其牢牢附着在宿主肠壁组织上,从而给宿主造成严重的机械损伤,成虫附着的部位,肠黏膜发生坏死,深达肌层,并有淋巴细胞和中性粒细胞浸润[2]。研究发现肠道寄生蠕虫可能具有诱导肠隐窝的新机制的损伤修复方式[21]。Nusse等[3]在使用多形类卷体线虫(Heligmosomoidespolygyrus)感染小鼠发现幼虫肉芽肿上肠隐窝增生明显,但是肠干细胞基因如Lgr5表达下降,该过程与肠隐窝损伤标志物Sca1表达显著增加有关。本实验发现H.nana感染ICR小鼠后似囊尾蚴期编码组织损伤因子Sca-1的基因Ly6a表达有一过性下降,肠干细胞相关基因Lgr5和Bmi1表达上升,而在成虫期Ly6a表达持续上升,肠干细胞相关基因表达Lgr5、Bmi1及Msi1均显著下降。H.nana的致病作用主要是由于成虫头节上的小钩和体表微毛对宿主肠壁的机械损伤以及虫体的毒性分泌物所致[2]。动物实验结果显示从感染第6天开始,H.nana的似囊尾蚴穿破肠绒毛回到肠腔,以头节吸盘固着在肠壁上,逐渐发育为成虫,对肠黏膜造成机械损伤,引起炎症反应,所以推测感染后第6~8天Ly6a基因呈现明显的高表达,可能与似囊尾蚴穿破肠绒毛回到肠腔引起肠黏膜的炎症反应密切相关。
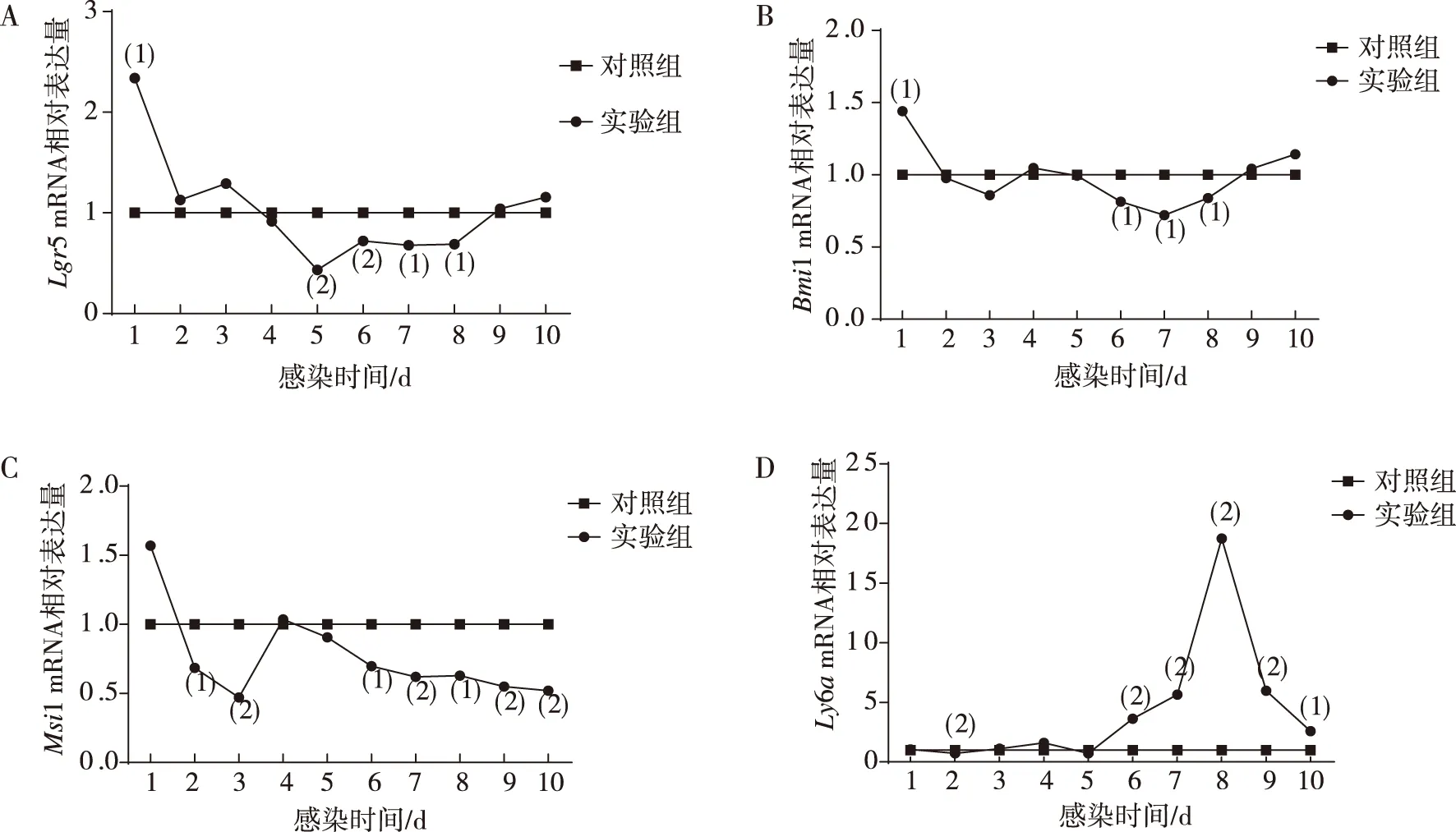
注:A、B、C及D分别为Lgr5、Bmi1、Msi1 及Ly6a mRNA相对表达量;与对照组比较,(1)P<0.05,(2)P<0.01。图5 ICR小鼠小肠中干细胞相关基因mRNA的相对表达Fig.5 Relative mRNA expression of stem cell-related genes in small intestine of ICR mice
本实验发现在感染成虫期,无论是快速增殖干细胞基因Lgr5,还是缓慢增殖干细胞基因Bmi1和Msi1表达均显著下降。Lgr5+干细胞是位于肠隐窝基底的快速增殖干细胞,其在肠道正常的生理代谢以及损伤修复过程中发挥着重要作用,当肠粘膜受到损伤时,Lgr5+干细胞迅速作出反应,快速增殖分化为各种肠上皮细胞类型,对肠上皮损伤进行损伤修复[5]。持续的损伤造成Lgr5+肠干细胞数目减少,这也许是快速增殖肠干细胞的一个特性。有研究发现在硫酸葡聚糖(disuccinimidyl suberate,DSS)诱导肠道炎症的早期阶段,Lgr5+肠干细胞的增殖会显著加快,其分化的子代细胞增多,而在炎症后期,小肠和结肠的Lgr5+肠干细胞的数目显著减少[22]。当损伤较重Lgr5+肠干细胞不足以补充肠组织正常结构时,Bmi1+干细胞和Msi1+干细胞快速增殖,产生新的快速增殖干细胞,从而对肠上皮进行修复[23]。本实验结果显示Bmi1和Msi1在成虫期表达显著下降,推测在H.nana感染ICR小鼠损伤修复过程中也存在其他未知因子发挥作用,抑制了干细胞基因的表达,具体机制有待进一步研究。有研究发现在肠道受辐射诱导的炎症阶段Msi1和Msi2表达上升[24],与本研究正好相反,可能是由于损伤诱导方式的不同以及Msi1在不同组织表达模式不同所致。推测辐射诱导的损伤肠道涉及基因突变,为避免将突变基因遗传下去,休眠的缓慢增殖干细胞会被激活,而H.nana感染主要对肠道造成机械性损伤,损伤修复模式及主要应答细胞也可能不同[25]。
综上所述,本实验发现H.nana感染可明显影响小鼠小肠组织Lgr5、Bmi1、Msi1及Ly6amRNA水平,基因表达差异主要分2个阶段,分别对应H.nana发育的似囊尾蚴阶段和成虫阶段。下一步可使用条件性基因敲除或敲除技术,对干细胞相关基因在H.nana感染ICR小鼠的肠道损伤修复过程中所起的调节作用作进一步研究。

