微小膜壳绦虫感染ICR小鼠后的虫体生长发育情况和小肠组织的病理变化*
杨汉蕾,赵敬,张科,鄢宇航,门万琪,皮焕婷,牟荣*
(1.贵州医科大学 基础医学院 人体寄生虫学教研室,贵州 贵阳 550004;2.贵州医科大学 现代病原生物学特色重点实验室,贵州 贵阳 550004;3.贵州医科大学 临床医学院,贵州 贵阳 550004)
微小膜壳绦虫(Hymenolepisnana,H.nana),又称短膜壳绦虫,属于膜壳科膜壳属[1],是一种人兽共患寄生虫,也是幼儿较常感染的一种绦虫,通常被称为“侏儒绦虫”,是因其体积小,长2~4 cm、宽1 mm[2-4]。H.nana成虫寄生于人或啮齿类动物小肠,以头节吸盘附着在肠绒毛间的黏膜表面[3];当H.nana性成熟时,末端孕节在肠道内分离、解体,之后释放出虫卵,并通过粪便排出虫卵;这些虫卵会立即产生感染性,且可以在环境中存活长达两周。据估计,全世界H.nana感染人数大约有50 000 000~75 000 000[5-6]。相关证据表明,H.nana感染具有改善肠炎的能力,其引起的免疫调节机制能够确定新的分子靶点,为炎症性肠道疾病患者提供新的治疗方案[7-9]。啮齿类动物目前是实验性哺乳动物绦虫研究的主要对象,尤其是小鼠[10]。因此,建立H.nana感染小鼠的实验动物模型可为后续开展H.nana所致炎症性肠炎的相关研究提供动物模型。近年来,国内外报道了一系列H.nana感染脊椎动物和节肢动物的动物模型[11-12],为建立H.nana感染小鼠动物模型奠定了理论基础,但是这些研究均缺少对小鼠体质量变化以及肠组织病理变化的研究,且小鼠每克粪便虫卵数(eggs per gram,EPG)检测缺乏连续性和系统性。因此本实验通过将野生小鼠小肠获取的H.nana,以不同虫卵量实验感染ICR小鼠,观测感染后不同时间小鼠的EPG、体质量和小肠组织病理学特征及检获虫体形态学特征,以了解H.nana在小鼠肠内的生长发育情况和小鼠肠组织病理变化,为H.nana实验感染ICR小鼠的后续研究奠定基础。
1 材料与方法
1.1 虫体来源、实验动物、主要试剂及仪器
虫体采自野生小鼠,经形态学和分子鉴定,确定采集虫体为H.nana。6周龄ICR雌鼠购自贵州医科大学实验动物中心,体质量26~28 g,体健,经粪检和间接凝集实验证实无寄生虫感染。称量体质量后隔离饲养观察3 d。严格隔离饲养,饮水瓶与鼠粮不能交叉污染,每周清洗更换3次饲养笼、饲料和垫料。Trizol购自美国Sigma公司,PCR引物购自上海生工生物工程有限公司,Nikon科研级成像系统(日本Nikon公司,Nikon DS-RI2),PCR扩增仪(THCHNE,TC-512)、生物组织冷冻包埋机(BIOBAS EKD-BC,BK-BM)、生物组织切片机(德国徕卡,RM2016)。
1.2 H.nana虫种鉴定
1.2.1形态学鉴定 将虫体取出置于载玻片上,滴入生理盐水使之舒展开,在普通光学显微镜下观察其成虫和虫卵的形态[13]。取两载玻片将H.nana虫体压平,棉线缠紧,于70 %的酒精里固定后行醋酸明矾卡红染色[14],二甲苯透明后用中性树胶封片,观察并拍照。
1.2.2野生小鼠体内获取的虫体分子生物学鉴定 取约5 mg成虫,用酚氯仿法提取总DNA。以其为模板用COX1[15-17]特异性引物(COX1 上游引物5′-ACCGCGTCGTGTGTGTATTT-3′,COX1 下游引物5′-ACATGCAACTGGGCTCATACG-3′)进行PCR扩增,推测结果为COX1产物条带202 bp。PCR反应体系:模板DNA 2 μL,上游引物1 μL,下游引物1 μL,2×TaqPCRMix 12.5 μL,ddH2O 8.5 μL。PCR扩增程序:94 ℃ 2 min,94 ℃ 40 s,57 ℃ 1 min,72 ℃ 1 min,30个循环;72 ℃ 10 min。使用1%的琼脂糖凝胶电泳35 min,于紫外灯下观察结果,凝胶成像系统拍照。将PCR 产物送上海生工公司进行测序,然后进行序列分析。
1.3 H.nana虫卵的收集和计数
取数段H.nana的末段孕节,生理盐水反复冲洗后以眼科剪充分剪碎使虫卵逸出,待虫体组织沉淀后收集上清,光学显微镜下观察收集的虫卵[18],分别计数5次虫卵量后取均值,每次计数虫卵悬液6 μL,最后定量为生理盐水0.3 mL中含1 000个虫卵备用。
1.4 分组
168只、6周龄、体质量约26 g的ICR小鼠分为6组,5个实验组和1个对照组,每组28只。5个实验组分别以60、100、300、500、1 000个虫卵灌胃感染,生理盐水灌胃的小鼠作为对照组。
1.5 观察指标
1.5.1一般情况与体质量实验组和对照组每组随机选8只小鼠标记,每日观察小鼠活动情况,连续记录小鼠体质量25 d,小鼠相对体质量=小鼠体质量/小鼠初始体质量×100。
1.5.2粪检虫卵 使用改良加藤法[19]检测检测小鼠粪便EPG,连续检测25 d,根据记录结果作排卵趋势图。
1.5.3剖检获取虫体观测 小鼠在感染后第5、10、15、20、25 d,每组随机选取5只小鼠麻醉处死,打开腹腔,取出小肠,放置于装有预冷生理盐水(0 ℃)的培养皿中10 min,然后解剖并收集虫体,观察肠内H.nana的发育状况。
1.5.4组织学观察 感染后第5、10、15、20、25天,取 5个实验组和对照组的小肠,经多聚甲醛固定、石蜡包埋、切片并做苏木精-伊红染色(hymatoxylin-eosin stain,H&E stain)。
1.5.5肠组织的DNA提取 挑选出观察到虫体的蜡块组织提取其中的总DNA,以其为模板利用COX1特异性引物进行PCR扩增。将石蜡包埋的组织切成厚10 μm的薄片,取10 张切片用二甲苯常规脱蜡后,使用75%酒精和无菌水各洗涤3次,然后采用酚氯仿法提取总DNA,DEPC水溶解后采用分光光度计测定DNA的浓度和纯度[20-21]。
1.6 统计学方法
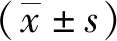
2 结果
2.1 H.nana虫种鉴定
将野生小鼠体内获得的虫体置于显微镜下观察,发现虫体头节有4个吸盘以及一个可自由伸缩的顶突;划破孕节使虫卵逸出,可见卵壳较薄,胚膜两端凸起发出丝状物,内有一六钩蚴(图1a、图1b);明矾醋酸卡红染色后镜下可清晰看到虫体顶突上有一圈小钩,成节内有3个圆球形睾丸和发达的储精囊(图1c、图1d)。此外,虫体DNA的PCR扩增结果显示在约200 bp位置有一特异性条带,与分子生物学鉴定的COX1产物条带为202 bp的预期结果大致相符(图2)。同时PCR 产物测序及序列比对结果表明,所克隆的基因片段与GenBank中记录的COX1参考株核苷酸序列同源性为99%。

注:a为虫卵(400×);b为成虫(100×);c为头节(200×),箭头所示为小钩;d为成熟节片(400×);a、b为生理盐水涂片,c、d为醋酸明矾卡红染色。图1 野生小鼠体内获取的微小膜壳绦虫形态Fig.1 Morphology of H.nana in wild mice
注:M为DNA分子质量标准,1为COX1核酸扩增产物。图2 野生小鼠体内获取的虫体DNA PCR扩增图Fig.2 PCR amplification of insect DNA obtained from wild mice
2.2 小鼠一般情况与体质量
感染后第3天,小鼠出现精神萎靡、食量下降、活动减少、皮毛色泽变暗、毛发蓬乱等症状,症状随虫卵感染量加重。感染量为60、100和300个虫卵的实验组小鼠体质量与对照组比较,差异无统计学意义(P>0.05);与对照组比较,感染量为500个虫卵的实验组小鼠体质量在感染后第2天明显减轻(P<0.05),感染量为1 000个虫卵的实验组小鼠体质量在感染后第2天和第7天也明显减轻(P<0.05)。见图3。
2.3 粪检结果
不同虫卵感染量的实验组小鼠,在感染后第12天从粪便中检获虫卵,感染率为100%,证明虫体在感染后第12天已经发育成熟,完成一个生活史。感染500个虫卵的实验组检出虫卵时间最早、排卵持续时间最长,H.nana感染ICR小鼠动物模型建立可参考该感染量,见表1。

表1 各组H.nana感染ICR小鼠粪检虫卵情况Tab.1 The results of eggs detected from the feces of ICR mice infected with H.nana

注:(1)与对照组比较,P<0.05。图3 实验组和对照组小鼠的相对体质量Fig.3 Relative weight of mice in experimental group and control group
2.4 剖检虫体观测
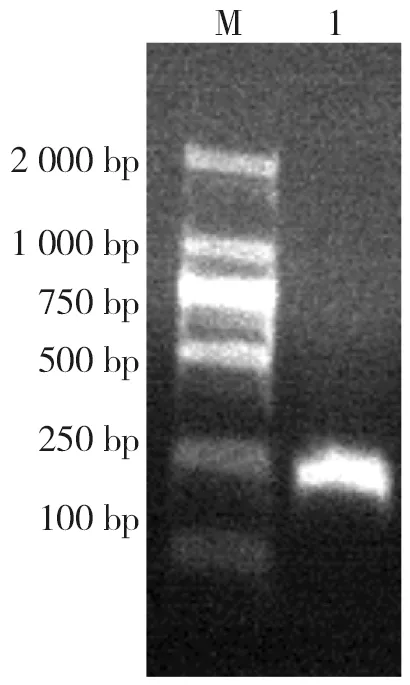
感染后第5天未检获虫体。感染后第10天感染量为60个虫卵的实验组有3只小鼠检获虫体,成虫检获率60%;感染量为100、300、500、1 000个虫卵的实验组小鼠均检获虫体,成虫检获率100%,虫体主要分布于距回盲部6~12 cm处的小肠内。感染后第15、20、25天所有实验组小鼠小肠内均发现成虫,成虫检获率100%,虫体主要分布于距回盲部1~8 cm处的小肠内。见图4。
注:箭头A所指为H.nana虫体,箭头B所指为回肠末端。图4 感染小鼠小肠内获取的微小膜壳绦虫成虫Fig.4 Adult H.nana isolated from the small intestine of infected mice
2.5 小肠组织观察及蜡块组织PCR检测
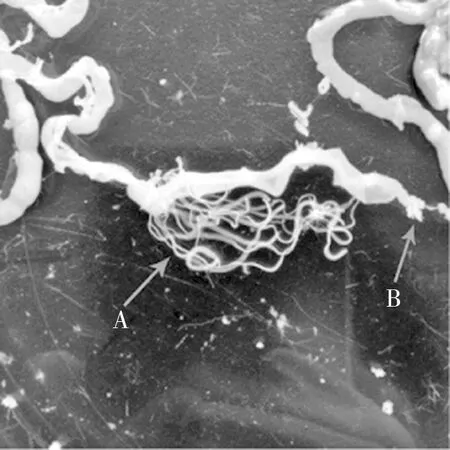
2.5.1小肠组织观察 感染第5天感染量为1 000个虫卵的实验组及感染第15天60个虫卵的实验组小鼠的组织切片中发现,小鼠后三分之一的小肠黏膜内含有似囊尾蚴(图5a),在肠绒毛之间发现带有吸盘和钩状物的成虫头节和头节后未分节的细长颈部(图5b、图5c)、以及含有雌雄生殖系统的成虫节片(图5d),认为H.nana从幼虫到成虫的发育过程是一个从肠壁逐渐向肠腔的迁移过程。与对照组比较,感染后25 d内实验组H.nana感染处肠组织病理切片均未观察到损伤修复肉芽肿组织,但是炎症细胞增多,特别是嗜酸性粒细胞增多明显。
2.5.2小肠蜡块组织的PCR检测 结果约200 bp有一特异性条带,与分子生物学鉴定的COX1产物条带为202 bp的预期结果大致相符(图6),表明小鼠肠道内寄生的确为H.nana。
注:a箭头所示为似囊尾蚴(400×),b箭头所示为成虫头节(200×),c箭头所示为成虫头节和颈部(200×),d为成虫成熟节片(100×)。图5 微小膜壳绦虫感染小鼠小肠组织切片(HE)Fig.5 Section of small intestine in mice infected with H.nana(HE)

注:M为DNA分子质量标准,1为COX1核酸扩增产物。图6 感染组小鼠小肠蜡块组织的PCR扩增情况Fig.6 PCR detection of intestinal tissue of the worm found in HE staining section
3 讨论
H.nana是一种常见的绦虫,分布于世界各地,主要发现于发展中国家的儿童体内。人类膜壳绦虫病是一种全球性流行的人畜共患病,由H.nana和缩小膜壳绦虫引起[22]。H.nana在亚洲、南欧和东欧、中美洲和南美洲以及非洲流行,其生活在人类、小鼠和大鼠的小肠中,它主要通过含有卵的粪便或以中间宿主昆虫为载体进行传播。H.nana也能够在一个宿主中完成其整个生命周期,因此能够自体感染。张维真等[23]研究报道,H.nana虫卵孵化出六钩蚴的时间大约需要2~ 3 d。
本实验结果显示,感染量为60~1 000个鼠源性H.nana虫卵均能感染ICR小鼠,且感染后第2天,500个虫卵感染量和1 000虫卵感染量的实验组小鼠体质量均较对照组明显减轻。结合张维真等[23]所报道的结果,推测感染后第2天H.nana虫卵孵化出六钩蚴后钻入小鼠肠绒毛对其造成损伤,同时虫卵孵化过程中的代谢分泌物也会刺激小鼠肠壁,导致肠壁吸收功能障碍,从而使感染组小鼠体质量下降。本实验粪检虫卵的结果显示,实验组小鼠的感染率为100%,虫体在感染后约第12天发育成熟,这与Thompson[24]研究中所报道的约2周时间相符合,其中感染500个虫卵的实验组虫体和虫卵检获时间一致性最高,反应了虫体发育状况良好。500个虫卵感染量的实验组小鼠体内虫体发育良好的原因可能是小鼠体型较小,其肠道无法负担过多的虫卵感染有关;本研究中也发现1 000个虫卵感染量的实验组小鼠体质量下降更明显,排卵持续时间反而更短。因此适量的虫卵感染量可维持H.nana与小鼠相互作用的平衡关系,一方面小鼠的自身免疫力不会完全清除感染的虫卵,另一方面部分虫卵可以在小鼠小肠内继续生长发育成熟。Fan等[12]曾报道以20个H.nana虫卵感染小鼠,感染19~33 d后检测的成虫感染率仅为33%。因此可将500个虫卵感染量作为参考以建立H.nana感染ICR小鼠动物模型。
本实验的组织病理切片结果显示,在实验组小鼠距离回盲部1~12 cm处的小肠内可见似囊尾蚴、成虫头节、颈部以及成虫节片,肠粘膜未见损伤修复肉芽肿组织,但是炎症细胞增多,尤以嗜酸性粒细胞增多明显,这与Hench等[10]报道的情况基本一致,在检测中并没有发现与宿主排斥反应有关的变化,如组织正常结构的丧失、水肿、混合细胞浸润或上皮糜烂,但是炎症性细胞明显增多。从进化角度来说,寄生虫对宿主的伤害越小越好。Hench等[10]的研究是基于1例自然感染的病患,而本实验是取野生小鼠体内的H.nana虫卵感染ICR小鼠。有研究报道,人、啮齿类动物的H.nana虽属于同种生物,但其生理型并不相同,当改变宿主后其生理型会逐渐改变,这其中的机制尚不明确。
本实验设计尚存在不足之处,实验过程中可能存在自体感染的问题,比如感染后12 d,有可能存在自身感染,这对后续实验结果的分析会造成干扰,因此今后在建立H.nana实验感染ICR小鼠动物模型时可以将实验时间控制在12 d以内,来排除自体感染的干扰,以利于开展进一步的相关研究。

