敲除Rbpj降低小鼠子宫蜕膜对孕酮的敏感性
谢 娟,康劲文,刘晓征,颜婉锟,苏仁伟 (华南农业大学 兽医学院,广东 广州 510642)
哺乳动物通过妊娠为发育期的胎儿提供稳定环境以保护胎儿的生长。孕酮(progesterone,P4)是维持雌性哺乳动物妊娠最重要的甾类激素之一,在妊娠早期,维持妊娠所需的P4几乎全部由卵巢黄体分泌,而妊娠后期P4的主要来源则为发育完成的胎盘[1]。P4通过多种途径执行其维持妊娠的功能,包括促进子宫内膜基质细胞的蜕膜化、将子宫内膜转化为接受态以接受胚胎的着床、抑制母体免疫系统对胎儿的免疫排斥以及抑制子宫肌层的收缩等[2]。蜕膜化是指子宫基质细胞由成纤维状分化为上皮样并成为具有分泌功能的蜕膜细胞的过程,是妊娠的成功建立所必须。蜕膜细胞可为着床后的胚胎发育提供营养物质,调节胚胎滋养层细胞的侵入和胎盘形成,蜕膜还可保护胎儿免受母体产生的免疫反应的侵害。不同程度的蜕膜化受损都会导致胚胎着床失败、早期妊娠丢失、流产或早产[3]。
重组信号结合蛋白Jκ(recombination signal binding protein Jκ,Rbp-Jκ,由Rbpj基因编码)是Notch信号通路的核心转录因子。哺乳动物的Notch信号通路由Notch1~4四个受体、Delta-like1,3,4和Jagged1,2五个配体以及核心转录因子Rbp-Jκ和其他共激活因子组成[4]。当与相邻细胞的配体蛋白结合后,Notch受体接受2次切割后释放其C端裂解产物胞质内结构域(intracellular domain,ICD),该片段是Notch的活性形式,被释放后能够立即转位到核内与转录因子Rbp-Jκ结合并将其转换为转录激活因子,从而启动下游靶基因的转录和表达[5]。Notch信号通路在雌性哺乳动物妊娠过程中起着重要作用,在小鼠妊娠前期的子宫基质细胞蜕膜化过程中,Notch1受体表达增加,抑制Notch信号通路会使蜕膜反应受到影响,并诱导凋亡相关基因的表达[6]。除此之外,Notch信号通路还与P4相互调节,小鼠子宫中Notch1信号的异常激活导致P4受体(progesterone receptor,Pgr)的基因启动子区域甲基化程度增加并引起Pgr表达的降低和不孕[7]。在人子宫内膜异位症病人的异位子宫内膜中,Notch1的异常高表达与PGR表达量的降低具有相关性,可能导致内异症妇女的子宫内膜对P4处理的抵抗[8]。
Rbpj在小鼠胚胎着床和蜕膜化过程中也具有重要的作用,子宫特异性敲除Rbpj会导致着床、妊娠和产后修复异常,而特异性敲除滋养层细胞中的Rbpj则会导致绒毛膜尿囊形态发生异常和滋养层细胞分化不良[9-11]。本研究使用子宫特异性敲除Rbpj基因小鼠,结合人工诱导蜕膜化模型试验,探讨Rbpj影响雌性生殖的机理。
1 材料与方法
1.1 实验动物将Pgr启动子驱动Cre酶表达的PgrCre/+小鼠(由贝勒医学院赠予)与在Rbpj基因21~23外显子两侧添加了Flox位点的RbpjF/F小鼠(由东京大学赠予)杂交,获得子宫特异性敲除Rpbj的PgrCre/+RbpjF/F(简写为Rbpjd/d)或作为对照的Pgr+/+RbpjF/F(简写为Rbpjf/f小鼠。所有小鼠均在华南农业大学实验动物中心SPF级动物房中饲养,自由取食饮水,光照(7:00至19:00)和黑暗(19:00至次日7:00)各12 h,室内温度维持在22~24℃,相对湿度维持在60%~70%。
1.2 缓释管的制作与孵育参考COHEN等[12]所述,并在此基础上修改制备P4缓释管。缓释管由1.5和2.5 cm 2种不同长度的硅橡胶管(内径1.57 mm,外径3.18 mm,Dow Corning,Midland,MI,USA)制备。该硅胶管的管壁上有细小空隙,可以维持释放管中的药物稳定。内套管为普通聚乙烯管(两端共插入0.5 cm)。每个缓释管的有效长度,即两端聚乙烯管之间的长度为有效释放长度,为1或2 cm。称取一定量的P4(Sigma)到芝麻油中配成P4质量浓度为250或500 g/L的白色油-P4混悬液。用1 mL注射器吸取混匀后的混悬液,通过一端的聚乙烯管注入硅胶管中,直到填充整个长度的硅橡胶和聚乙烯管且无气泡,将从硅橡胶管两端突出的聚乙烯末端热密封、备用。使用前将缓释管在90%乙醇中清洗干净,再用蒸馏水清洗,在37℃,1% FBS(1×PBS配制,pH 7.35)中孵育过夜(≥16 h);小鼠麻醉后,缓释管埋植入背部皮下。
1.3 人工诱导蜕膜化蜕膜化模型参考FIONA等[13]方法并稍作修改,如图1所示。将成年的Rbpjd/d雌性小鼠和Rbpjf/f雌性小鼠于6~7周龄切除两侧卵巢后继续饲养2周,以清除体内残余激素。第1~3天每天上午9:00皮下注射0.1 mL的雌二醇(17β-estradiol,E2,Sigma,100 μg/0.1 L),第6天上午8:30将小鼠麻醉后在背部皮下埋植缓释管,之后连续3 d进行皮下注射0.1 mL的E2(6.7 μg/0.1 L)。第8天下午15:00(当天注E2之后6 h)进行单侧子宫人工诱导蜕膜化手术,从小鼠背部一侧开口(非缓释管埋植侧),暴露子宫角,使用7号注射针头在系膜对侧刮擦6~8次,缝合肌肉层和皮肤的手术创口;另一侧作为对照。于术后72或120 h将小鼠麻醉,采集血液,再将小鼠经颈椎脱臼处死,取出子宫,拍照并取材固定。

图1 人工诱导蜕膜化模型示意图
1.4 基因型鉴定剪尾于小鼠出生后的第21~23天进行(PND21~23)。记录小鼠出生信息,给小鼠打上耳标,剪掉5~10 mm的鼠尾组织,保存用于基因型鉴定。
用鼠尾溶解液(tail dissolve buffer,TDB)溶解鼠尾组织。TDB配制方法如下:KCl 0.745 5 g,Tris 0.242 3 g,Triton-X100 200 μL,dH2O定容至200 mL(pH调至9.0)。按每根鼠尾100 μL TDB配置裂解体系,体系中加入2 μL、20 g/L的蛋白酶K,终质量浓度为0.4 g/L。恒温振荡仪60℃振荡加热3 h,转为94℃,15 min后停止;将混悬液室温13 000 r/min 离心5 min,取上清液(鼠尾DNA样品)转入新的离心管中,-20℃保存备用,提取DNA,基因型鉴定 PCR引物见表1。

表1 基因型鉴定PCR引物序列
1.5 HE染色与免疫组织化学小鼠颈椎脱臼法处死后收集子宫,4%多聚甲醛固定,石蜡包埋,切片厚度5 μm。切片经脱蜡复水后进行常规的HE染色。免疫组化脱蜡复水步骤同HE染色,后对切片进行抗原修复,10%马血清封闭后与Rbpj抗体(1∶100)孵育过夜,再进行二抗孵育和DAB染色,脱水封片。
1.6 血清P4浓度的检测小鼠麻醉、眼球采血,4℃过夜后离心取上层血清,分装在离心管中并标记小鼠信息,-80℃储存,血清样本P4浓度由上海研辉生物科技有限公司测定。

2 结果
2.1 确认小鼠子宫中Rbpj的敲除成功
2.1.1基因型鉴定 以4只小鼠的鉴定结果为例,PgrCre/+和Rbpj基因型鉴定结果如图2所示,在PgrCre/+基因型PCR鉴定中,只扩增出WT(302 bp)条带而无Cre(522 bp)条带的为基因型Pgr+/+(A0462和A0495),同时含有Cre条带和WT条带的基因型为PgrCre/+(A0508和A0512)。在Rbpj基因型的扩增结果中显示,4只鼠都扩增出Rbpj-Flox条带(600 bp),而无Rbpj-WT条带(500 bp),证实这些小鼠的基因型均为RbpjF/F。综上所述,A0462和A0495的基因型为Pgr+/+RbpjF/F(Rbpjf/f),作为对照组;其余的基因型为PgrCre/+RbpjF/F(Rbpjd/d),为子宫特异性敲除Rbpj小鼠,将其作为试验组。

A.PgrCre/+小鼠的基因型鉴定;B.RbpjF/F小鼠的基因型鉴定 M.DL1000 DNA Marker;1.A0462;2.A0495;3.A0508;4.A0512;5.阴性对照
2.1.2Rbpj转录因子在敲除鼠子宫中表达量降低 将确认过基因型的雌性小鼠与已知可育的雄性小鼠合笼,以见到阴道栓为妊娠第1天。免疫组织化学结果如图3所示,在妊娠第8天的子宫中,相比于Rbpjf/f小鼠,Rbpjd/d小鼠Rbp-Jκ的蛋白水平表达量在胚胎周围的基质中明显降低,证明子宫特异性敲除Rbpj成功。
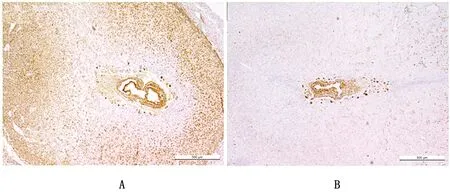
A.Rbpjf/f小鼠子宫;B.Rbpjd/d小鼠子宫(500 μm)
2.2 子宫特异性敲除Rbpj小鼠对P4敏感性的影响首先测试能够维持野生型小鼠蜕膜化所需的正常P4剂量下Rbpjd/d小鼠对人工诱导蜕膜化的响应能力。结果表明,在此剂量下(1 cm+250 g/L P4),虽然对照组Rbpjf/f小鼠的子宫可以正常响应人工诱导蜕膜化刺激(图4A),但Rbpjd/d小鼠子宫在术后120 h已无法维持蜕膜化状态(图4B)。Rbpjd/d小鼠的蜕膜侧子宫相较Rbpjf/f小鼠的同侧子宫细且颜色更深;HE染色结果显示,Rbpjf/f小鼠蜕膜仍然完整,而Rbpjd/d小鼠的蜕膜组织已经开始脱落,脱落组织剥落进子宫腔中,坏死伴有出血现象(图4)。术后72 h的蜕膜化情况如图5A所示,在1 cm+250 g/L P4剂量组,与对照侧子宫角相比,Rbpjf/f小鼠蜕膜侧子宫角体积肿大且充血呈粉红色;相比之下,Rbpjd/d小鼠蜕膜侧子宫角体积明显小于对照组,且有部分敲除鼠未成功蜕膜化。对蜕膜侧/对照侧子宫角的重量比分析发现,Rbpjd/d小鼠的蜕膜化程度显著小于Rbpjf/f小鼠(图5A)。HE染色显示Rbpjf/f小鼠子宫的蜕膜明显大于敲除鼠的子宫蜕膜;在Rbpjf/f小鼠子宫中,被蜕膜化组织包裹的上皮部分完整呈柱状(图5C)。而在敲除鼠中,系膜侧附近的子宫基质细胞有较大部分并没有发生蜕膜化,腔上皮完整,这可能是造成子宫体积偏小的原因之一(图5C)。此外,与Rbpjf/f小鼠(n=106)对人工诱导蜕膜化刺激100%的响应率相比,Rbpjd/d小鼠(n=100)的蜕膜化响应率仅为88%,低于对照组的成功率(图5B)。
2.3 高剂量P4可以部分挽救Rbpj敲除导致的蜕膜化能力下降为了测试高剂量的P4是否可以挽救Rbpj敲除导致的蜕膜化能力下降,将试验所用P4质量浓度提高为500 g/L,并且将缓释管的有效长度提高为2 cm(2 cm+500 g/L P4)。结果显示,在人工诱导蜕膜化术后72 h,Rbpjd/d小鼠的蜕膜化程度和蜕膜重量仍然显著低于Rbpjf/f小鼠(图5F~G)。但是,在提高P4剂量后,2种基因型小鼠蜕膜重量之间的差异明显变小(图5E,H)。在术后120 h,与Rbpjf/f小鼠相比,Rbpjd/d小鼠子宫的蜕膜化程度仍较低,且出现大面积坏死和出血,与基底层界限清晰,仅在系膜侧可见小部分形态完整的蜕膜化细胞,表明中心蜕膜组织即将从边缘脱落(图5C,D)。但与低剂量P4组相比,高剂量P4组Rbpjd/d小鼠子宫蜕膜化程度已有明显改善(图4B,D)。无论是低剂量还是高剂量P4组,缓释管在试验结束取出时仍存有大量P4的残余,证明Rbpjd/d小鼠蜕膜化的维持与P4的总量无关,而与缓释管的有效长度有关,随单位时间内释放的P4量增大,更有助于敲除鼠蜕膜化的维持。

A,B.1 cm+250 g/L P4条件下的子宫;C,D.2 cm+500 g/L P4条件下的子宫;A,C.Rbpjf/f小鼠;B,D.Rbpjd/d小鼠;(100 μm)
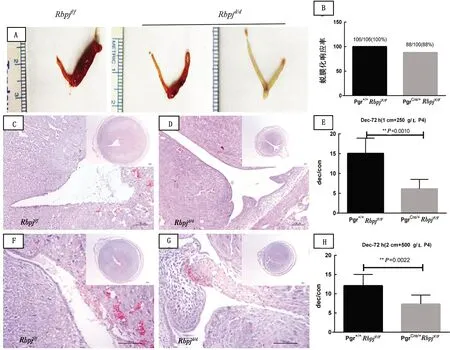
A,C,D,E.1 cm+250 g/L P4条件下子宫;F~H.2 cm+500 g/L P4条件下子宫;C,F.Rbpjf/f小鼠;D,G.Rbpjd/d小鼠;(100 μm);B.蜕膜化成功率
2.3.1不同P4剂量和基因型对蜕膜侧与对照侧子宫重量比的影响 进一步对所有试验组和对照组小鼠两侧子宫角的质量比进行分析,发现在术后120(图6A)和72 h(图6B),相同剂量P4下Rbpjd/d小鼠与Rbpjf/f小鼠相比,子宫重量比都有显著降低。然而,不同剂量P4组中的Rbpjf/f小鼠子宫质量比值无明显差异,但Rbpjd/d小鼠在术后120 h时在高剂量P4组的蜕膜程度显著高于低剂量组(图6A)(P<0.05)。在500 g/L P4中,敲除鼠(2 cm缓释管)和对照鼠(1 cm缓释管)的蜕膜化程度较接近(图6C),进一步证明敲除鼠对P4的依赖性更强,高剂量的P4可以挽救因Rbpj敲除导致的蜕膜化程度降低。

A.术后120 h;B.术后72 h;C.500 g/L P4,不同长度缓释管,术后72 h
2.3.2Rbpjd/d小鼠对P4的消耗量 对小鼠血清中的P4质量浓度进行检测后发现,2 cm+500 g/L P4在术后120 h时,敲除鼠血清中的P4质量浓度显著低于对照鼠血清中的质量浓度(图7),这表明Rbpj敲除鼠可能对P4需求更大。
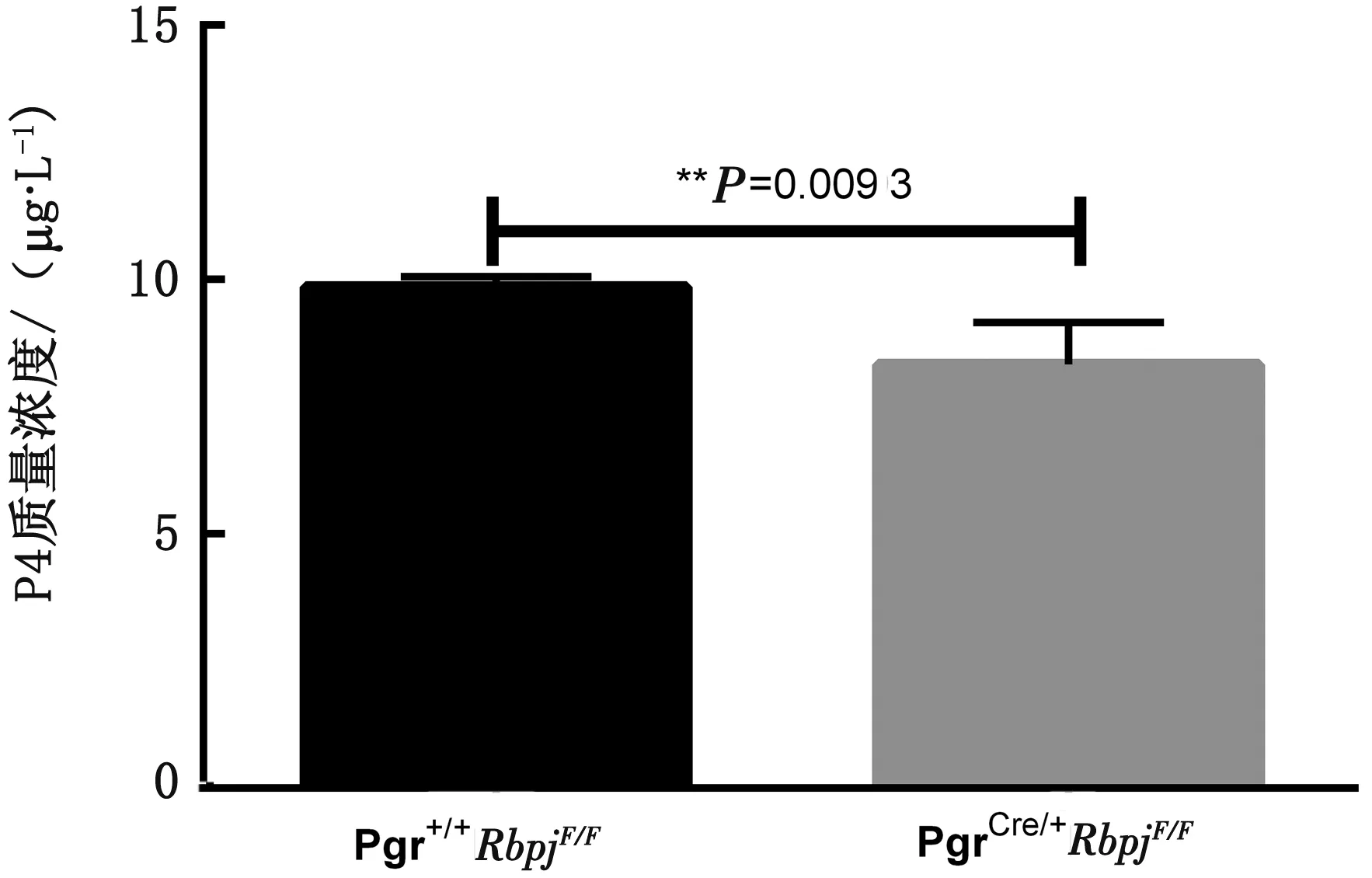
图7 血清中P4浓度
3 讨论
3.1Rbpj敲除小鼠对蜕膜化的反应能力下降经典的Notch信号通路通过其核心转录因子Rbpj激活下游靶基因来介导重要的细胞分化和个体发育功能,包括器官的自我更新[14]。全身性Rbpj缺失会导致妊娠早期胚胎致死,而子宫特异性敲除Rbpj小鼠则因胚胎着床角度异常而导致妊娠的丢失[9,15]。此外,子宫特异性敲除Rbpj小鼠的子宫内膜产后修复能力受到显著影响,从而导致继发性不孕[10]。
有研究表明,Rbpj敲除小鼠的子宫对人工诱导蜕膜化的响应能力下降,但该研究采用皮下注射方式给予P4,不能精确的控制不同小鼠间单位时间内释放到血液中的P4剂量[16]。本研究中使用缓释管方式,通过控制有效长度精确地控制单位时间内释放到血液中的P4剂量,使其在不同小鼠之间尽量保持一致,同时也能保证P4稳定释放,避免皮下注射P4带来的血清P4浓度的剧烈波动。研究结果表明,在相同P4剂量下,无论是高剂量还是低剂量P4组,Rbpj敲除小鼠的子宫对人工诱导蜕膜化的响应能力都显著低于对照组小鼠,与上述的研究结果一致。本研究的每种基因型小鼠的样品数量超过100只,结果更接近真实情况。本研究还进一步发现敲除小鼠蜕膜化能力受损的原因是系膜对侧部分基质细胞未能成功发生蜕膜化。
3.2Rbpj敲除影响小鼠P4受体表达和对P4的利用P4对子宫内膜蜕膜化的建立和维持至关重要,P4受体Pgr及P4靶基因如Ihh和Hoxa10等敲除小鼠均表现为蜕膜化能力的丧失或下降[17-18]。在妊娠早期,卵巢黄体是P4的主要来源。而将黄体与Notch信号通路抑制剂DAPT一起孵育时,P4合成量减少,表明Notch信号通路对P4的合成至关重要[20]。此外,在子宫中过度激活Notch信号通路还会导致P4受体Pgr的下调,说明Notch信号通路还可以通过调节Pgr的表达影响P4信号通路的活性[8]。人子宫成纤维细胞的体外试验研究中证实,P4处理能够促进Notch1受体蛋白胞质内区的剪切,从而诱导其活性形式N1ICD的上调[21]。诸多研究表明,无论是在卵巢还是子宫中,Notch信号通路与P4以及P4受体之间存在一定的联系,在哺乳动物的蜕膜化和妊娠过程中相互调节。
在先前的研究中,Rbpj敲除小鼠蜕膜中P4受体Pgr的表达量下调,这很可能是敲除小鼠在相同剂量的P4作用下蜕膜化能力下降的原因之一[16]。除此之外,研究结果还表明,在给予同样剂量和有效长度的P4缓释管的情况下,Rbpj敲除小鼠的血清P4浓度显著低于对照小鼠,表明作为P4的重要靶器官,子宫内膜中的Rbp-Jκ对于P4的代谢也有一定的影响。但是,该影响的具体作用机制还需要进一步的探索。
3.3 高剂量P4可部分挽救Rbpj敲除导致的蜕膜化能力下降研究表明,P4的剂量对子宫内膜蜕膜化的维持至关重要,在不同P4水平下,子宫蜕膜崩解出血的时间随P4水平的升高而延迟[22]。本研究中的缓释管给药法保证单位时间内释放到小鼠体内的P4水平与缓释管的有效长度呈线性正相关,并证明低剂量的P4对于对照组子宫内膜的蜕膜化维持已经足够,但是在敲除鼠中子宫内膜蜕膜化无法维持到120 h。而提高P4剂量则可以有效的缓解因Rbpj敲除引起的蜕膜化损伤和维持障碍。但是在高剂量P4组,敲除小鼠子宫内膜的蜕膜化程度依然低于对照组小鼠。这些研究结果表明,提高P4剂量可以部分挽救因缺失Rbp-Jκ造成的小鼠子宫内膜对人工诱导蜕膜化能力降低,但不能完全挽救。进一步分析表明,虽然无论使用1还是2 cm的缓释管,在相同P4剂量下敲除小鼠的蜕膜化反应程度都显著低于对照小鼠,但敲除小鼠在高剂量P4情况下的蜕膜化程度与对照小鼠在低剂量P4情况下的较为接近,进一步证明相对于对照小鼠,敲除小鼠蜕膜对P4的依赖性更强,但敏感性更低。
综上所述,Notch信号通路核心转录因子Rbpj缺失会导致小鼠的蜕膜化能力下降,蜕膜子宫对P4的敏感性降低且具有剂量依赖性,可以通过提高P4剂量的方式加以部分挽救。其详细调节机制有待于进一步的研究和探索。

