猪瘟、非洲猪瘟和猪水泡病毒多重荧光RT-PCR同步检测和鉴别诊断方法的建立及应用
史喜菊,刘艳华,马贵平,李炎鑫,刘全国,赖平安,高志强,徐立伟 (北京海关,北京 100026)
我国自2018年发生非洲猪瘟疫情后,对活猪和猪肉制品的进口量剧增,为了保障进出口产品的安全性,出入境的活猪和猪肉制品都要经过严格检疫。目前检疫的主要猪病都是对养殖业危害巨大、OIE重点关注、世界各国重点防控的疫病[1-3]。现有检测方法基本还是针对单个病原的单一检测,会造成漏检。而且,进境动物经过长途运输后,在隔离检疫期间可能会出现一些临床疾病,很多病原都可以引起相似的临床症状,现有单一检测技术难以全面、真实地反映畜禽感染状态和发病死亡原因[1-2]。因此,建立可同时检测多重疾病的多重检测技术一直是口岸和各级兽医卫生防疫机构研究工作的重点。本试验是在前期建立的多病原同步检测技术基础上[2-4],进一步以古典猪瘟病毒(classical swine fever virus,CSFV)、非洲猪瘟病毒(African swine fever virus,ASFV)和猪水泡病病毒(swine vesicular disease virus,SVDV)为研究对象[2,5-10],建立了可用于这3种病毒混合感染检测和鉴别诊断的多重荧光PCR方法。
1 材料与方法
1.1 试验材料CSFV、ASFV和SVDV阳性质控品均为本实验室制备并保存的体外反转录cRNA或者重组质粒[2-3,9]。测试所用的CSFV、ASFV及猪圆环病毒2型(PCV2)、伪狂犬病病毒(PRV)、猪细小病毒(PPV)、传染性胃肠炎病毒(TGEV)、猪繁殖与呼吸综合征病毒(PRRSV)、猪流感病毒(SIV)、O型口蹄疫灭活病毒(FMDV)和水泡性口炎病毒(VSV)均为本实验室制备的核酸样质控品[3]和检测留样。
1.2 试剂克隆载体和体外转录试剂均为Promega公司产品;Ex-Taq PCR试剂为TaKaRa公司产品;Path-IDTMMultiplex one-step RT-PCR Kit为AB公司产品;TIANamp Virus DNA/RNA Kit为天根生化公司产品;探针、引物由TaKaRa(大连宝生物)公司合成。
1.3 引物和探针设计与合成下载GenBank中现有CSFV、ASFV和SVDV所有分离株基因,使用CLCMain Workbench 7.0.3和BioEditor 1.6.1分析软件进行多重比较,分别选取CSFV的5′UTR基因片段、ASFV的VP72基因片段和SVDV的5′UTR基因片段作为扩增靶基因,根据多重荧光RT-PCR特点分别设计并筛选出能覆盖大部分分离株、又适合多重检测并可以区分的引物和探针(表1)。引物和探针均由TaKaRa(大连宝生物)合成,用灭菌水稀释成100 mmol/L储藏液,-20℃保存备用。
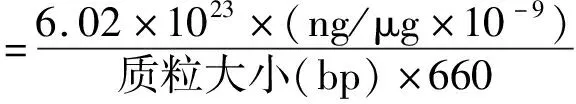
1.5 多重荧光RT-PCR反应体系将引物和探针储备液按照引物终浓度400 nmol/L和探针终浓度200 nmol/L的要求分别进行10倍稀释和混合,引物混合液包括5条CSFV引物、5条ASFV引物和2条SVDV引物共12条,探针混合液包括2条CSFV探针、1条ASFV探针和1条SVDV探针共4条(表1),按照表2配制反应体系,将混合液充分混合后,最后加入模板,简短离心,按照表3的反应程序进行荧光PCR反应,所用设备为BioRad公司的CFX-96。

表1 CSFV、ASFV和SVDV的一步法多重荧光RT-PCR检测引物

表2 一步法多重荧光PCR反应体系

表3 一步法多重荧光PCR反应程序
1.6 标准曲线绘制和最低检测限的确定分别将已知浓度的CSFV、ASFV和SVDV阳性质控品进行10倍梯度稀释后进行荧光RT-PCR反应,用模板浓度对数与对应的荧光Ct值做单重荧光RT-PCR浓度标准曲线,最高稀释倍数能检测出的Ct值所对应的浓度即为单重荧光RT-PCR最低检测限。
再将已知浓度的CSFV、ASFV和SVDV阳性质控品等量混合后,进行10倍梯度稀释进行多重荧光RT-PCR反应,按1.6步骤检测最低检测限。
1.7 特异性测试选择实验室制备的8种猪病毒质控品(表4),分别用CSFV、ASFV和SVDV的引物和探针进行单重荧光RT-PCR,验证引物和探针的特异性;用建立的多重荧光RT-PCR反应体系对表4中的8种病毒质控品进行检测,验证引物和探针混合后多重反应体系的特异性。

表4 特异性试验用到的病毒质控品
1.8 多重荧光RT-PCR和单重荧光RT-PCR的比较将CSFV、ASFV和SVDV阳性质控品等量混合后进行10倍梯度稀释,分别进行多重荧光RT-PCR和CSFV、ASFV和SVDV单重荧光RT-PCR,将相同浓度模板对应的荧光Ct值进行比较,求解回归方程,比较多重荧光RT-PCR和各单重荧光RT-PCR的符合性。
1.9 样品验证和测试建立的多重荧光RT-PCR测试中国兽药监察所猪瘟参考实验室提供的CSFV核酸20份,委托美国农业部外来动物疫病中心(USDA)测试了ASFV毒株5株、各3个浓度梯度,与中国动物卫生与流行病学中心非洲猪瘟参考实验室进行10份阳性样品测试比对。对实验室近2年收集的200份血液及300份肉制品提取病毒总核酸进行临床样品验证,并与单重荧光RT-PCR进行比较。
2 结果
2.1 阳性质控品定量结果将制备好的阳性质控品,分别用紫外分光仪测定其D260和D280值并计算出质粒拷贝数(表5)。
2.2 标准曲线和最低检测限分别用CSFV、ASFV和SVDV质控品做浓度标准曲线,结果如图1。从图1可以看出,标准曲线PCR扩增效率E值、R2和曲线斜率均在正常范围内,说明扩增效率良好。将模板进行10-11稀释仍能检测到荧光信号,根据表5浓度,计算出对应的最低检测限为8.8~13.0拷贝/μL。

表5 阳性质控品浓度测定

图1 荧光RT-PCR标准曲线 A.CSFV;B.ASFV;C.SVDV
CSFV、ASFV和SVDV混合质控品做多重荧光RT-PCR标准曲线,从图2可以看出,多重荧光RT-PCR扩增效率E值分别为103、107和110,R2值分别为0.984、0.986和0.989,曲线斜率均在正常范围内,说明扩增效率并没有受到多重干扰。相同稀释倍数对应的Ct值比单重荧光RT-PCR略有升高,但不构成显著性差异,最低检测限仍然可达10拷贝/μL。

图2 CSFV、ASFV和SVDV多重荧光RT-PCR标准曲线
2.3 特异性检测结果单个病毒的引物和探针只能扩增出各自的病毒核酸,其他病毒模板扩增均为阴性,表明所设计的引物和探针特异性良好。利用建立的多重荧光RT-PCR方法对表4中的病毒进行检测,结果仅CSFV、ASFV和SVDV有扩增曲线,其他病毒均无特异性扩增信号,表明所建立的方法特异性良好,多重并没有对特异性产生干扰。
2.4 多重荧光RT-PCR和单重荧光RT-PCR的比较利用相同浓度的混合模板同时进行多重荧光RT-PCR和单重荧光RT-PCR的符合性测试,回归方程计算结果表明,CSFV、ASFV和SVDV单重荧光RT-PCR与多重荧光RT-PCR的相关性系数R2分别为0.9988、0.9978和0.9976,说明多重荧光RT-PCR和各单重荧光RT-PCR的符合性良好,对于相同浓度的模板,其Ct值基本一致,所有引物和探针放在一个反应体系混合后并没有相互干扰(图3)。
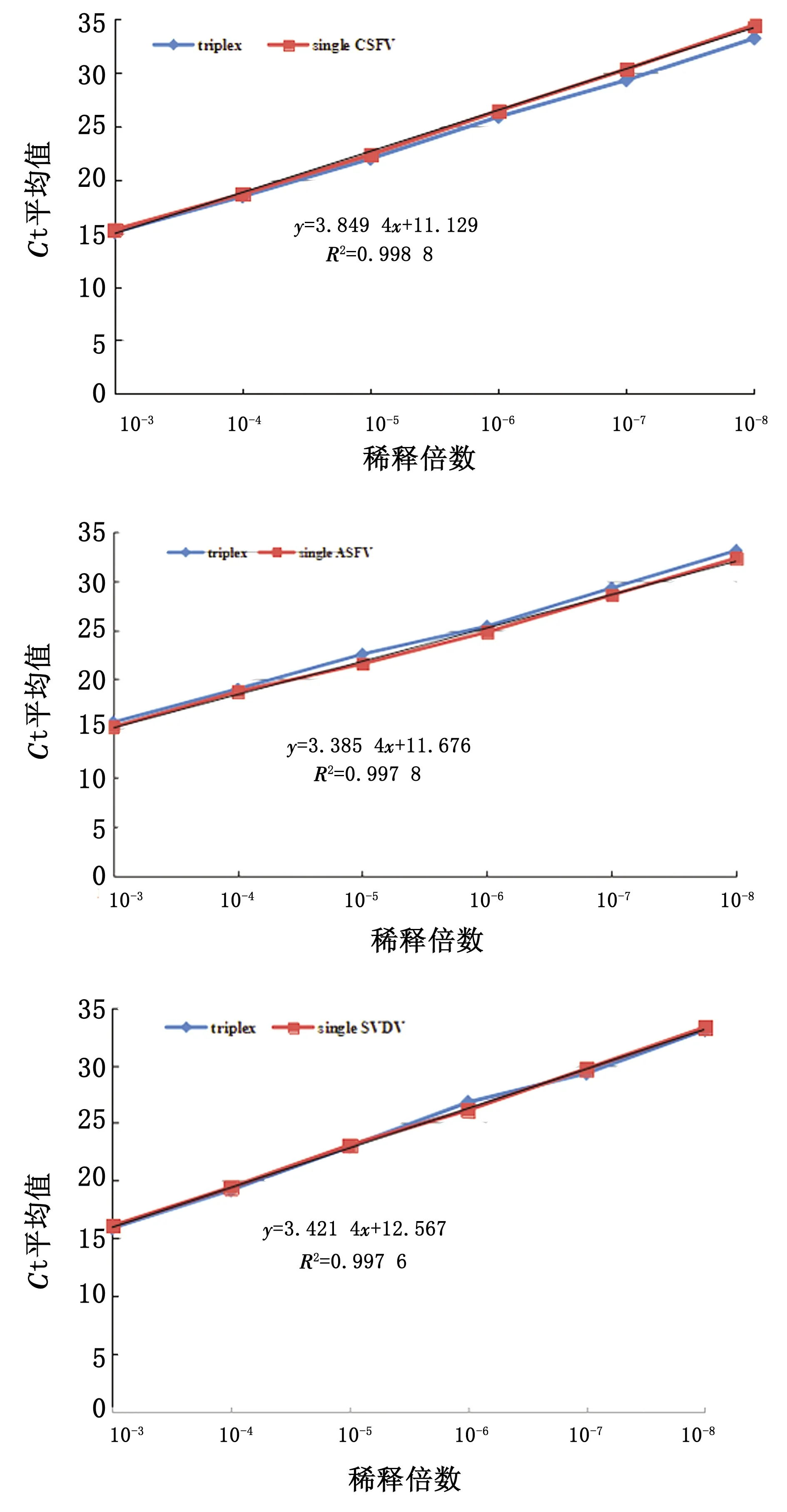
图3 多重荧光RT-PCR与单重荧光RT-PCR的比较
2.5 样品验证结果本研究建立的多重荧光RT-PCR对国家猪瘟参考实验室提供的20份阳性样品进行测试,100%符合。本检测方法经USDA测试,5株ASFV毒株各3个浓度梯度,结果全部阳性;本实验室检测出的10份阳性样品经与国家非洲猪瘟参考实验室检测,结果全部一致。从200份血液中检测出ASFV阳性8份,从300份肉制品中检测出ASFV阳性10份,CSFV和SVDV检测均是阴性,与单重荧光RT-PCR检测结果一致,没有检测到混合感染。
3 讨论
针对单个病原检测的荧光PCR技术目前已相当成熟,广泛用于动物疫病检测领域[9,11],但是对于多重荧光PCR,由于对引物和探针设计的技术要求很高,目前并没有成熟的方法可用。有很多学者已建立多种普通多重PCR检测法[12],而敏感性显然不能满足筛选试验的要求[1,4,10,13-14],也有研究建立多重荧光PCR,但敏感性和特异性没有达到预期[8,13-17]。本研究针对目前单一病原检测方法的不足,建立了CSFV、ASFV和SVDV 3种病毒一步法多重荧光RT-PCR检测和鉴别方法。
现有荧光PCR大多是1个靶基因设计1对引物和1个探针,病毒靶基因经常容易发生变异,需要不断更新引物和探针序列。本研究设计引物和探针时针对现有CSFV和ASFV序列,分别设计5条引物,基本可以覆盖现有CSFV和ASFV分离株,针对CSFV还设计了2个探针,更增加了方法兼容性和涵盖性。但是在同一个反应体系中混合多条引物和探针,互相之间的干扰又是一个难题,本研究从设计的众多序列中进行配对筛选,经过RNA-RNA引物二级结构等测试和筛选,最终选择了上述序列。
通过浓度荧光标准曲线可以看到,不论是单重荧光RT-PCR还是多重荧光RT-PCR,其标准曲线显示PCR扩增效率E值均在正常范围,R2>0.98,曲线斜率也正常,说明扩增效率很高,体系中各成分浓度搭配恰当。
敏感性测试结果表明,与各病原单重荧光RT-PCR相比,对于相同浓度的模板,多重荧光RT-PCR扩增所得Ct值略有升高,但差异不显著,计算所得最低检测限仍然可达10拷贝/μL,与之前的荧光PCR技术的敏感性指标一致[2,17-18]。
特异性测试结果表明,本研究建立的多重荧光RT-PCR引物和探针特异性均为100%,不管是单病原模板,还是3个病原混合模板,单特异性引物和探针和多重混合引物和探针均只能扩增出自己的目标病原。而且,用实验室建立的其他8种猪病毒阳性质控品测试,均未见任何非特异性扩增。说明上述设计的15条引物和4个探针放在同一个多重反应体系并没有产生干扰,特异性很强,克服了多重PCR的固有不足[12]。
多重荧光RT-PCR与单重荧光RT-PCR比较分析表明,对于同一浓度模板,多重荧光RT-PCR分别与各自单重荧光RT-PCR扩增得到的Ct值相关性非常高,R2均大于0.99,再次证明了引物和探针的混合并没有产生相互干扰,没有影响扩增效率。据报道,三重荧光PCR可以达到与单重荧光PCR相等的指标参数,但是四重以后敏感性和特异性均会受到不同程度的影响[2,12,17]。本研究也曾尝试加入第4种病原,四重荧光RT-PCR标准曲线指标参数很难都落在合理范围内(未公开发表),说明产生了干扰,敏感性会降低。
在方法验证过程中,本研究建立的多重荧光RT-PCR方法用国家猪瘟参考实验室提供的20份CSFV核酸样品进行验证,100%符合。USDA测试的样品包括5株ASFV毒株,每个毒株设了3个不同浓度梯度,结果均为阳性。本次检测的10份阳性样品送到国家非洲猪瘟参考实验室确诊,结果完全相同。在临床样品测试中,分别使用了200份血液和300份猪肉制品,筛选出ASFV阳性样品8份(8/200)和10份(10/300),这与前2年我国ASF疫情暴发有关,有的动物也许处于隐性感染或者康复带毒状态。CSFV和ASFV临床症状相似,在感染野猪群中也发现了2种病原可以共存[6],但本研究没有检测到共感染样品。一方面说明CSFV得到了很好的控制,另一方面可能也与采样部位有关,CSFV常见于各种淋巴组织和处于病毒血症期的血液中[6,11,13],而SVDV很多年在我国并未见报道。

