同步分离培养大鼠肝星状细胞和枯否细胞的方法研究
陈峰杰
河南护理职业学院,河南 安阳 455000
肝星状细胞与枯否细胞作为肝内重要的非实质性细胞,也是肝纤维化的主要效应细胞,有促进肝纤维化进程的作用。活化的HSCs是肝纤维化发生的关键细胞和核心环节[1],可转化为肌成纤维细胞并分泌多种受体,生成大量细胞外基质,促进肝纤维化进程。KCs 可通过分泌的多种细胞因子,促使HSCs活化,参与肝纤维化过程。由于体内环节复杂多变,容易受神经、体液等多因素的影响,体外提取培养原代HSCs与KCs就显得尤为重要。现实中HSCs仅仅占肝非实质细胞总数20~30%[2],KCs仅占25~40%[3],KCs和HSCs的形态、密度与其它肝非实质细胞非常接近,一直以来同步提取大鼠原代KCs和HSCs较难。自1982年Knook[4]报道提取肝星状细胞方法后,国内相继报道了多种改良的分离与提取方法[5-8],但多数报道中的提取方法为单一细胞的分离培养[9-10],多数方法存在分离过程繁琐,成本高,细胞得率与纯度低等问题。因此,建立简便经济的大鼠原代HSCs与KCs同步分离培养方法,是研究HSCs活化、肝纤维化发生机制的前提与基础性工作。
1 材 料
1.1实验动物 SD大鼠,清洁级,体重400-450g,购自山西医科大学动物中心,普通饲料喂养。
1.2主要试剂 链酶蛋白酶、a-SMA抗体购自Sigma公司;Ⅳ型胶原酶购自Invitrogen公司;DNA酶购自北京索莱宝公司;Nycodenz购自Axis-Shield Pocoslo公司;DMEM培养基购自Gibco公司;RPMI1640购自美国HyClone公司;胎牛血清购自杭州四季青;Desmin抗体、武汉博士德公司的SABC免疫组织细胞化学试剂盒。
1.3主要仪器 Milli-Q Biocel超纯水系统、Jouan IGO-150 CO2培养箱、生物倒置显微镜。
2 方 法
2.1大鼠门静脉插管,链酶蛋白酶及胶原酶液原位灌注 SD大鼠,禁食12h后乙醚吸入麻醉,固定大鼠并用碘伏消毒腹部皮肤,呈“U”型剪开腹部,充分暴露肝脏、肝门静脉,肝门静脉插管并牢固固定导管,39℃前灌注液,20mL/min,灌注12-15min,剪开大鼠下腔静脉,灌注的同时按摩灌注不良处,肝脏变白时游离肝脏。40℃链酶蛋白酶,5mL/min,灌注 25min,之后灌注37℃Ⅳ型胶原蛋白酶液,10mL/min,30min。
2.2密度梯度离心,制备混合细胞悬液 将循环灌注后的肝脏,移入超净工作台,去除表面被膜,加4mL DNA酶液和振荡液,200-250次/min,37℃摇床恒温振荡30min。加入20mLDMEM液,过滤细胞悬液并收集上清液,10-15℃,1700r /min,离心5min。洗涤3次的细胞悬液中加入DMEM液,沿管底依次缓慢加入10.387%Nycodenz和18.8%的Nycodenz密度梯度液,10℃,20000r/min,离心25min。离心后可见在同一离心管中,因密度不同,原先的细胞悬液中出现明显分层,HSCs与KCs位于细胞悬液的不同层面。
2.3HSCs与KCs同步分离纯化 依据细胞分层情况,平头针依次吸取位于不同层面的HSCs与KCs。DMEM 10-15℃,2000 r/min,5min离心洗涤HSCs三次,20%胎牛血清DMEM悬浮HSCs,用RPMI 1640 10-15℃,2000 r/min,5min离心洗涤KCs三次,用含10%胎牛血清的RPMI 1640悬浮KCs。
2.4台盼兰拒染实验判定细胞得率与活率 取10μL细胞悬液与10μL台盼兰充分重复吹打混匀,取10ul加到计数板凹槽,镜下计数活细胞,台盼兰着色者为死细胞,未着色者为活细胞,计算细胞得率和活率。细胞悬液标本测定2次,取两次均值。
2.5细胞培养 刚分离的HSCs与KCs分别按2.5×105/mL、1×106/mL密度接种,每孔加1mL细胞悬液,37℃、5% CO2培养箱培养。6h后吸弃KCs培养基,换成10%胎牛血清RPMI 1640培养液。48h后吸弃HSCs培养基,换含10%胎牛血清的DMEM培养液,每2-3d更换一次HSCs与KCs的培养液。
2.6细胞鉴定 使用Desmin及a-SMA抗体免疫细胞化学法鉴定原代培养7d的HSCs,SABC法免疫细胞化学染色。原代培养48h的KCs印度墨汁吞噬实验验证细胞吞噬能力,免疫细胞化学法鉴定KCs内溶菌酶表达情况。
3 结 果
3.1细胞形态观察 镜下可见,刚分离的HSCs可呈圆形、椭圆形,胞质内富含脂滴,折光性强,。24h后多数的HSCs贴壁。48h后少数HSCs伸出伪足,呈星形或多边形。培养5d后的HSCs呈星形,细胞相互融合成片状。7d 后HSCs内脂滴消失,多数细胞呈星形,部分融合呈片状。培养14d 的HSCs,细胞完全伸展,呈现典型的成纤维细胞形态,胞质内有细胞骨架。新分离的KCs呈圆球形,大小均匀一致。4-6h后呈扁圆形,大部分细胞贴壁,少量伸出突起。24h后的KCs体积增大明显,外观呈圆形、三角形或星形。48h后KCs胞质内出现大量脂滴,核呈肾形。72h的KCs开始伸出伪足。培养7d的KCs完全伸展,甚至呈梭形。
3.2免疫细胞化学法鉴定所得细胞 a-SMA与Desmin免疫细胞化学染色后,可观察到HSCs的胞浆呈棕黄色(见图1)。溶菌酶免疫细胞化学染色后的KCs呈阳性,胞质内沉积的棕黄色颗粒清晰可见(见图2),表明本实验成功同步分离培养了HSCs与KCs。静止期与活化的肝星状细胞均表达Desmin,仅活化的HSCs表达a-SMA。
3.3墨汁吞噬实验来鉴定KCs吞噬能力 KCs以RPMI1640培养48h后,用少量印度墨汁加入KCs进行吞噬实验验证KCs吞噬能力。镜下可见,KCs体积增大,胞质内大量碳素墨汁颗粒围绕在细胞核周围,表明分离培养的细胞KCs具有吞噬活性。
4 讨 论
本实验使用酶原位灌注消化和密度梯度离心相结合的两步法。通过离体灌流链霉蛋白酶去除肝脏实质性细胞即肝细胞、Ⅳ型胶原酶去除胶原纤维,提高细胞得率和纯度。HSCs与KCs密度有一定交叉,密度梯度离心液的选取和配置尤为关键。经过对比,本实验使用的密度分离介质为 Nycodenz,具有性质稳定,配制简单、价格适中的优势。10.387%与18.8%Nycodenz密度梯度离心后HSCs与KCs位于细胞悬液不同层次,细胞分离界面清晰,通过一次实验即可同步分离上述两种原代细胞。而且提取的原代细胞与体内差异较小,可以很大程度反映细胞在体状态。
本实验所建立的HSCs和KCs同步分离培养方法,简便经济,又无需特殊设备和昂贵试剂,分离培养的原代HSCs与KCs生物学性状良好,细胞得率、活率和纯度高,达到后续实验要求。该方法对于研究HSCs、KCs的生物学行为,KCs分泌细胞因子对于HSCs的作用及肝纤维化机制的研究奠定了细胞学基础,值得推广和广泛使用。

图1 培养7天的HSCs desmin免疫细胞染色(DAB显色,×400)
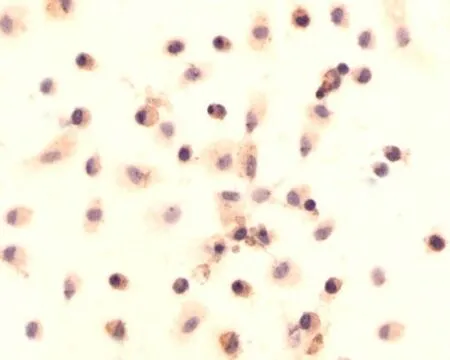
图2 KCs培养48h后溶菌酶免疫细胞化学(DAB显色,×400)

