土壤中稀有放线菌选择性分离方法
刘莲娜,刘淑艳,王梦珂,徐 婷,李亚宁
(1.河北北方学院 医学检验学院,河北 张家口 075000;2.河北农业大学 植物保护学院,河北 保定 071001)
放线菌是抗生素及其它生物活性物质的主要生产者,作为一类重要的功能性微生物资源,日益受到科研工作者的关注。放线菌可以产生多种类型的抗生素、抗肿瘤物质、免疫抑制剂等。世界上已发现的抗生素大约有三分之二是由放线菌产生的,其中70%以上由链霉菌产生[1-3]。越来越多的链霉菌被重复发现,使得从链霉菌中获得新的活性物质的几率越来越低。为了获得新的物种并从中分离得到新的活性代谢产物,人们逐渐将研究对象转为稀有放线菌(rare actinomycetes)[4-5]。稀有放线菌通常指非链霉菌,采用常规分离手段进行分离,其分离频率远低于链霉菌。近年来,随着新的选择性分离方法及基因技术的开发,稀有放线菌的分离数量不断增加。稀有放线菌的分离,不仅可以减少对菌株的重复分离,还可以发现更多生物活性物质,为新药的研发奠定基础。
自然界的绝大多数稀有放线菌难以纯培养。对稀有放线菌资源进行勘探,并设计有效的稀有放线菌分离方法对发现放线菌新种属至关重要。土壤中稀有放线菌选择性分离方法包括对土壤样品进行预处理与富集、抑制剂的添加、培养基的设计等,本文对此作一综述,以期为科研人员分离稀有放线菌提供参考。
1 样品预处理
从土壤中选择性分离稀有放线菌,土样预处理尤为关键。土样预处理不但可以抑制一部分包括细菌和真菌在内的非目的菌的生长,还有利于稀有放线菌孢子的萌发,提高目的稀有放线菌的出菌率。土样预处理方法不同,稀有放线菌的分离效果也不同。
1.1 物理手段
物理处理包括自然风干、热处理、分散和差速离心法(dispersion and differential centrifugation,DDC)、密度梯度离心法、微波、超声波、极高频辐射法(extremely high frequency radiation,EHF)、电脉冲及紫外线照射等。
1.1.1 自然风干 土壤风干20 d,可使90%以上的细菌死亡。很多学者对土壤进行自然风干处理,从土壤中分离得到了不同种类的稀有放线菌。樊炳君等[6]将土壤样品在无菌条件下风干,分离得到小单孢菌属(Micromonospora)和野野村氏菌属(Nonomuraea)。田华[7]发现土壤样品风干6 d,可从中分离得到较多的放线菌。康萍芝[8]的研究结果表明,风干处理土样7-10 d,放线菌的分离效果较好,分离到的放线菌数量和种类较多,且易于纯化,杂菌明显减少。
1.1.2 热处理 热处理包括干热处理和湿热处理,干热处理是普遍使用的预处理方法[9-10]。对土壤100 ℃或120 ℃干热处理1 h,可以有效分离多种稀有放线菌[11]。李载渊[12]对五指山原始林区采集的土样120 ℃干热处理1 h,分离得到了90株稀有放线菌。在50~70℃条件下,对土壤悬浮液加热处理一定时间(5~20 min)即为湿热法。该法可促使稀有放线菌孢子萌发,有利于稀有放线菌的分离[13]。Niyomvong等[14]对样品同时进行湿热处理(50℃,6 min)和干热处理(120℃,1 h),同时采用1.5%苯酚预处理样品,可减少非目的细菌的数量,提高选择性分离多种稀有放线菌的效果。
1.1.3 分散和差速离心法 分散和差速离心法的主要原理是综合运用物理和化学手段,破坏土壤团粒的聚集,使微生物从土壤颗粒充分释放后,进行差速离心,可显著提高稀有放线菌的分离效率[15-17]。罗红丽等[18]从西藏地区采集土样,使用酵母麦芽浸汁琼脂培养基(ISP 2)和高氏一号培养基,通过分散差速离心法分离得到放线菌156株,其中包括5个稀有放线菌属。崔庆锋[19]采用分散和差速离心法和常规分离方法分离出20株稀有放线菌。何建清等[20]用分散差速离心法分离了拉鲁湿地中的诺卡氏菌属(Nocardia)、小链孢菌属(Microstreptospora)、马杜拉放线菌属(Actinomadura)、小单孢菌属等稀有放线菌。丁芸等将土壤样品经分散差速离心预处理后,涂布添加了抗生素的GTV培养基,选择性分离出酸性土壤中多种嗜酸放线菌。
1.1.4 密度梯度离心法 浓氯化铯溶液和蔗糖等一些小分子溶液可被用作制备浓度梯度,对土壤中存在的稀有放线菌孢子进行选择性分离。Karwowski等[22]根据放线菌孢子浮力密度的差异,利用氯化铯密度梯度超速离心法从土壤中分离出小单孢菌。Yamamura等[23]利用蔗糖密度梯度离心法选择性分离出诺卡氏菌。
1.1.5 微波及超声波 适度微波处理可使部分不可培养放线菌的孢子萌发,转化为可培养放线菌。R.S.Ferriss[24]对土壤进行微波辐射处理,显著提高了稀有放线菌的分离效果。杨斌等[25]通过微波对土壤进行预处理后发现,微波处理可提高原小单孢菌属和链轮丝菌属等稀有放线菌属分离效率。王东胜[26]采用120 W、2 450 MHz微波对土壤进行预处理,分离得到诺卡氏菌属和伦茨菌属(Lentzea),提高了土壤中稀有放线菌的分离效果。
超声波处理使用槽式超声波清洗器处理土壤悬液40 s,可大大增加放线菌的出菌种类和数量,显著提高分离稀有放线菌的效率,是一种经济且简便易行的方法。徐小雄等[27]利用50 Hz超声波处理土壤样品30 min,筛选得到假诺卡氏菌属(Pseudonocardia)、野野村氏菌属、小单孢菌属等多种稀有放线菌。
1.1.6 极高频辐射法 极高频辐射法(extremely high frequency radiation,EHF)可以选择性地分离那些能耐受EHF辐射强度,甚至受到EHF刺激后可被其激活生长的稀有放线菌,如原小单孢菌属(Promicromonospora)、珊瑚状放线菌属(Actinocorallia)、野野村氏菌属和荒漠拟孢囊菌属(Kibdelosporangium)等。研究表明,EHF处理可以增加稀有放线菌的分离数量[28]。
1.2 化学处理
化学处理主要是通过添加适当浓度的化学物质来筛选目的稀有放线菌。不同的放线菌孢子对化学试剂的耐受能力不同,可在土壤中添加不同的化合物进行预处理,用于特殊稀有放线菌的分离。常用的化学物质有苯酚、SDS(十二烷基磺酸钠)、葡萄糖酸氯己定、苄索氯胺、氯胺-T、萘啶酮酸、重铬酸钾等。苯酚可杀灭土壤中的细菌、真菌和链霉菌,利用1.5%苯酚预处理土样可有效提高土壤中稀有放线菌的分离效果[29-31]。M.Hayakawa[32]使用氯胺-T对土壤进行预处理,细菌、链霉菌和其它非目的放线菌在HV琼脂培养基上的生长受到严格抑制,可选择性分离出小单孢菌属、小四孢菌属(Microtetraspora)和链孢囊菌属(Streptosporangium)。
1.3 化学趋化处理
趋化法最初由Palleroni[33]为选择分离游动放线菌而提出,利用游动放线菌的游动孢子囊能被Cl-和Br-吸引的特性,在特殊设置的分离装置中加入KCl缓冲液,选择性分离该属放线菌。该分离方法因需要特殊的分离装置,使用范围较小,相关的研究不是很多。
1.4 生物学手段(噬菌体定向分离法)
噬菌体技术将对一种或几种链霉菌有裂解作用的噬菌体加入土样中,以减少非目标菌的数量,提高目的稀有放线菌的出现频率。Kurtboke[34]利用该技术已从南极土壤和海洋沉积物中分离得到一些具有活性的稀有放线菌。彭云霞等[35]研究发现,利用噬菌体S3和S7专一性感染裂解链霉菌,抑制大多数链霉菌的生长,结合多种预处理方法,可提高从土壤中筛选稀有放线菌的效果。Esther等[36]设计了一种以细菌噬菌体作为指示物,对环境样品中的野野村氏菌属进行快速筛选和分离的新方法。首先确定土样中是否含有能感染目标菌的噬菌体,对能产生噬菌斑的土样,采用常规的选择性分离方法对目标菌进行分离。近年来,鲜有文献报道使用噬菌体定向分离法分离稀有放线菌。
2 富集培养
富集培养又称增殖培养、加富培养。在分离培养基中加入目的菌所需的特殊营养物质和微量元素(如氨基酸、维生素等),同时加入非目的菌的抑制剂,并创造有利于目的菌生长的条件,使目的微生物迅速生长繁殖,使其变为优势菌群,更利于分离出该特定微生物,提高选择性分离效果[37]。
2.1 天然材料诱捕法(诱饵法)
天然材料诱捕法是利用天然物质作为诱饵捕获放线菌,主要用于游动放线菌的分离。使用预消毒的诱物毛发或花粉作为诱导剂,可分离得到小瓶菌属、螺孢菌属、小双孢菌属、小单孢菌属和发仙菌属(Pilimelia)[38]。Hayakawa[10]通过添加木糖、氯化物、溴化物、γ-三甲基吡啶及香草醛等趋化物分离得到多种可产生游动孢子的稀有放线菌。钙离子可以刺激放线菌菌丝的形成,利用CaCO3能富集分离放线动孢菌属[39]。用蛇皮作诱饵可分离瓶孢菌属[40]。Suzuki等[41]用脱脂牛奶对土样进行预处理,能刺激鱼孢菌属孢子运动,pH=8.0时,孢子运动频率最大。脱脂牛奶结合离心法还可选择性有效分离动孢菌属。CaCl2可促进双孢放线菌属(Actinobispora)气生孢子的形成[42]。
2.2 再水化-离心过滤法(rehydration and centrifugation,RC)
Hayakawa等[16]在Makkar和Cross的再水化法基础上发明了再水化-离心法,用于稀有放线菌的分离。Otoguro等[43]通过碳酸钙及离心过滤相结合的方法成功地从土壤和植物落叶中分离得到了动孢放线菌属和其它放线菌。Qin等[44]使用该法分离得到糖多孢菌属、迪茨氏菌属、芽生球菌属等稀有放线菌。Duong等[45]利用再水化-离心法分离出小单孢菌和链孢霉菌。
3 抑制剂的选择
可采用选择性抑制剂分离稀有放线菌。选择抑制剂有两方面要求:一是抑制真菌和细菌,而又不抑制目的菌;二是抑制非目的放线菌(如常见链霉菌),而不抑制目的菌。目前实验中广泛使用的两组高效抑制剂为①100 mg·L-1的放线菌酮(或100 mg·L-1制霉菌素)和20 mg·L-1的萘啶酮酸;②50~75 mg·L-1的重铬酸钾。萘啶酮酸可抑制细菌生长,放线菌酮和制霉菌素可抑制真菌生长。王书睿[46]采用高氏一号培养基和腐殖酸培养基作为选择培养基,以萘啶酮酸、放线菌酮和重铬酸钾为抑制剂,分离得到了小单孢菌属、野野村氏菌属、糖丝菌属和小链孢菌属等稀有放线菌。李小俊[47]用萘啶酮酸、放线菌酮、重铬酸钾作为抑制剂,从九莲城淖尔土壤样品中分离到优势菌属拟诺卡氏菌属和涅斯捷连科氏菌属的嗜碱放线菌。M.Hayakawa等[48]使用1.5%的苯酚溶液和0.03%葡萄糖酸洗必泰作为抑制剂,可富集培养得到小单孢菌。刘文祥[49]在土壤样品中加入阿米卡星,并用苯酚对样品预处理后,可有效分离具有抑菌活性的小单孢菌。部分稀有放线菌种属及其选择性抑制剂见表1。

表1 部分稀有放线菌属及其选择性抑制剂
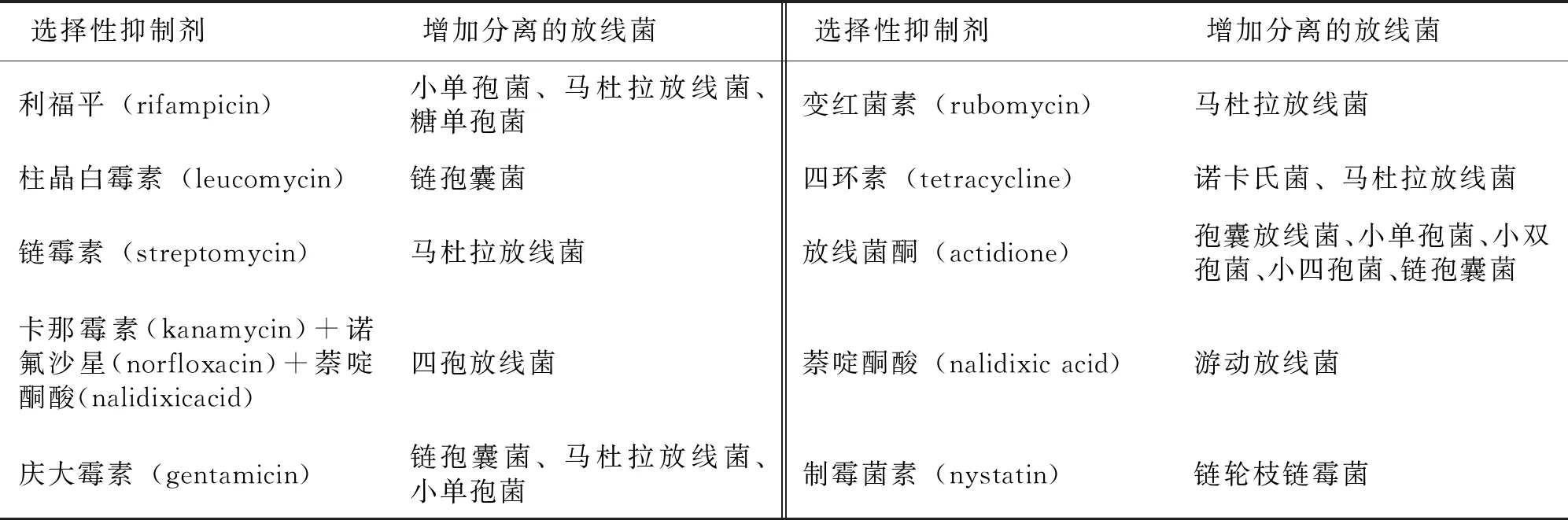
表1(续)
4 培养基的设计
放线菌的传统分离常采用高氏一号合成培养基作为分离培养基。然而,大多数稀有放线菌生长较慢,对培养基的营养要求比较苛刻,使用目前常见的培养方法与分离手段,难以获得大量的稀有放线菌。合适培养基的选择对稀有放线菌的分离及培养至关重要。不同类型的稀有放线菌对碳源、氮源的利用情况也不尽相同,几丁质、甘油、淀粉、葡萄糖、腐殖酸、MOPS、丙烯酰胺、海藻糖和EDTA等已广泛用作稀有放线菌分离培养基的碳源。精氨酸、天冬氨酸、酪氨酸或硝酸盐可作为分离培养基的氮源,腐殖酸也可作为培养基的唯一碳氮源[50]。
腐殖酸-维生素琼脂培养基(HVA)最早由日本学者Hayakawa设计,用于土壤样品中放线菌的分离,黑色的腐殖酸培养基背景尤其适合辨认和分离白色放线菌菌落,但是,没有气生菌丝或者产孢不好的小菌落在HVA培养基上不好观察[51-52]。目前,该培养基仍被众多研究者改良后用于分离多种稀有放线菌[53-55]。HVG培养基(HVA培养基中添加吉兰糖胶和2 mmol·L-1CaCl2)有助于鱼孢菌属的生长,结合离心法最早用于鱼孢菌属的分离[41]。S.L.Suzuki[56]采用HSG(腐殖酸微量盐吉兰糖胶)培养基对游动双孢菌属进行分离,微量盐和碱性培养基(pH=9.0)可刺激游动双孢菌属孢子囊的形成,且碱性环境可抑制链霉菌的生长,从而有助于游动双孢菌属的选择性分离。HMG选择性分离培养基,即HVG培养基中加入1 g·L-1吗啉丙磺酸(MOPS)。HMG分离培养基中添加100μg·mL-1硫酸庆大霉素、20μg·mL-1氨苄青霉素钠盐、50μg·mL-1三甲氧苄啶、10μg·mL-1萘啶酮酸,结合干热法预处理土样(120°C,60 min),用于分离A.rugatobispora菌[57]。刘最等[58]利用聚乳酸(PLA)和丝蛋白粉分别作为选择性碳源、氮源,可以有效提高稀有放线菌的分离效率。王霏[59]以聚乳酸培养基(PLA)、甘油-天门冬酰胺培养基(ISP 5)、脯氨酸-MOPS培养基、淀粉酪蛋白培养基(SC)、R2A培养基和2216E培养基6种培养基进行稀有放线菌的选择性分离,总共分离到106株稀有放线菌,占所分离到的放线菌总数比例为51.5%,有极高的稀有放线菌出菌率。
稀有放线菌种类繁多,不同种的放线菌所需的营养物质和培养条件各不相同,在设计选择性分离培养基时,应采取菌株分离时“投其所好,取其所抗”的基本原则,根据稀有放线菌自身的生理生化特性,在培养基中加入适合其生长的物质,不断对培养基和培养条件进行改进,以便于发现更多稀有放线菌新种,从而获得更多的新型次生代谢产物。在分离土壤中稀有放线菌时,必须考虑采用更多的培养基,才可能更大限度地获得土壤中的微生物资源。研究者常采用多种选择性分离培养基从土壤样品中分离稀有放线菌,还可在培养基中加入微量元素,有利于稀有放线菌的生长。
5 结 论
近年来,国内外学者综合运用不同的选择性分离方法及多种分离培养基对稀有放线菌进行选择性分离,显著提高了稀有放线菌的分离效果。但受分离条件和技术的限制,自然界中至少还有80%的放线菌没有被分离出来。因此,新型高效选择性分离方法的开发及合适培养基的选择仍然是药用微生物筛选人员重点研究的课题。
研究者们还从极特殊生态环境(如高温、高盐碱、极地、洞穴、海洋、沙漠、高海拔山脉、火山口等地)中分离得到多种新的稀有放线菌资源,从中获得了丰富的天然活性物质。一般认为极端环境中的放线菌具有较为特殊的生理代谢机制和生物学特性,可产生独特的生物活性物质。
随着分子生物学的快速发展,多种新型放线菌筛选策略也被用于稀有放线菌的分离,且更有针对性和目的性,菌株和其产生的活性代谢产物被重复发现的几率变低。通过设计引物或探针可利用PCR技术快速筛选土壤稀有放线菌的某种基因,还可以发现产生特定化合物的放线菌新种[60]。热解质谱法(PyMS)可以对放线菌进行快速、可回收分离,是一种新型全细胞指纹技术[61]。原位培养技术可最大程度还原微生物的自然生长环境,使用特殊的原位培养装置从土壤中俘获稀有放线菌,较传统分离筛选技术分离效果更好,提高了微生物的可培养性[62]。
总之,从土壤中分离出新的稀有放线菌,还需结合现代生物化学与分子生物学方法,采用多种行之有效的分离方法与手段,提高分离效果。我们期望更多新型简便、有效的分离方法的开发,用以挖掘土壤中的未知稀有放线菌,从而为放线菌资源开发及天然产物筛选奠定基础。

