RHBDD1与乳腺癌的研究进展
宗 雪,居红格,2
(1.内蒙古科技大学包头医学院,内蒙古 包头 014060;2.内蒙古科技大学包头医学院第一附属医院)
乳腺癌是全球女性高发病,严重威胁女性健康。目前,在分子水平上的研究是国内外专家的研究热点,EP、PR、EGFR在乳腺癌的治疗中已经成为治疗靶标。RHBDD1(Rhomboid domain containing 1)又称膜内丝氨酸蛋白酶,有研究表明其高表达促进胃癌、结肠癌的进展,研究已证实其在乳腺癌中也呈高表达水平,与乳腺癌的发生、发展密切相关。本文主要探讨Rhomboid蛋白家族的起源、结构、功能和RHBDD1的起源、结构、功能以及与乳腺癌的关系进行论述,旨在为临床提供新的治疗方法。
1 Rhomboid蛋白的发现、家族结构及功能特点
1.1Rhomboid蛋白的发现 1995年,Christiane和Eric两位诺贝尔奖获得者通过扫描基因突变的果蝇幼虫发现Rhomboid蛋白,此种果蝇幼虫头呈菱形状,Rhomboid蛋白在果蝇生命活动中发挥重要作用[1]。近年来,Rhomboid蛋白还被发现于酵母菌、细菌、哺乳动物中,与人类疾病密切相关。Rhomboid蛋白家族怎样进行蛋白水解尚不清楚,但其结构和功能随着人类科技的进步逐渐清晰,这类家族蛋白与人类疾病发生发展密切相关。
1.2Rhomboid蛋白家族结构及功能特点 Rhomboid家族蛋白是一组极其稳定的,含有6~7个跨膜结构域,其本质为膜内丝氨酸蛋白酶的蛋白家族。该家族相关基因开放阅读框架含有774个核苷酸序列,起始密码子为ATG,终止密码子为TAA,(A+T)%=50 %,共表达257个氨基酸。包含强碱性氨基酸(K,P)20个、强酸性氨基酸(D,E)16个、疏水性氨基酸(A,I,L,F,W,V)117个、极性氨基酸(N,C,Q,S,T,Y)54个。它们的活性位点隐藏在细胞膜平面内,并在跨膜区内部或者邻近跨膜区域内对底物进行加工切割,释放到细胞外或管腔外,具有催化三联体结构[2]。
大肠杆菌GlpG属于此家族,研究人员通过X射线晶体学以2.1 A度的分辨率生成大肠杆菌GlpG的核心区域,结果表明GlpG由6个跨膜螺旋组成(图1)。该结构有两个特征。第一是分子内存在1个V形凹穴,深度约为10 A,内腔氨基末端的中心螺旋S4结构位于膜表面下方,在蛋白质内部形成一个水溶性空穴,从而打开细胞外侧,S4顶端是催化基团;第二是膜嵌入循环,如图中L1结构,此结构具有上部和内部表面都是亲水性,而下表面是疏水的两亲特征。相对于蛋白质结构,其余部分的位置表明L1通常插入脂质双层的外叶中。L1的疏水羧基末端区域是从大V形间隙内延伸到脂质层面[3]。

图1 大肠杆菌GlpG
周华等[4]应用分子动力学模拟研究确定菱形蛋白酶基质进入活性位点的途径在Loop3和Loop5之间(图2)。Loop和Tm5的开放以及His150的转移可能通过此途径(衬底具有构象改变,以避免阻止His150)。此外,重要残基His150、Trp157、Trp196、Gly198、Ser248、Met247、Trp236与底物形成相互作用,以便在此通路的出口处稳定底物。
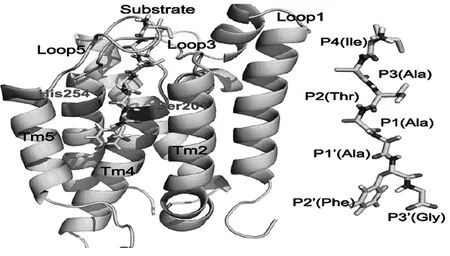
图2 大肠杆菌分子动力模型(引用自参考文献4)
综上所述,由L1上两个氨基酸残基W136、R137组成底物进入活性位点的门控位点,当底物接近跨膜蛋白活化中心,门控开启,活化位点上部呈亲水性,促进底物上半部螺旋区结构改变,进一步发生S201-H254Q亲核催化反应,肽键水解断裂。
1.3Rhomboid蛋白家族的分类 Rhomboid蛋白家族分为活性蛋白酶、iRhoms(无活性成簇)、其他rhomboid蛋白(无活性不成簇),见图3。活性蛋白酶最常见,其可分为分泌酶型、PARL型(位于线粒体,通常由6个TMH核心,N端附加一个TM组成),活性蛋白酶分泌酶型又含分泌酶A型(由6个TMH核心和1个TM组成C端)、分泌酶B型(仅由6个TMH核心组成)。

图3 Rhomboid蛋白家族分类
2 RHBDD1的发现、结构、功能特点
2.1RHBDD1的发现 RHBDD1(Rhomboid domain containing 1)属于Rhomboid蛋白家族成员,2008年被Wang等[5]发现的Rhomboid家族的一个新成员。其在人类睾丸组织中表达水平较高,但在肺、前列腺、卵巢、子宫和宫颈等组织中表达水平很低。
2.2RHBDD1的结构、功能特点 RHBDD1作为膜内丝氨酸蛋白酶,主要由N末端菱形结构域和C末端结构域组成,共表达315个氨基酸,含有6个跨膜结构,活性位点位于跨膜区域,具有蛋白切割底物功能。首先,RHBDD1蛋白对其底物加工修饰并释放,定位于内质网的底物在星形蛋白的作用下,转移到高尔基体,与高尔基体上的RHBDD1蛋白相互作用,并分离释放出具有活性的底物,然后底物被分泌到细胞外激活EGF受体,这是一个活性Spitz形式的提呈过程[1]。蔺亚妮等[6]通过实时定量PCR方法,检测发现RHBDD1基因在慢性髓系白血病(CML)患者骨髓细胞中的表达量明显高于正常人,且BCR/ABL p210表达阳性的患者RHBDD1表达量低于BCR/ABL p210表达阴性的患者,证实RHBDD1高水平表达与CML发生具有相关性,尤其在BCR/ABL p210表达阴性患者的发病中发挥作用。RHBDD1能切割转化生长因子α(TGFα)前体并释放具有活性的配体,从而使表皮生长因子受体(EGFR)信号通路增强,刺激肿瘤细胞生长,最终可造成癌症的发生和进展。史济华等[7]发现,RHBDD1在胃癌的癌前病变、早期胃癌以及进展期胃癌组织中表达量均高于慢性胃炎组织,提示RHBDD1基因参与胃黏膜的恶性转化过程。抑癌基因激活途径-6(Tumor suppressor-activated pathway,TSAP6)又称Steap3。RHBDD1主要位于TSAP6的第3跨膜结构域的C末端,进行切割并以活性依赖性方式诱其蛋白水解,且RHBDD1通过抑制TSAP6参加非经典外泌体分泌途径的调节,在细胞内介导可调节的细胞内水解过程(RIP),水解跨膜蛋白的C端跨膜结构域,产生的细小片段可在细胞生理过程中发挥至关重要的调节作用[8]。Song等[9]进行结肠直肠癌(CRC)鼠模型中证明RHBDD1表达与EGFR/Raf/MEK/ERK信号传导路径呈正相关,能够促进肿瘤生长,并且RHBDD1可作为结肠、直肠癌(CRC)疾病预后的预测生物标志物。RHBDD1对胶质母细胞瘤细胞U251和U87MG的进展具有促进作用,并且其沉默导致细胞周期进展和细胞增殖的抑制[10]。
RHBDD1与其他疾病的联系尚未被证实,有待进一步研究。与RHBDD1同属扁菱形蛋白家族的RHBDD3被证实具有双重作用,其一可以通过泛素化途径参加DNAX激活蛋白12(DNAX activation protein of 12kDa,DAP12)的降解,从而增加DAP12的促癌作用。其二可以维持免疫稳态,为肝病的治疗提供一个全新契机[11]。有报道,同属扁菱形家族的另一蛋白RHBDD2的mRNA水平以及蛋白表达水平在乳腺癌中均高于正常乳腺组织,且主要表现为Ⅲ期乳腺癌。RHBDD2基因在乳腺恶性肿瘤中有扩增,下调其表达水平可抑制乳腺癌细胞增殖,其表达水平越高,患者总体生存期、无复发生存期、无转移生存期越短[12-13]。
3 乳腺癌的研究进展
3.1诊断进展 根据国家癌症中心最新统计结果表明,我国新发乳腺癌病例数达到27.24万,每年死亡人数超过7万。乳腺癌是发生于女性乳腺上皮组织和细胞的一种恶性肿瘤。乳腺癌患者99 %是女性,所以乳腺癌已成为女性最典型最易发生的恶性肿瘤性疾病之一。不仅在我国,甚至整个世界,乳腺癌也是女性恶性肿瘤发病率最高的疾病。随着我国医疗水平和科学技术的不断发展,诊断乳腺癌的方案和技术支持日益完善,治疗方法和策略也随之增强。通过分组乳腺癌患者的术后病理结果(彩超组、X线钼靶组和X线钼靶-彩超联合组),显示与单一检查相比,X线钼靶联合彩超对乳腺癌诊断具有更高的特异性、敏感性和准确性,是现阶段诊断初期乳腺癌的首要方法,值得在临床广泛推广和应用。MRI可作为超声和钼靶发现疑似病例时必要的补充检查方式,且对浸润性乳腺癌具有较高敏感性,钼靶X线在乳腺癌癌前病变-乳腺非典型增生的诊断中具有重要的意义,是诊断乳腺非典型增生的较好方法[14]。免疫组化对乳腺癌的诊断研究表明,乳腺癌早期单个肿瘤标志物的检出率较低。血清糖类抗原(Carbohydrate antigen,CA)153、癌胚抗原(Carcinoembryonic antigen,CEA)及CA125的联合检测有利于提高乳腺癌早期检出率和各个时期诊断的准确性,同时提高乳腺癌与乳腺其他良性疾病的鉴别与诊断。肿瘤标记物联合检测最为准确的标记物组合应当最低为3项,其诊断为乳腺癌的意义大,其中乳腺癌淋巴结转移为阳性者,CA125标记物的诊断率更高[15]。
3.2治疗进展 乳腺癌是由于乳腺导管上皮出现恶性改变而产生,临床表现主要为乳房肿块、乳头溢液、腋窝淋巴结肿大等局部症状。乳腺癌晚期,癌细胞远处转移至身体多处组织和器官,患者生命受到严重威胁[16]。近年来,国家全面推广乳腺癌的二级预防以及医院普及多种早期诊断技术,乳腺癌早期诊断率因此不断提高,但随之出现的乳腺癌发病人口的不断年轻化,要求广大医生不仅要进行根治性手术治疗,更要注重年轻患者未来的生活质量,促进患者重视乳腺癌早期治疗方案和方法,逐步实现乳腺癌初期诊断规范化、个体化的综合诊疗[17]。乳腺癌的治疗有内分泌治疗、放疗、化疗、分子靶向治疗、外科治疗、姑息治疗、推拿、音乐放松疗法、冥想瑜伽等。乳腺癌的首选治疗方案一直是手术治疗,医生根据检查结果判断肿块大小,浸润深度和淋巴结转移情况决定手术方案。传统乳腺癌根治术对病人身体表面创伤较大,并且生存率低于改良乳腺癌根治术,因此现在很少使用这种术式。目前治疗乳腺癌的首选手术方式为改良后的乳腺癌根治术。手术方式逐渐向缩小切除范围发展。改良根治术治疗包括保乳手术(Breast Conservation therapy,BCT)和术后辅助放疗。保乳手术BCT包括瘤组织的局部广泛清除及腋窝淋巴结的清扫(Axillary lymph node dissection,ALND)或前哨淋巴结活检(Sentinel l ymph node biopsy,SLNB)。保乳手术判断标准以保证患者生存率为前提,选择合适术式,直接关系到术后效果和乳房外观[18]。患者是否进行保乳手术没有绝对标准,我国大部分医院的标准为肿瘤单发、周围型、直径2~3 cm;肿瘤位置在乳房边缘且离乳晕>2 cm;无乳头溢液的患者可以进行保乳手术(BCT)。肿瘤直径过大但是主动要求保乳的肿瘤患者,可选择尝试2~4 d的新辅助化疗,如肿瘤直径经化疗缩小,并且在手术切除肿瘤后乳房外观影响不大,可以进行保乳手术(BCT)。有国外研究显示,肿瘤≤3 cm、D>2 cm、腋淋巴结阴性、淋巴管内无癌细胞浸袭的乳腺癌患者可进行保乳手术BCT治疗,且随访未见复发[16-19]。保乳手术BCT禁忌包括:病灶直径>4 cm,边界不清晰者;伴有腋窝淋巴结明显肿胀或临床判定疑似有淋巴结转移者;癌瘤位于乳头、乳晕者;病灶呈现多中心或多散发恶性钙化灶;胸部或乳腺曾经有放疗记录者;存在胶原性血管疾病者。乳腺癌患者若处在妊娠期必须禁止采用化疗。术中切除的乳腺组织标本经多次病理科检验呈阳性者,在实行保乳手术BCT同时还应进行前哨淋巴结的活检SLNB。早期浸润性乳腺癌患者预后,腋窝淋巴结是否被侵袭成为患者经手术治疗后,是否进行下一步全身治疗或其他辅助放疗的标准。大量数据和临床实践表明,前哨淋巴结活检呈阴性的乳腺癌患者,进行淋巴结清扫不能提高病人生存几率,但可能引起患者上肢淋巴结水肿、疼痛和皮下积液等并发症。因此前哨淋巴结活检呈阴性的患者,已不再进行淋巴结清扫[16]。保乳手术不仅遏制疾病发展,还可提高患者生活质量,让女性身心得到健康发展。根据英国国家卫生和临床技术优化研究所(NICE)报道,双膦酸盐已被大范围应用于乳腺癌骨转移的并发症治疗,双膦酸盐能够预防乳腺癌骨转移患者出现SREs。随着研究进展,以内分泌治疗为基础的联合治疗已进入新时代,CDK4/6是驱动HR+乳腺癌增值的关键酶,内分泌联合CDK4/6抑制剂的治疗方案能够克服耐药性、增大内分泌治疗效果,已成为ER+/HER2-晚期乳腺癌的标准治疗方案[20]。所有乳腺癌类型中最常见的是激素受体(HR)呈阳性的乳腺癌,内分泌治疗对其有很大效果。据国内外科学家研究表明,雌激素受体(ER)和孕激素受体(PR)均阳性的乳腺癌患者术后再进行内分泌治疗有效率高达80 %。但是ER和PR都阴性的患者,术后进行内分泌治疗有效率<10 %,这表明ER和PR的性质直接决定内分泌治疗是否有效[21]。内分泌治疗与靶向治疗联合的实验也在不断尝试,Tifany研究来曲唑联合抗VEGF抗体贝伐珠单抗治疗转移性乳腺癌(MBC)的安全性是可行的[19]。患者绝经前内分泌治疗药物和绝经后药物有所不同,前者主要为芳香化酶抑制剂包含非甾体类(阿那曲唑)和甾体类(依西美坦),后者主要为他莫昔芬、LHRH类似物(戈舍瑞林)。随着研究的进展,乳腺癌治疗用药趋于多样性,还包括一些中药的应用,例如参芪扶正注射液。防己黄芪汤对乳腺癌术后的治疗与恢复有较好效果,能够缓解患者疼痛和肢体水肿等情况,安全性较高[22]。
4 RHBDD1与乳腺癌的关系
最新研究发现,rhomboid蛋白酶与乳腺癌的发生和发展密切相关。研究人员使用组织微阵列联合免疫组化技术对乳腺癌及癌旁组织中RHBDD1的表达水平进行检测发现,在乳腺癌组织中,RHBDD1的表达量高于瘤旁正常乳腺组织;RHBDD1的表达水平与病理性肿瘤(pT)分期、PR相关,病理性肿瘤-淋巴结转移(pTNM)分期和雌激素受体(ER)表达相关、与HER2及P53表达无明显相关。RHBDD1基因上调与几种乳腺癌亚型的预后不良有关,RHBDD1基因敲除能够加快乳腺癌细胞的凋亡进程,并能降低乳腺癌细胞增殖过程。RHBDD1敲除后,乳腺癌细胞的运动能力、迁徙能力以及侵袭能力减弱;RHBDD1对乳腺癌细胞的细胞周期积累效应并无影响,但可以调控乳腺癌细胞周期进展;RHBDD1缺失通过蛋白酶体途径明显抑制p-Akt活化和降低CDK2表达水平,从而抑制细胞周期运转和G1|S期转变。在乳腺癌组织中,RHBDD1和p-Akt蛋白表达水平呈正相关,RHBDD1和CDK2蛋白水平表达也呈正相关。因此RHBDD1可以作为乳腺癌患者一个新型的分子标志物,为乳腺癌的治疗提供一个全新的预后指标和研究方向[23-25]。
研究发现乳腺癌组织和细胞中miR-138-5p水平降低。乳腺癌细胞中的荧光素酶报告基因测定证实RHBDD1为miR-138-5p直接靶标。提升RHBDD1在乳腺癌组织中的表达量,miR-138-5p的表达量则降低,呈负相关。高表达miR-138-5p可下调RHBDD1表达,但RHBDD1过度表达逆转了miR-138-5p对乳腺癌细胞迁移,侵袭细胞上皮-间质转化(EMT)的抑制作用。研究表明miR-138-5p通过靶向RHBDD1调节乳腺癌迁移的肿瘤抑制作用,说明miR-138-5p负调节EMT可能是乳腺癌的治疗靶点[26]。有研究表明,RHBDD1在不同乳腺癌组织病理中表达不同,浸润性导管癌的表达水平高于小叶原位癌。RHBDD1在乳腺癌导管上皮和癌细胞中高表达。研究发现RHBDD1-mRNA在乳腺癌中的水平增高,且转移组中其含量高于未转移组[27]。
5 结语
RHBDD1是一类含有Rhomboid结构域的蛋白家族,本质为膜内丝氨酸蛋白酶,是肿瘤细胞增殖和凋亡的调节剂。已有研究证实,RHBDD1与人类癌症密切相关,本综述主要探讨了RHBDD1参与乳腺癌的生发过程。RHBDD1可以作为乳腺癌的一个新治疗靶点。随着科技的进步和大量学者的参与,更多关于RHBDD1与乳腺癌关系的研究正在不断发展中,需要研究者探索、研发进一步深入。

