双功能催化剂Nix/MgyAl2Oy+3用于丁酮烷基化反应
朱子慧 赵怀远 侯昭胤 陈 平
(浙江大学化学系,杭州 310028)
0 引 言
酮类化合物是现代化工最重要的有机合成基础原料和中间体。3-戊酮(DEK)作为一种应用广泛的精细化学品,是生产农药除草剂二甲戊乐灵和抗禽流感药物达菲的关键中间体[1]。3-甲基-2-丁酮(MIPK)作为一种精细化工中间体和高档溶剂,被广泛应用于合成染料、医药、农业以及有机溶剂等[1]。目前工业上主要通过2种方式生产DEK和MIPK,即丙醇、丙醛或丙酸自缩合脱羧制备法和以醇、酮为原料的缩合法。其中,丙醇、丙醛或丙酸缩合脱羧制备法是指在CeO2[2-3]、CeO2/MgO[4]、Cu-La2Zr2O7[5]、碳化铁[6]和Fe2O3[7]等催化剂作用下将醛和醇氧化,制备DEK。这种方法所需的反应温度较高,反应过程中生成酮的同时会释放出等物质的量的二氧化碳和水(式1),导致原料利用率不高[8]。
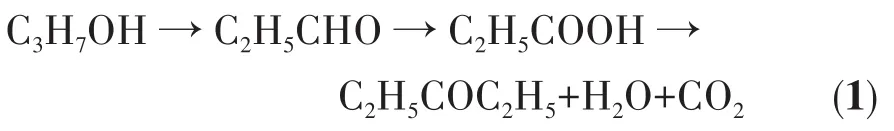
采用丁酮(MEK)和甲醇为原料,经(甲醇)脱氢、缩合、脱水和加氢还原过程制备DEK和MIPK(式2),该方法具有原料价廉易得、原子利用率高、反应工艺简洁、安全、无三废排放等诸多优点,是原子经济性好、工艺绿色的C—C键形成路径,为全新的合成工艺,应用前景十分广阔。
从化学反应的动力学过程分析,MEK分子中最活泼的碳原子是与羰基相连的乙基中的亚甲基碳(CH3CH2COCH3)。因此,迄今为止,在已报道的专利和文献中,MEK烷基化催化反应的主要产物都是MIPK。日本专利[9]公开了采用液相法催化反应的工艺,以MEK和质量分数35%的甲醛水溶液为原料,在10%的NaOH水溶液中,以Pd/C为催化剂,温度为60℃,在约0.40~0.45 MPa的氢压下,催化加氢合成MIPK,收率为73%,其他产物为DEK和2-甲基-3-戊酮(EIPK)。近年来,为利于连续化生产,气相法工艺的研究引起了关注,该工艺采用更绿色的甲醇来替代甲醛,且在原料成本上存在一定的优势,可以一步法联产MIPK、DEK、EIPK。德国BASF公司的专利[10]公开了利用含Ce、Cr、Fe、Mg、Mn等复合氧化物制备催化剂的方法,但存在反应温度过高(500℃)、催化剂表面易结焦等问题。田丽等[11-12]制备了Na-Pd/ZrO2-MnOx-ZnO催化剂,并用于一步法催化合成MIPK和DEK。结果表明,当Pd和Na质量分数分别为0.25%、0.29%、nZr∶nMn∶nZn=2.0∶(0.2~0.5)∶1.0时,在常压、温度370℃、原料液时空速(LHSV)1.0 h-1的条件下,MEK的转化率为39.6%,MIPK和DEK的选择性分别为45.5%和32.2%。说明在Na-Pd/ZrO2-MnOx-ZnO催化剂作用下的主要产物为MIPK,且原料利用率低,催化剂稳定性差,大规模工业应用受到限制。因此,为了使反应能在更温和的较低温度条件下进行,急需研制与气相法工艺条件相适应的高效催化剂。
目前主要采用3-戊醇氧化法制备DEK,该方法需要在浓硫酸存在的条件下使用重铬酸钠氧化剂进行氧化。上述工艺所用的原料(3-戊醇)价格昂贵,操作危险,废弃物的生成量高,严重污染环境,不符合绿色化工生产工艺的要求。
水滑石是一种重要的离子型层状化合物,具有高比表面积、中孔结构以及酸/碱性可调等优点[12-13],各种金属离子在水滑石骨架中均匀分布,因此被广泛认为是一种理想的制备双功能催化剂的前驱体[14]。许多双功能催化剂,如Cu基固体碱催化剂[15-17]、Ni/Al2O3催化剂[18-19]、Co-Mg-Al催化剂[20],都可以通过将水滑石焙烧和还原得到。同时,通过调节水滑石前驱体的组成还可以控制催化剂的酸/碱性[15]。我们合成了一系列Ni-Mg-Al水滑石前驱体,再经高温焙烧和氢气还原后,制备了双功能催化剂Nix/MgyAl2Oy+3,表征了该系列催化剂的结构性质,考察了催化剂在MEK烷基化反应中的活性规律,发现可以通过改变Mg/Al比例调节催化剂的表面碱量,优化催化剂的活性,从而在提高原料利用率的同时,提高MEK的转化率以及DEK和MIPK的选择性。
1 实验部分
1.1 试 剂
无水乙醇、碳酸钠(Na2CO3)、氢氧化钠(NaOH)、六水合硝酸镍(Ni(NO3)2·6H2O)、六水合硝酸镁(Mg(NO3)2·6H2O)、九水合硝酸铝 (Al(NO3)3·9H2O)、MEK、甲醇,均为AR级,购于国药集团化学试剂有限公司。高纯H2、高纯N2(纯度为99.999%)购于浙江今工物资有限公司。
1.2 实验过程
1.2.1 催化剂的制备
在250 mL烧杯中加入Ni(NO3)2·6H2O(x=0.2时,Ni(NO3)2·6H2O 为 2 mmol;x=1 时 ,Ni(NO3)2·6H2O 为10 mmol)、Mg(NO3)2·6H2O(y=11.8 时,Mg(NO3)2·6H2O为 118 mmol;y=11 时,Mg(NO3)2·6H2O 为 110 mmol;y=9 时,Mg(NO3)2·6H2O为 90 mmol;y=7时,Mg(NO3)2·6H2O 为 70 mmol;y=5 时 ,Mg(NO3)2·6H2O 为 50 mmol)、Al(NO3)3·9H2O(20 mmol)和100 mL去离子水,充分搅拌至完全溶解,将该溶液标记为溶液A。同时,在另一个250 mL烧杯中加入NaOH(160~280 mmol)、Na2CO3(50 mmol)和100 mL去离子水,搅拌至完全溶解并将该溶液标记为溶液B。然后,将2种溶液分别用蠕动泵同时滴加到装有100 mL去离子水的1 000 mL烧杯中并搅拌混合,并用精密pH计实时监测该混合液的pH值。溶液A的滴加速度为1.5 mL·min-1,溶液B的滴加速度约为1.1 mL·min-1。在滴加的过程中,保持混合液的pH值在8.5~9.0。滴加结束后,将混合液在室温下持续搅拌反应3 h。反应结束后,抽滤并用去离子水充分洗涤至洗涤液呈中性,然后将得到的固体放入100℃的烘箱中干燥12 h,最终得到的固体即水滑石前驱体Nix/zMgy/zAl2/z(OH)2(CO3)1/z(z=x+y+2,x=0.2、1,5≤y≤11.8)。将该水滑石前驱体置于马弗炉内于400℃焙烧3 h。然后用压片机将焙烧后的固体压制成40~100目的颗粒,得到的催化剂标记为(NiO)x/MgyAl2Oy+3。
1.2.2 催化剂的表征
催化剂的结构分析在Rigaku D/MAX 2550/PC型X射线衍射仪(XRD)上进行,采用Cu Kα射线(λ=0.154 nm),管电压为40 kV,管电流为100 mA,步长为 0.02°,扫描范围为 5°~80°。样品的形貌分析在Zeiss Sigma型场发射扫描电镜(SEM)上进行,电压为5 kV。样品经过喷金后在适当电压下进行观察。样品的热重-差示扫描量热(TG-DSC)分析在Netzsch STA409热天平系统上空气气氛中进行,控制升温速率为10℃·min-1,由20℃升温至800℃。催化剂的结构测定在ASAP 2020 HD88型全自动吸附仪上进行,样品均在200℃的真空中预处理4 h,催化剂的比表面积采用Brunauer-Emmett-Teller(BET)法计算,催化剂的孔径分布用Barrett-Joyner-Halenda(BJH)法计算。催化剂的还原特性由H2程序升温还原法(H2-TPR)测定。首先将50 mg焙烧后的催化剂在Ar气氛中750℃下预处理1 h,然后冷却至100℃,将气体切换为体积分数10%的H2/N2混合气,该气体首先经过干燥管脱水和脱氧管脱氧。将还原炉以10℃·min-1的加热速率逐步升温至850℃,同时通过热导检测器(TCD)测量并记录H2的浓度。还原催化剂的碱量由CO2程序升温脱附法(CO2-TPD)测定。首先将50 mg焙烧后的催化剂在H2气氛中750℃下还原1 h,然后冷却至100℃。将气体切换成CO2体积分数为20%的CO2/Ar吹扫30 min后再将气体切换成Ar,吹扫去除催化剂表面物理吸附的CO2。程序升温脱附时,以10℃·min-1升温至600℃,在检测过程中流出的气体要经过KOH粉末干燥,同时用TCD检测器测量并记录CO2的浓度。样品的形貌结构分析在JEOL-2010F型透射电子显微镜(TEM)上进行,以200 kV的加速电压进行观察。
1.3 MEK的烷基化反应
准确称取0.200 g催化剂(NiO)x/MgyAl2Oy+3放入管式反应器内,反应管的两端用石英棉固定,在15 mL·min-1的氢气流中,于750 ℃下还原 1 h,得到Ni/MgyAl2Oy+3。待反应器降温至220℃后,用高效液相色谱的高压泵将反应液引入反应器中,控制原料中甲醇与MEK的物质的量之比为10∶1,汽化温度为200℃,进样流量0.075 mL·min-1。反应液冷却后用乙醇为吸收溶剂,每隔1 h分析一次,用正丁醇作为内标物,反应产物通过气相色谱仪(Shimadzu,GC-8A 4m parapak Q填充柱)测量,依次考察了250、280、310℃下的反应结果。数据处理公式如下:
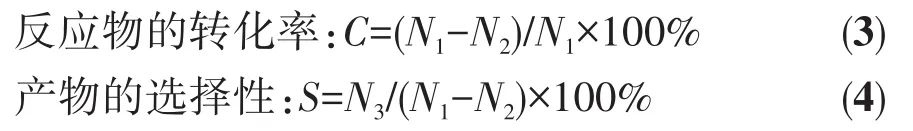
其中,N1为MEK的进料量(mol);N2为反应混合液中MEK的剩余量(mol);N3为反应混合液中目标产物的量(mol)。
2 结果与讨论
2.1 催化剂的结构表征
图1为所制备的水滑石前驱体Nix/zMgy/zAl2/z(OH)2(CO3)1/z的XRD图。从图中可以看出,所有样品均具有典型的水滑石特征衍射峰,并没有检测到单独的Ni物种的衍射峰,这表明Ni2+成功替代了Mg2+进入了水滑石的骨架中。在11.7°、23.6°、35.0°、60.6°和61.8°处的衍射峰分别对应于水滑石的(003)、(006)、(012)、(110)和(113)晶面(PDF No.56-0954),表明采用共沉淀法可以成功制备水滑石前驱体[21-22]。图2为NiMg9Al2(OH)24CO3水滑石的SEM图,可以看出,所制备的水滑石具有很好的片层结构,片层的平均厚度约为7.7 nm。
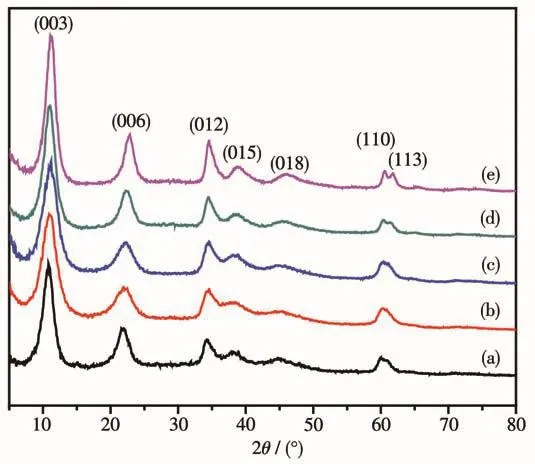
图1 水滑石前驱体Nix/zMgy/zAl2/z(OH)2(CO3)1/z的XRD图Fig.1 XRD patterns of hydrotalcite precursors Nix/zMgy/zAl2/z(OH)2(CO3)1/z

图2 NiMg9Al2(OH)24CO3的SEM图Fig.2 SEM images of NiMg9Al2(OH)24CO3
图3为水滑石前驱体NiMg9Al2(OH)24CO3的TGDSC曲线。可以发现,NiMg9Al2(OH)24CO3的质量损失主要分为3个阶段,分别在 30~113、113~207和207~396℃。第一阶段的质量损失可能是水滑石表面的物理吸附水和结晶水的流失,约占5.5%;第二和第三阶段的质量损失分别归因于水滑石层间OH-及CO32-的脱除[23]。在396℃以后未发现明显的重量损失,说明经过高温分解,水滑石前驱体最终能够形成稳定的混合金属氧化物结构。该结果与XRD表征一致。
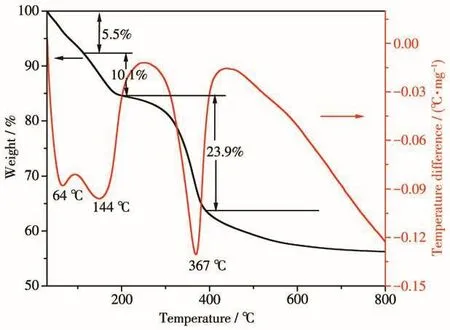
图3 NiMg9Al2(OH)24CO3的TG-DSC曲线Fig.3 TG-DSC curves of NiMg9Al2(OH)24CO3

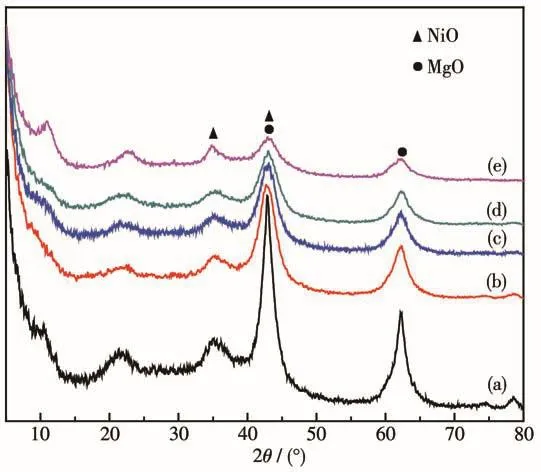
图4 (NiO)x/MgyAl2Oy+3的XRD图Fig.4 XRD patterns of(NiO)x/MgyAl2Oy+3
图5为水滑石前驱体经焙烧后的样品的N2吸附-脱附等温线。根据IUPAC的分类标准,所有的吸附曲线均属于类Ⅳ型,说明这些焙烧后的样品属于介孔材料。根据吸附数据,采用BET方程计算,焙烧后的样品NiO/Mg5Al2O8、NiO/Mg7Al2O10、NiO/Mg9Al2O12、NiO/Mg11Al2O14和(NiO)0.2/Mg11.8Al2O14.8的比表面积分别为193、156、128、120、41 m2·g-1。采用电感耦合等离子体原子发射光谱法(ICP-AES)检测了(NiO)x/MgyAl2Oy+3混合金属氧化物中Ni和Mg的含量(表1),结果表明随着Ni含量的增加,催化剂的比表面积逐渐增大。另外,各个样品的滞后环均处在p/p0=0.45~0.99之间,属于经典的H3型滞后环,这可能是片状材料的堆积生成了狭缝介孔的缘故[16]。
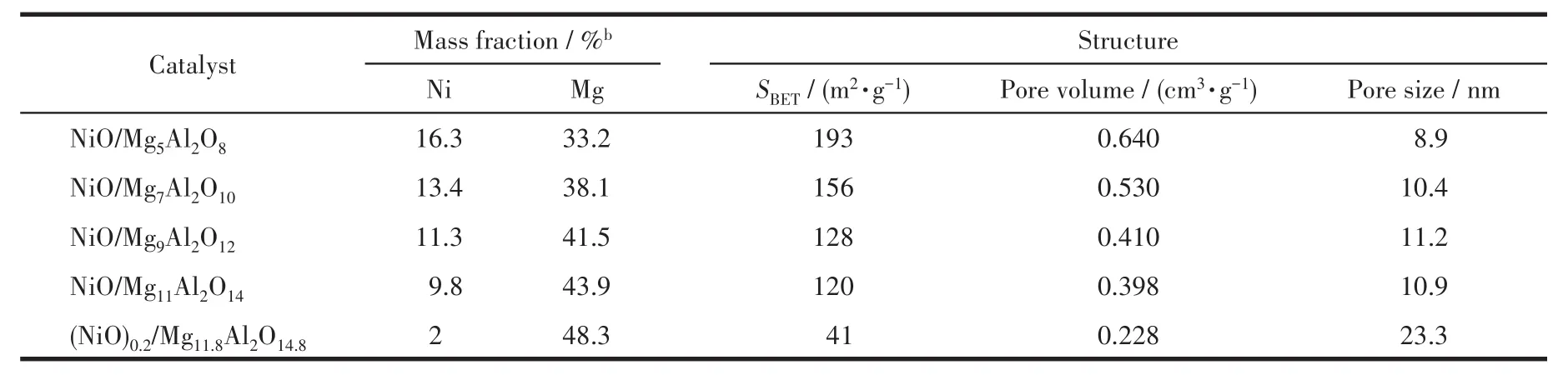
表1 催化剂(NiO)x/MgyAl2Oy+3的结构aTable 1 Structure of(NiO)x/MgyAl2Oy+3catalystsa
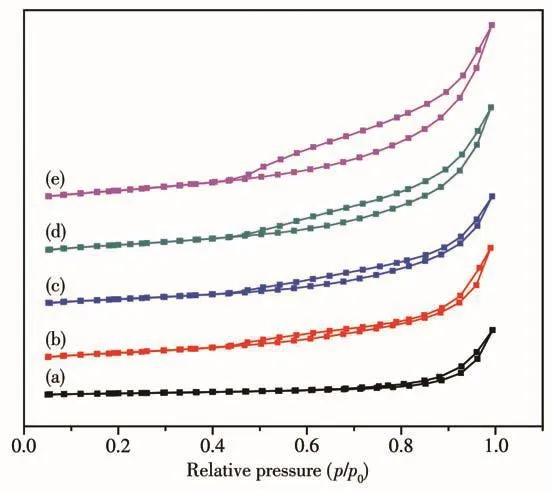
图5 (NiO)x/MgyAl2Oy+3的N2吸附-脱附等温线Fig.5 N2adsorption-desorption isotherms of(NiO)x/MgyAl2Oy+3
图6是焙烧后样品的H2-TPR图。从图中可以看出,这些焙烧后的样品(NiO)x/MgyAl2Oy+3在650~850℃处均有一个较宽的耗氢峰,该耗氢峰可归属为混合金属氧化物结构中NiO的还原峰[26]。随着NiO含量的增加,耗氢量明显增大。
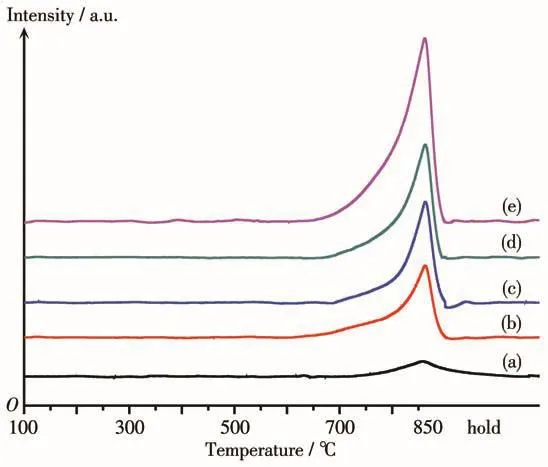
图6 (NiO)x/MgyAl2Oy+3的H2-TPR曲线Fig.6 H2-TPR profiles of(NiO)x/MgyAl2Oy+3
图7为(NiO)x/MgyAl2Oy+3还原后Nix/MgyAl2Oy+3催化剂的XRD图。在2θ=44.5°和51.8°处为还原Ni的特征衍射峰[25];在 2θ=43.4°和 62.3°处仍能检测到MgO的衍射峰。采用谢乐公式,根据Ni(220)晶面衍射峰的半峰宽计算得出Ni颗粒的粒径大小(表2),可以看出Ni颗粒的粒径随着Ni含量的增多而增大。

表2 Nix/MgyAl2Oy+3催化剂中Ni颗粒的粒径大小Table 2 Ni particle size of Nix/MgyAl2Oy+3catalyst
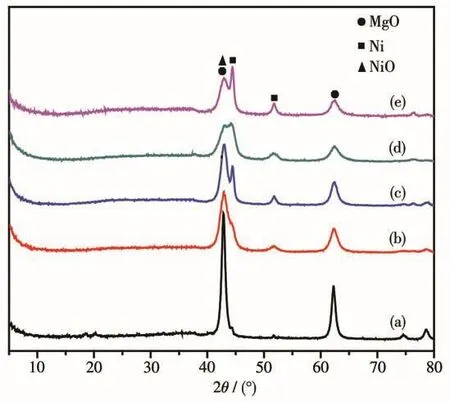
图7 Nix/MgyAl2Oy+3催化剂的XRD图Fig.7 XRD patterns of Nix/MgyAl2Oy+3catalysts
还原后样品Nix/MgyAl2Oy+3的CO2-TPD结果汇总于图8和表3。从图中可以看出,这些催化剂在220~450℃处均具有一个CO2的脱附峰,可以归属于MgO位点上吸附的CO2的物理脱附。随着样品中MgO含量的增加,CO2脱附峰面积随之增大且峰的中心位置逐渐向温度较高的方向移动。这可能是由于样品表面碱量的增加,使得CO2在MgO位点的吸附能逐渐增大[27-28]。因此可以在制备过程中通过改变MgO的含量来改变催化剂表面的碱性。
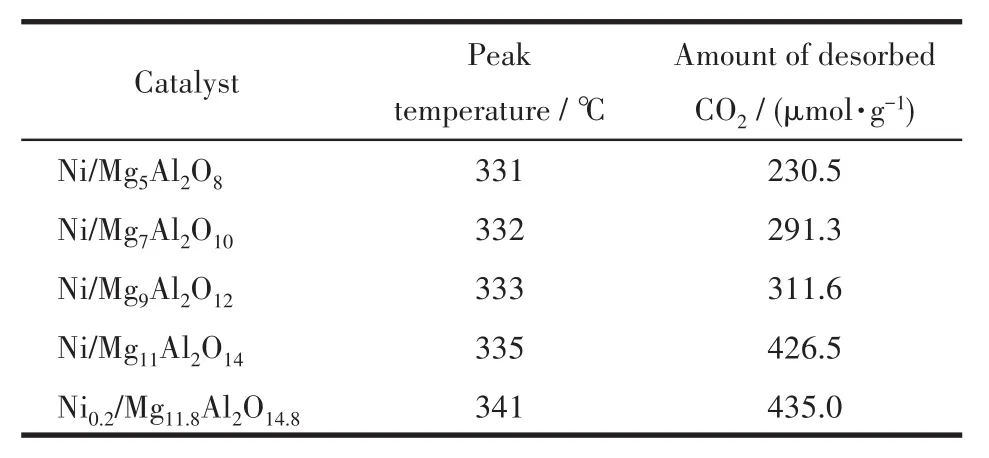
表3 Nix/MgyAl2Oy+3的CO2-TPD结果Table 3 Result of CO2-TPD of Nix/MgyAl2Oy+3 catalyst
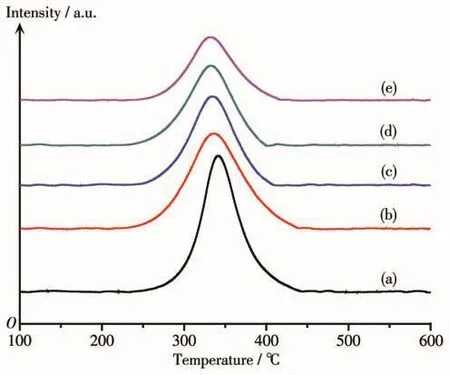
图8 Nix/MgyAl2Oy+3的CO2-TPD曲线Fig.8 CO2-TPD profiles of Nix/MgyAl2Oy+3catalysts
图9是还原后Ni/Mg9Al2O12催化剂的TEM图。从图中可以看出,在氢气中高温焙烧还原后,片层状团簇颗粒表面生成了许多直径在9~15 nm的Ni颗粒(图9a),且平均粒径为11.4 nm(图9b),与XRD结果基本一致。其中,0.195 nm的晶格间距对应于Ni的(111)晶面(图 9c)。
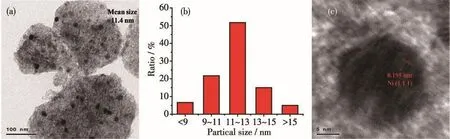
图9 Ni/Mg9Al2O12的TEM图(a、c)及粒径分布图(b)Fig.9 TEM images(a,c)and partical size distribution(b)of Ni/Mg9Al2O12catalysts
2.2 催化剂的活性
2.2.1 Nix/MgyAl2Oy+3在MEK烷基化反应中的催化性能
表4为在常压、温度280℃条件下,不同催化剂作用下MEK和甲醇烷基化反应的结果。实验结果表明,在较低的Ni含量(质量分数2%)的Ni0.2/Mg11.8Al2O14.8催化剂作用下,反应的活性较低,MEK的转化率只有5.6%,且生成的主要产物为仲丁醇(s-BuOH)。随着Ni的质量分数增加至9.8%(Ni/Mg11Al2O14催化剂)和 11.3%(Ni/Mg9Al2O12催化剂),MEK的转化率有显著的提高,且主要产物为DEK和MIPK。其中,在Ni/Mg9Al2O12催化剂作用下,MEK的转化率达到最高(57.9%),且DEK和MIPK的选择性分别为38.5%和21.6%。这主要是由于Ni可以促进不饱和醛、酮的加氢,同时Ni的增加还提高了催化剂的比表面积(表1),因此改善了催化剂的活性。然而,随着Ni含量的进一步增加,MEK的转化率却出现了下降,当Ni的质量分数增加至16.3%(Ni/Mg5Al2O8),MEK的转化率下降至50%。反应活性的降低主要是由于过量的Ni会覆盖Nix/MgyAl2Oy+3表面的碱性位点,而碱性位点在该反应中可以促进缩合。因此,适量的Ni与MgO的比例对于该反应至关重要。
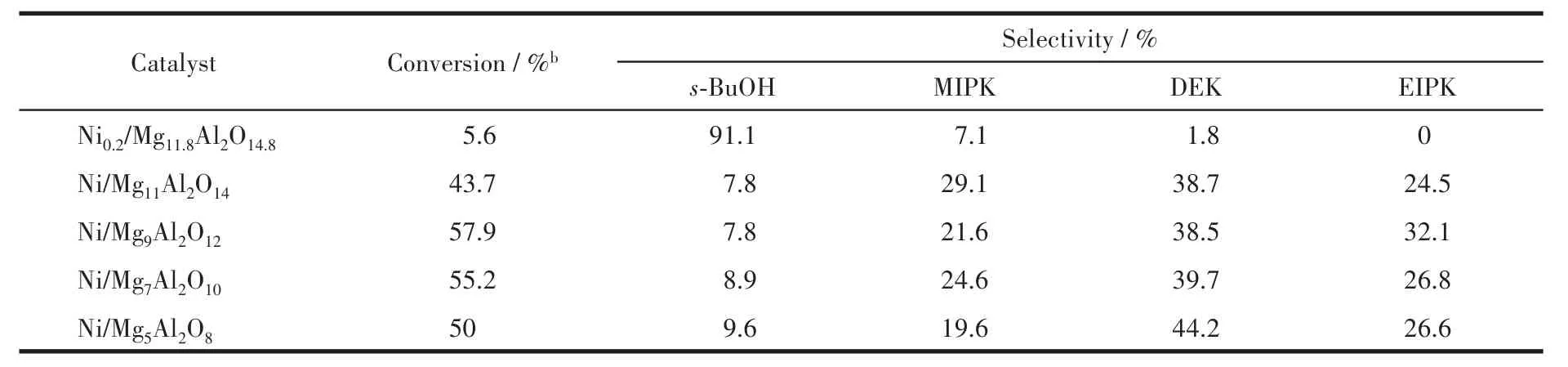
表4 Nix/MgyAl2Oy+3催化甲醇-MEK烷基化反应的活性aTable 4 Activity of methanol-MEK alkylation reaction over Nix/MgyAl2Oy+3a
2.2.2 不同温度对Ni/Mg9Al2O12催化剂活性的影响为了探索不同反应温度下甲醇-MEK烷基化的效果,在其他反应条件相同的情况下,考察了不同温度对催化性能的影响。表5是在Ni/Mg9Al2O12催化剂作用下,不同反应温度对MEK和甲醇反应的影响。当反应温度为220℃时,MEK的转化率只有34.5%,当温度升高至280℃时,MEK的转化率达到57.9%。以上结果表明,反应温度的提高可以提高MEK的转化率并增加DEK的选择性。这主要是由于反应温度的提高可促进碳负离子的生成速率以及缩合反应,从而加速MEK和甲醇的烷基化反应。然而随着反应温度的进一步提高,MEK的转化率下降,这可能是由于催化剂中金属Ni的烧结,以及焦炭的沉积会覆盖催化剂的活性位点[26,29]。
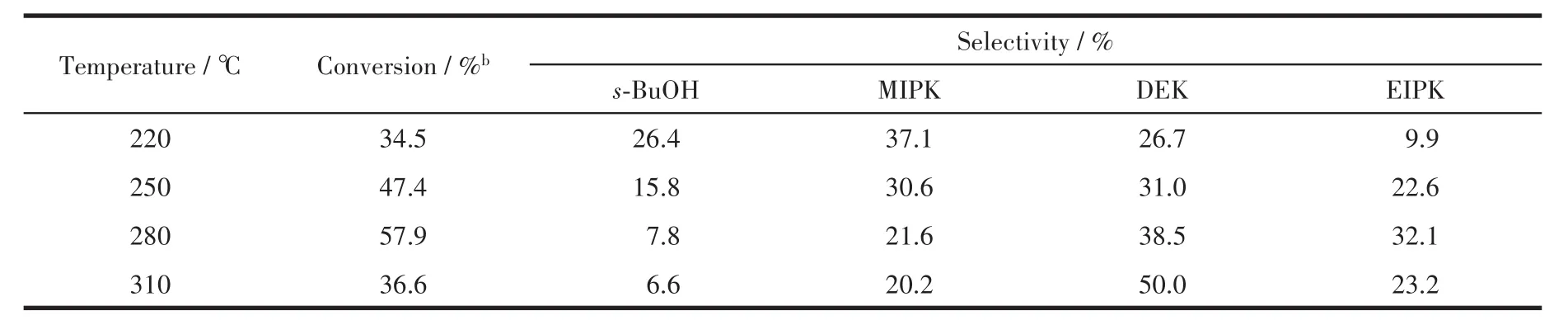
表5 反应温度对Ni/Mg9Al2O12催化剂活性的影响aTable 5 Effect of different temperatures on the activity of methanol-MEK alkylation over Ni/Mg9Al2O12a
2.2.3 不同原料组成对Ni/Mg9Al2O12催化剂活性的影响
表6是在Ni/Mg9Al2O12催化剂作用下,不同原料组成对反应活性的影响。由表可知,当LHSV为9.0 h-1时,随着甲醇和MEK的物质的量之比的增大,MEK的转化率呈现出先增加后减小的趋势。在nmethano∶lnMEK=10∶1的条件下,MEK的转化率达到57.9%,此时DEK和MIPK的选择性分别为38.5%和21.6%。
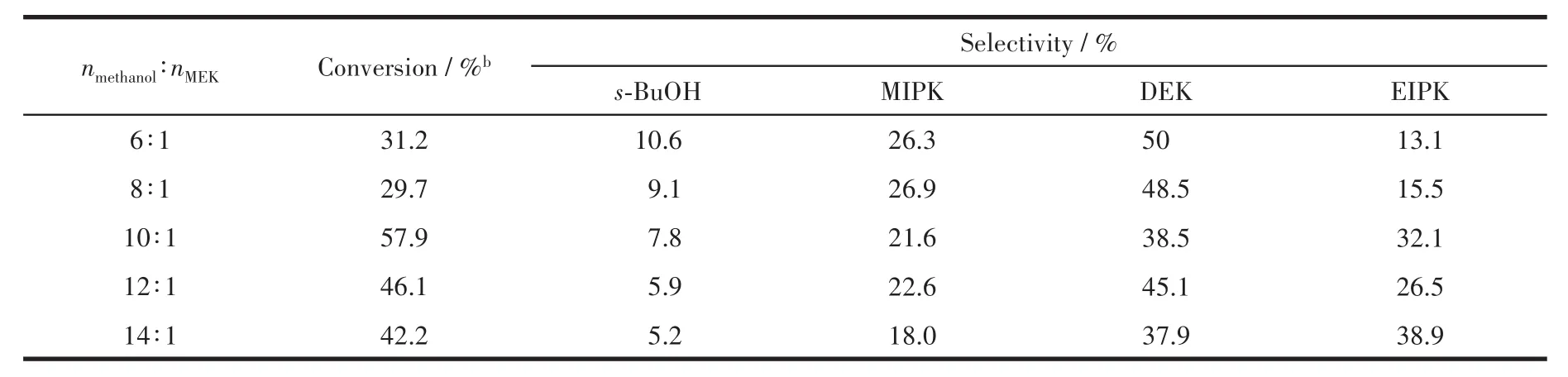
表6 不同原料组成对Ni/Mg9Al2O12催化剂活性的影响aTable 6 Effect of different MeOH/MEK molar ratios on the activity of methanol-MEK alkylation over Ni/Mg9Al2O12a
2.2.4 不同LHSV对Ni/Mg9Al2O12催化剂活性的影响
表7是在Ni/Mg9Al2O12催化剂作用下,不同LHSV对反应活性的影响。从表中可以看出,随着LHSV的增加,MEK转化率先增大后减小。当原料的LHSV为6.0 h-1时,MEK的转化率达到最高(61.6%),此时DEK和MIPK的选择性分别为45%和17.7%。

表7 不同LHSV对Ni/Mg9Al2O12催化剂活性的影响Table 7 Effect of different LHSVs on the activity of methanol-MEK alkylation over Ni/Mg9Al2O12a
根据上述结果,可以认为在Nix/MgyAl2Oy+3催化剂作用下,MEK与甲醇烷基化反应是由活性金属Ni与碱性位点MgO共同作用的结果,可能的机理如图10所示。首先,MEK在Nix/MgyAl2Oy+3催化剂的碱性中心作用下生成碳负离子。同时,甲醇在活性金属Ni的作用下脱氢生成甲醛。然后,碳负离子作为亲核试剂对甲醛上的羰基进行亲核加成,生成β-羟基醛。β-羟基醛受热脱水生成不饱和酮。最后不饱和酮在活性金属Ni的作用下加氢得到DEK和MIPK。在该反应中,低温(200~250℃)时以亚甲基上生成碳负离子为主,得到的主要产物为MIPK。温度较高(250~330℃)时,由于无位阻效应,甲基上生成碳负离子的速度加快,得到的产物以DEK为主。
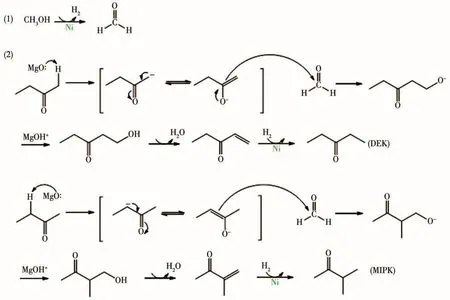
图10 甲醇-MEK烷基化生成DEK和MIPK的反应机理Fig.10 Reaction mechanism of methanol-MEK alkylation to DEK and MIPK
3 结 论
采用共沉淀法合成了组成可控的Nix/zMgy/zAl2/z(OH)2(CO3)1/z水滑石前驱体,再通过400℃焙烧及750℃还原制备得到Nix/MgyAl2Oy+3催化剂。考评实验发现,催化剂Ni/Mg9Al2O12在常压、280℃、原料中甲醇和MEK物质的量之比为10∶1、原料液时空速6.0 h-1条件下,在MEK烷基化反应中具有最高的活性,MEK的转化率为61.6%,DEK和MIPK的选择性分别为45.0%和17.7%。实验发现,催化剂中的金属活性中心Ni可促进甲醇脱氢得到甲醛,而适宜的碱量促进甲醛与MEK的缩合反应。因此,双功能的脱氢(金属)-缩合(固体碱)催化剂Nix/MgyAl2Oy+3上产物DEK选择性高,可减少原料在高温下的热解和积炭,从而提高原料的利用率和延长催化剂的使用寿命。

