MOFs包封纤维素酶的制备及性能研究
张学松,杨陈阳,陶娟
(江西科技师范大学生命科学学院,江西南昌330013)
金属-有机框架材料(MOFs)是由有机配体与金属离子或团簇通过配位键自组装而成的一种新型的有机-无机杂化晶态多孔材料,具有高孔隙率、大比表面积、孔径可调及可裁剪性等优势,已成为现代化学和材料领域的一大研究热点。
目前采用MOFs作为纤维素酶载体的文献报道中,其固定化方法主要以物理吸附法、化学结合法及化学交联法为主,本研究首次采用原位封装法,即在MOFs材料制备过程中预先加入纤维素酶,最终酶被包封在MOFs框架内,形成牢固结合的固定化酶,纤维素酶@MOFs。该包封型固定化酶不仅能提高纤维素酶的稳定性,显著减少由于酶的脱附引起整体酶活性的降低;同时酶的固定不再局限于载体表面,还可被封装在MOFs框架内,从而极大地提高了酶的负载量。孔径检测的结果可进一步验证纤维素酶在MOFs中的分布。本研究还对纤维素酶@MOFs的稳定性进行了评价。
1 材料和方法
1.1 主要仪器与试剂
RCT型IKA磁力搅拌器(江西鼎技科学仪器有限公司);TF-FD-1型冷冻干燥机(上海田枫实业有限公司);UV-5200PC型紫外分光光度计(上海元析仪器有限公司);Autosorb IQASIQ型物理吸附仪(美国quantachrome公司)。
纤维素酶、2-甲基咪唑(2-mIm)、羧甲基纤维素钠(CMC-Na)、考马斯亮蓝G-250(分析纯,萨恩化学技术(上海)有限公司);乙酸锌(Zn(CH3COO)2)(分析纯,西陇科学股份有限公司)。
1.2 纤维素酶@ZIF-8的制备
本研究以锌基MOFs,沸石咪唑框架材料-8(ZIF-8),作为纤维素酶的固定化载体,制备方法参考文献Wu等(2019)[1]并略做改动,首先称取0.6856 g Zn(CH3COO)2溶于300 mL去离子水中得溶液A;称取0.984 g 2-mIm溶于300 mL去离子水中得溶液B;称取纤维素酶粉0.20 g溶于25 mL缓冲溶液(pH 4.8,0.1 M)中得溶液C。将上述溶液A,C逐滴加至溶液B中,室温下搅拌反应12h,过滤,去离子水洗涤三次,除去未反应的分子。产品在真空条件下冷冻干燥24 h,制得纤维素酶@ZIF-8。
1.3 纤维素酶负载量的测定
采用考马斯亮蓝法[2]通过测定纤维素酶中蛋白质的含量来确定纤维素酶的质量。最终纤维素酶负载量用下式表示:

其中,M0为纤维素酶的初始加入质量,mg;M1为未被固定的纤维素酶的质量,即反应上清液中游离纤维素酶的质量,mg;M为载体ZIF-8的质量,g。
1.4 纤维素酶@ZIF-8的活性评价
采用羧甲基纤维素法测定纤维素酶的活性,首先量取2 mL CMC-Na至反应管中,加0.5 mL纤维素酶液混匀,40℃下摇床反应30 min。之后加入3 mL 3,5-二硝基水杨酸显色剂(DNS),沸水浴加热5 min灭活,冷却至室温,加蒸馏水定容至25 mL,540nm测光密度值。本研究以40℃、pH4.5最适反应条件下,纤维素酶的活性作为计算标准,纤维素酶@ZIF-8的酶活性均以相对活性表示。
1.5 纤维素酶@ZIF-8的孔径测定
纤维素酶@ZIF-8的孔径分布采用美国Quantachrome公司生产的Quantachrome Autosorb-IQASIQ物理吸附仪进行表征,由非局域密度泛函理论(NLDFT)计算得到,并在77K条件下测定了氮气吸附脱附等温线。样品在进行氮气物理吸附前在200℃脱气10 h。
2 结果与讨论
2.1 纤维素酶@ZIF-8中酶的负载量
本研究在ZIF-8的制备过程中添加了不同比例的纤维素酶进行原位封装,结果显示,随着初始纤维素酶加入量的增加,纤维素酶@ZIF-8中酶的负载量也随之增加,当纤维素酶的加入量为ZIF-8质量的50%时,酶的负载量达到最高值为350mg/g。相比吸附法或交联法制备的固定化纤维素酶[3],原位封装法可获得较高的酶负载量,这是由于纤维素酶的固定不再局限于MOFs载体的表面,还可被封装在MOFs框架内,从而极大地提高了酶的负载量,同时固定化酶的比酶活性也随之提高。
2.2 纤维素酶@ZIF-8的稳定性
本研究对比了纤维素酶与纤维素酶@ZIF-8在pH 3~8反应条件下的相对酶活性,结果如图1所示。纤维素酶的最佳pH值为4.5,随着pH值的增大,酶活性迅速下降,当pH为8时,相对酶活性仅为最佳条件时的10%;纤维素酶@ZIF-8的最佳pH值为5,并在pH5~8的环境下保持较高的酶活性,特别是在pH8反应条件下中,仍能保持65%的相对酶活性。固定后的纤维素酶@ZIF-8表现出更好的碱性耐受性,可能是ZIF-8本身在碱性条件下结构稳定,对纤维素酶蛋白质的构象变化起到了一定保护作用。

图1纤维素酶与纤维素酶@ZIF-8在不同pH反应条件下的相对酶活性
本研究还对比了纤维素酶与纤维素酶@ZIF-8在不同反应温度下的相对活性,结果如图2所示。纤维素酶在40℃时活性最高,随着温度升高,活性逐渐降低,当反应温度为80℃时,相对酶活性为85%。纤维素酶@ZIF-8的最佳反应温度为50℃,酶活性也随温度升高缓慢降低,在80℃反应条件下,相对酶活性为88%。固定后的纤维素酶@ZIF-8最佳反应温度比固定前提高了10℃,可能是ZIF-8对纤维素酶的包封,限制了纤维素酶的蛋白质在加热过程中的迁移率和构象的变化,所以,纤维素酶@ZIF-8的温度耐受性随之提高。
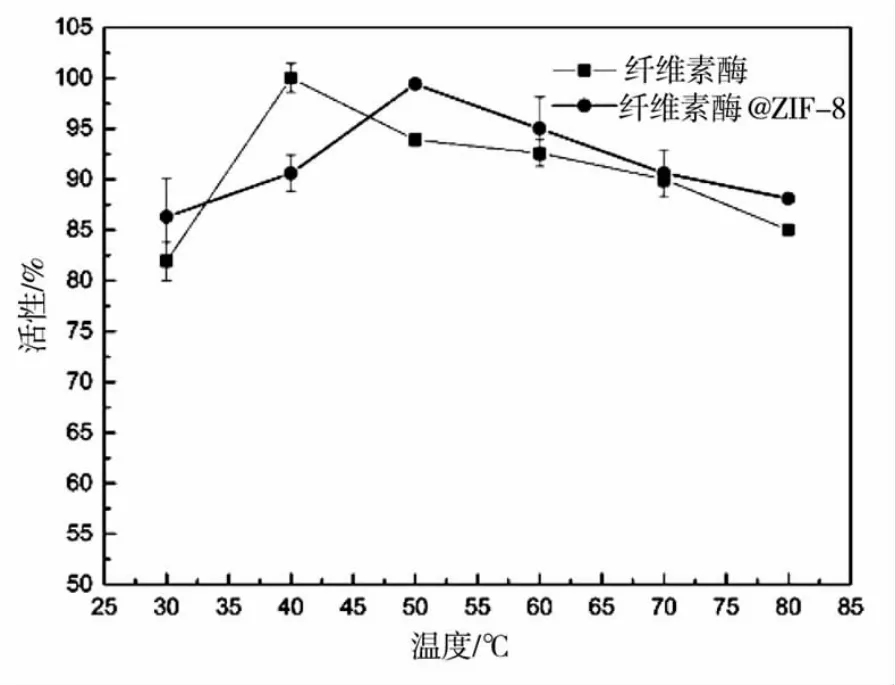
图2 纤维素酶与纤维素酶@ZIF-8在不同反应温度下的相对酶活性
2.3 纤维素酶@ZIF-8的孔径分布

图3 纤维素酶@ZIF-8的孔径分布图
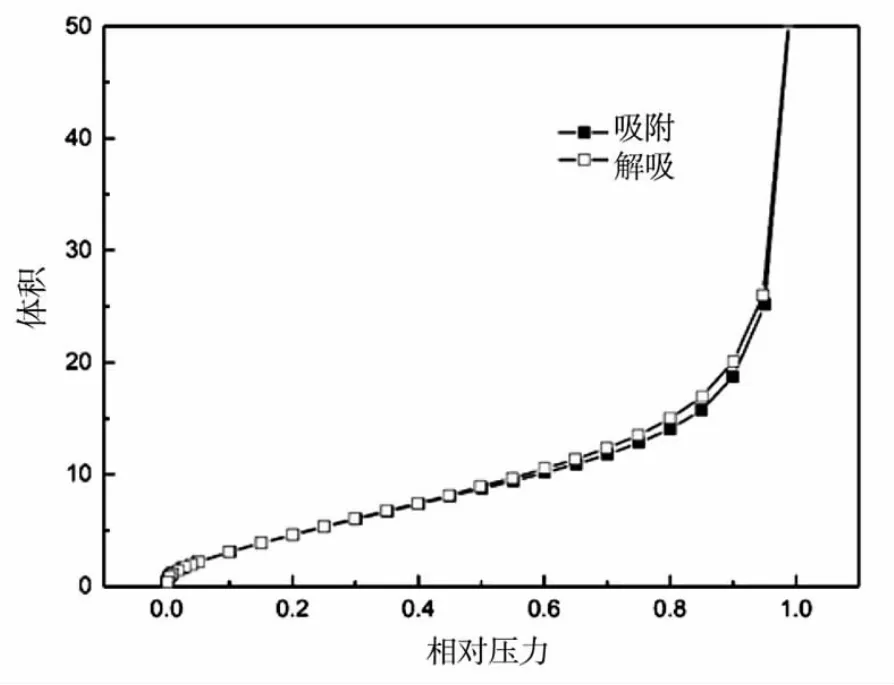
图4 纤维素酶@ZIF-8的N2吸附-脱附等温线
从图3孔径分布图中可以看出:纤维素酶@ZIF-8的孔径均为大于2 nm的介孔结构。图4为氮气吸附-脱附等温线,在中压(0.3~0.8)范围内,吸附曲线缓慢上升,并且存在一个后滞环,同样说明介孔结构的存在。由于ZIF-8本身的孔径分布在0.34~1.1 nm[4]之间,属于典型的微孔MOFs,纤维素酶的引入,导致ZIF-8在组装过程中形成了缺陷,从而使得孔径变大得到介孔结构,由此进一步证明了纤维素酶被有效地封装在了ZIF-8的框架内,制得包封型固定化酶。
3 结论
采用原位封装法在ZIF-8的制备过程中引入纤维素酶,最终酶被包封在ZIF-8的框架内,得到纤维素酶@ZIF-8,该固定化酶具有结合牢固、负载量高、对碱耐受性良好等优点。同时纤维素酶的引入导致ZIF-8的微孔结构产生缺陷进而形成介孔结构,更加有利于底物和产物的自由扩散,为后续纤维素的酶催化反应提供广阔的应用前景。

