Cu/Al纳米流体的制备及导热性能
汪靖凯,赵蕾,马丽斯
(1.西安建筑科技大学 建筑设备科学与工程学院,陕西 西安 710055;2.空军工程大学 基础部,陕西 西安 710051)
随着纳米技术和纳米材料的日益发展,纳米粒子在热量传递过程中,大的比表面积具备更佳的传热能力、小的尺寸具有较高的运动性、微对流传热速度快、不易堵塞微通道等优点已越来越多被人们应用于传质传热领域中[1-5]。纳米流体是指将导热性能好的纳米粒子以一定方式和比例添加到基础液体中形成新的换热或冷却工质体系,由于其表现出快速加热与高效制冷的出色热力性能,使其成为应用热交换器微型流道内新换热工质的主要载体。金属纳米粒子通常为普通基液的2~3个数量级,成为制备纳米流体的首选材料[6-12]。由于铝相对于Cu具有密度小的显著特点,对于常见的水基纳米流体,铝粉的纳米流体不易沉降,具有显著的稳定性,因此,纳米Al的流体传热工质具有应用潜能。但Al具有较小的电极电势,表面易被氧化而生成一层致密的Al2O3氧化膜,使Al粉失去活性而降低其应用效果。在Al粉表面包覆上一层纳米Ni、PS,可改善铝粉的抗氧化性,但都是以损失其导热性为代价[12-13]。Cu相比较Al有更高的导热性,更强的耐腐蚀性,添加纳米铜粒子的纳米流体可望具有较好的导热性能,但其密度较大,生成的纳米流体长时间易产生聚沉。本研究拟选取粒晶大小为20 nm的球形铝粉,设计兼顾Cu优质的导热性和Al的轻质性,在Al表面通过还原法生长一层Cu纳米薄膜,得到Cu/Al纳米复合粒子,在温控条件下,研究粒子尺寸、添加量、基液及稳定剂种类对其稳定性与导热性能的影响,以期制备高性能的纳米流体传热工质。
1 实验部分
1.1 材料与仪器
醋酸铜、硫酸铜、氯化亚铜、硫酸、氟化钠、β-糊精、抗坏血酸、柠檬酸钠(SC)、丙酮、三乙醇胺、无水乙醇、乙二醇、十二烷基苯磺酸钠(SDBS)、十六烷基三甲基溴化铵(CATB)、聚乙醇吡咯烷酮(PVP)均为分析纯;纳米铝粉(纯度99%,平均粒度20 nm);实验用水为去离子水。
PW3040/60型X射线衍射仪(XRD);JSM-7001E型场发射扫描电子显微镜(FE-SEM);JEM-2010-HT型透射电镜;U-3900H型紫外-可见光谱仪(UV-Vis DRS);Hot Disk 2500S型热物性分析仪。
1.2 Cu/Al纳米流体的制备
1.2.1 纳米Al粉的预处理 称取6.0 g的Al粉于烧杯中,加入丙酮,搅拌加超声以去除Al粉表面的有机物。用乙醇清洗,用5%的稀硫酸进行酸洗,再用蒸馏水反复清洗,直到检测不到Al3+。
1.2.2 还原法制备Cu/Al复合纳米粒子 采用置换还原法制备Cu/Al复合纳米粒子。将0.01 molβ-糊精和0.01 mol SC磁力搅拌溶于150 mL 40 ℃去离子水中,三乙醇胺调节溶液的pH值为6。加入与Cu2+等摩尔比的还原剂Vc,同时加入0.4 mol NaF,加入表面处理的Al粉,超声振荡分散30 min,得到含Al粉的混合液。将混合液置于40 ℃的水浴锅中加热,加入20 mL浓度2 mol/L的NaF溶液,反应 40 min,得到悬浊液。高速离心,用去离子水与乙醇分别洗涤3次,干燥,得Cu/Al复合纳米粒子。
1.2.3 Cu/Al纳米流体的制备[14]以去离子水与乙二醇体积比1∶1为基液,添加质量分数分别为0.3%Al、0.1%Cu/Al、0.3%Cu/Al、0.5%Cu/Al的纳米粒子和质量分数为0.3%的SC、PVP、SDBS、CTAB分散剂,高速电动搅拌3 h,搅拌速度为100~200 r/min,超声40 min,得Cu/Al纳米流体。
1.3 表征与测试
样品物相结构晶体类型分析采用X射线衍射仪(XRD);样品的微观形貌采用场发射扫描电子显微镜和透射电镜观察;将颗粒分散在乙醇溶液中,通过紫外-可见光谱仪测定纳米流体的吸光度,评价其稳定性;纳米流体的导热系数用热物性分析仪测试,测试时间设定为2 s。
2 结果与讨论
2.1 不同铜盐前驱体对Cu/Al复合粒子相结构和形貌的影响
分别以硫酸铜、氯化亚铜和醋酸铜为铜源,制备含铜离子为0.250 mol/L的溶液,在其他条件相同的情况下,制备Cu/Al复合粒子。反应过程中可观察到以氯化亚铜为铜源反应得到产品未离心之前呈橙红色悬浊液;以硫酸铜和醋酸铜为铜源反应得到产品未离心之前呈现酒红色悬浊液。图1是40 ℃条件下,三种不同铜盐制备样品与原料Al的XRD图谱。
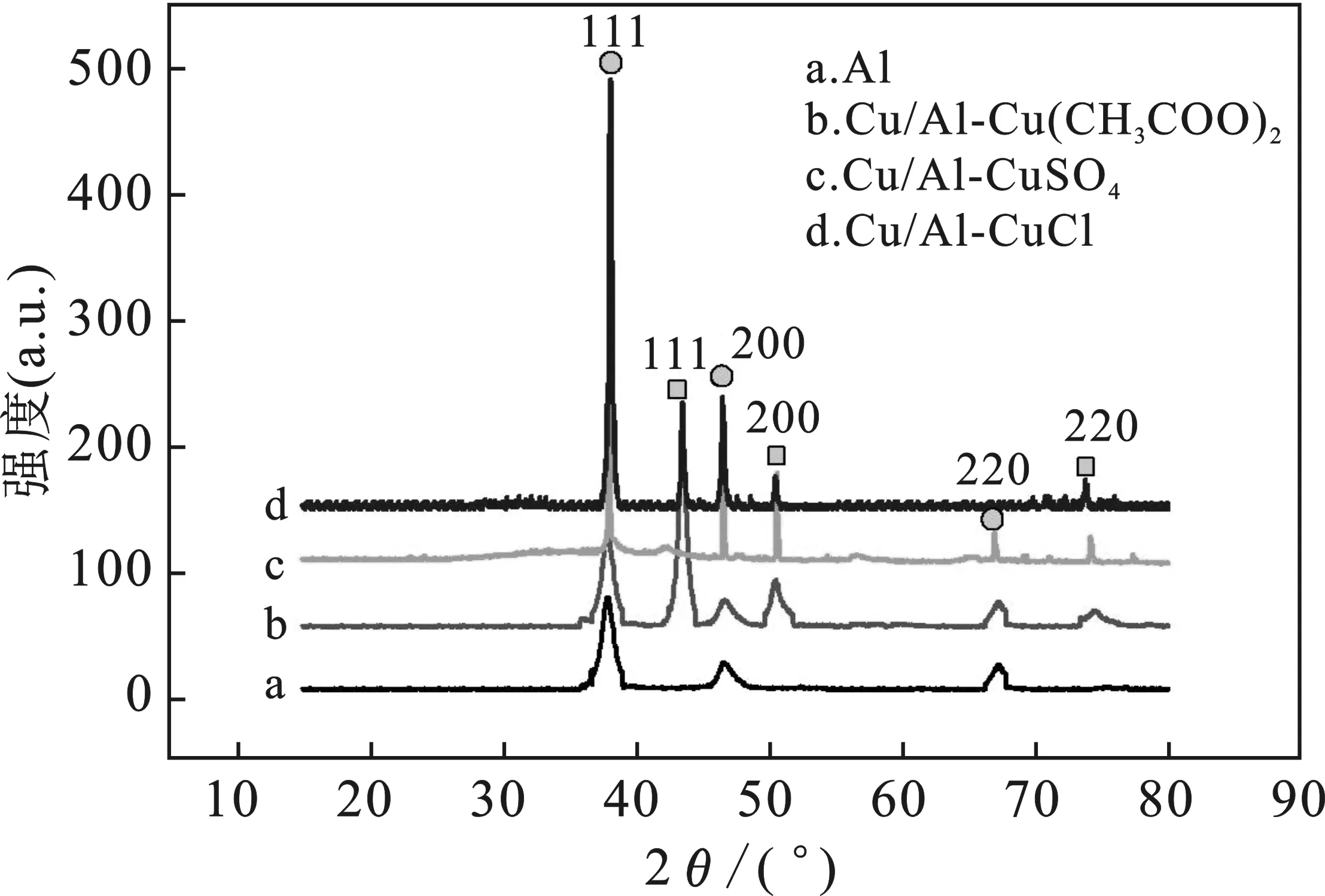
图1 不同铜盐原料合成Cu/Al粒子的XRD图谱Fig.1 XRD of particles prepared with different copper slate raw materials
由图1可知Al粒子的主要特征峰出现在2θ=38.2,45.5,67.2°处,与标准卡片(PDF card No.04-0787)的立方结构Al数据一致[8,15],分别对应Al的(111)、(200)、(220)晶面;从图1b、1c、1d曲线可以观察到除原来Al的衍射峰峰位存在之外,在2θ=43.5,51.2,73.6°处出现了特征峰,对照标准卡片(PDF card No.04-0836),可知与面心立方结构Cu相对应;除此之外,没有其它峰出现,说明样品中不存在其他物相杂质,三种铜盐均生成了Cu;不同铜源所得到样品的曲线除具有相同特征的衍射峰外,衍射峰的强度和峰的半宽高不同,以氯化亚铜为铜源制备的样品中,铝粉的衍射峰相对强度比较强,这可能是因为在样品中铜粉层相对较薄或铜粉层未全部包覆铝的表面。
图2是三种铜盐制备的样品的SEM照片。

图2 不同铜盐原料合成Cu/Al粒子的SEM照片Fig.2 SEM of Cu/Al particles prepared with different copper slate raw materialsa.CuSO4·5H2O;b.Cu(CH3COO)2;c.CuCl
由图2可知,以硫酸铜为铜源制备的铜包覆铝粉形成的Cu/Al复合纳米粒子,颗粒大部分呈类球状,晶粒尺寸大小不均匀,部分的晶粒粘连在一起,有团聚现象;以醋酸铜为铜源制备的铜包覆铝粉形成的Cu/Al复合纳米粒子颗粒呈类球形,基本没有改变Al粉的原貌,分散均匀,无团聚现象、大小较均匀,粒晶尺寸约为30 nm;以氯化亚铜为铜源制备的铜包覆铝粉形成的Cu/Al复合纳米粒子以立方体为主,分散均匀,无团聚现象,平均尺寸为 50 nm 左右。
由上可知,虽然三种不同的铜盐通过还原反应,都制备了Cu,但其包覆Al粉,得到的样品在形貌上存在一定的差异。
2.2 不同浓度的铜盐对Cu/Al复合粒子形貌的影响
图3为40 ℃条件下,不同浓度的醋酸铜制备的Cu/Al复合纳米粒子的微观形貌FT-SEM照片。

图3 不同浓度Cu(CH3COO)2制备的Cu/Al纳米粒子的FE-SEM照片Fig.3 FE-SEM images of Cu/Al nanoparticles with diffenert concentration a.0.012 5 mol/L;b.0.025 mol/L;c.0.050 mol/L
由图3可知,随着浓度的增加,晶粒的尺寸逐渐变大;醋酸铜浓度为0.012 5 mol/L,所得样品比较均匀,粒径约为30 nm,尺寸较小;反应醋酸铜浓度为0.025 mol/L,所得样品同样比较均匀,粒径约为50 nm;0.050 mol/L的浓度,样品表面显得略微粗糙,这是因为随着还原反应的进行,生成的Cu粒子慢慢沉积包覆在Al的表面,最终得到均匀的近纳米级的Cu/Al复合粉体,而低浓度下,沉积在Al表面的纳米Cu层就比较薄,醋酸铜浓度为 0.050 mol/L 时,样品平均粒径约为100 nm,样品已出现了轻微的团聚现象。因此,在该条件下制备Cu/Al复合纳米粒子的醋酸铜溶液最佳浓度为 0.025 mol/L。
为了进一步观测Cu对Al包覆情况,利用SEM自带的EDS分析功能,分别对纳米Al粉、纳米Cu/Al 复合粉体进行元素分析,结果见图4。
由图4可知,纳米Al粉体只包含一种元素,且其原子能谱的强度相对比较强;而Cu/Al纳米复合粉体中含有Cu、Al两种元素,经过Cu包覆后 Al元素的原子能谱强度相对变弱,但没有全部消失,表明Cu的包覆覆盖在了Al表面,使其相对原子能谱变弱[16]。

图4 纳米Al,Cu/Al的EDS 图谱Fig.4 The EDS spectra of aluminum and Cu/Al
2.3 还原法制备Cu/Al复合粒子的机理
利用Vc作还原剂制备Cu/Al复合纳米粒子的反应过程,主要发生的反应方程式为:
Cu2++C6H6O4(OH)2→
Cu +C6H6O6+2H+(1)
反应中使用疏水结构的β-糊精主要的作用是起一个分散剂和稳定剂的作用。β-糊精的分子结构是一个由吡喃葡萄糖单元构成的椭圆形的大分子,它的内腔基团具有疏水性,外面的大环是亲水基[17],反应过程中亲水基团与Al先以配位键结合,相对于锚定在了Al表面,随着Cu粒子被Vc的还原,疏水的一侧 —OH容易吸附到被还原的铜纳米颗粒上[18];同时,在反应过程中由于NaF的滴加,把表面处理好的铝粉加入后,NaF电离出的F-会与[AlF6]3-使Al粉表面Cu的成核活性点位增多,被还原的铜可以快速结晶生长为一层包覆层,在Al纳米颗粒上异质成核形成包覆核壳结构。Cu/Al复合纳米粒子反应过程可以用图5来表示。

图5 Cu/Al复合纳米粒子形成过程示意图Fig.5 Schematic illustration of Cu/Al nanoparticles
不同铜源对其形貌可以做以下的解释:用氯化亚铜作铜源时,在反应初期,CuCl电离出来的Cu+离子与稳定剂CATB中的Br-结合生成CuBr,而CuBr的溶度积常数(Ksp=8.28)比CuCl溶度积常数(Ksp=5.92)要大,表明CuBr相对于CuCl在水中更难解离,则溶液中Cu+的浓度显著降低,导致反应速率减慢。随着反应时间的延长,Cu+逐渐被还原成单质Cu,相对较低的反应速率有利于晶体各向异性的生长[19-21]。这一反应过程可用化学反应方程式来表示[17]:
Cu++Br-→CuBr
(2)
CuBr →Cu++Br-
(3)
Cu++e-→Cu
(4)
以硫酸铜为铜源进行反应,硫酸铜在与Vc反应过程中,电离速度比较快,Cu2+会与加入的NH3·H2O反应,部分结合生成[Cu(NH3)4]2+,部分生成水合铜离子,抗坏血酸Vc与其反应时,先将其还原转化为Cu2O,再进一步还原最终生成Cu原子,在多步反应过程中影响因素比较多,结果表现出生成的粒子大小均匀度受限。
醋酸铜电离出的弱酸根醋酸根离子,能发生水解,使得醋酸铜中铜离子的电离,能够受控制地逐步释放出来,致使Cu2+的还原反应也能在温和的条件下逐渐完成,因而得到了较为均匀的粒子。本文选择以醋酸铜为铜源进行Al粉的包覆。
2.4 不同分散剂对Cu/Al纳米流体稳定性的影响
配制添加物Cu/Al复合粒子质量分数为0.1%、分散剂质量分数为0.3%的水基纳米流体,实验过程中对纳米流体超声波振荡30 min后高速离心,离心转速104r/min,时间1 min,吸取上层清液测试其吸光度,分析研究分散剂对纳米流体稳定性的影响,结果见图6。

图6 不同分散剂的Cu/Al纳米流体吸光度Fig.6 Absorbance of Cu/Al nanofluids with different dispersant
由图6可知,柠檬酸钠的稳定性最好。
2.5 不同质量分数Cu/Al纳米流体稳定性
图7为含质量分数3%的柠檬酸钠分散剂及质量分数分别为0.3%Al、0.1%Cu/Al、0.3%Cu/Al、0.5%Cu/Al的纳米流体吸光度。
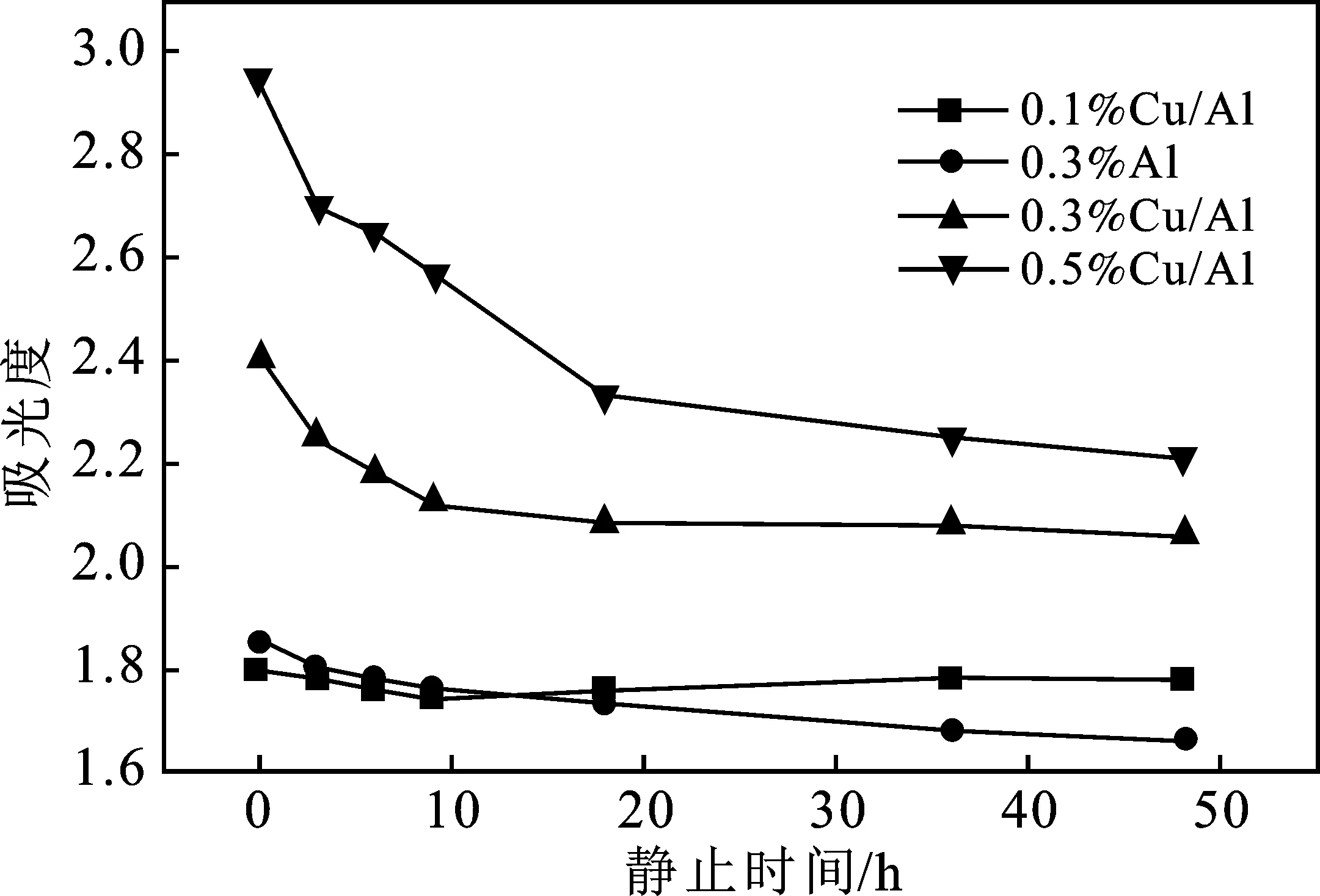
图7 不同纳米流体吸光度随静置时间的变化关系Fig.7 Varies of absorbance with standing time
由图7可知,对于含复合Cu/Al纳米粒子的纳米流体,随着溶液内悬浮物的浓度的增加,溶液吸光度值增大;添加0.3%的Al纳米粒子的纳米流体吸光度在放置前9 h内与0.1%的含Cu/Al纳米粒子的纳米流体吸光度基本相同,这是因为在浓度较低含0.1%的添加物情况下,纳米流体的吸光度基本与基液接近,但由于Al表面与复合粒子表面色泽不同,除了部分对光的吸收,还有一部分较强的反射,所以使得二者较接近。随着放置时间的延长,Al纳米流体的吸光度又略高于0.1%的Cu/Al纳米流体的,可能是由于Al表面的氧化减弱其对光反射的缘故;添加0.1%,0.3%,0.5%的Cu/Al纳米流体其吸光度随着放置时间延长变化率逐渐减小,静置超过36 h后,吸光度基本都保持不变,说明该条件下制备的Cu/Al纳米流体均具有较好稳定性。
2.6 不同质量分数Cu/Al纳米流体的导热系数
以去离子水与乙二醇体积比1∶1为基液制备纳米流体,其中纳米粒子质量百分数为0.3%Al、0.1%Cu/Al、0.3%Cu/Al、0.5%Cu/Al,研究室温下,不同质量百分数纳米流体的导热系数,结果见表1。

表1 Cu/Al纳米流体常温下的导热系数测试结果Table 1 The experimental results of thermalconductivity with Cu/Al fulids at 25 ℃
由表1可知,随着Cu/Al纳米粒子质量分数含量的增加,流体的导热系数增大,质量分数为0.3%Al,0.1%,0.3%和0.5%的Cu/Al水-乙二醇纳米流体的导热系数,较基液分别增加19.6%,25.9%,31.7%和39.6%,说明纳米粒子的添加,有效提高了去离子水/乙二醇基液换热工质的导热性能,且在添加量相同的条件下,复合Cu/Al纳米粒子比单一Al粒子具有更好的导热性;这是由于纳米粒子具有大的比表面积,增加了传热的接触面、小尺寸保持了其在基液中的稳定性,能形成较稳定的胶体体系,无规则的布朗运动使其增加了运动活性,具有更大的传热速度,及增加粒子与粒子、粒子与液体间的相互碰撞机会,使热量交换机会明显增加,促进了换热工质内部的热对流;且复合粒子相比较单一Al粒子,其成分中含有的Cu比Al具有更高的本征导热系数,Al外层包覆Cu薄膜增加了活性铝含量,使其具有更好的稳定性,使得纳米流体的导热系数相对于基液有更明显提升。
3 结论
采用还原法制备Cu/Al纳米复合粉,以水-乙二醇为基液,制备的Cu/Al复合纳米流体,以醋酸铜为前驱体制备的Cu/Al纳米复合粒子具有核壳结构,大小均匀,粒径约为50 nm;以柠檬酸钠为稳定剂,质量百分数为0.1%,0.3%,0.5%复合Cu/Al纳米流体均具有良好的分散稳定性;随着添加物的增加,纳米流体的导热系数增大,当Cu/Al纳米复合粉体的质量分数为0.5%时,室温下纳米流体的导热系数相对于基液可提高39.6%。

