耐低温对硝基苯酚降解菌的降解动力学研究
李超凡,温玉娟,曹楠,孙东,宋晓明,杨悦锁,2
(1 沈阳大学区域污染环境生态修复教育部重点实验室,辽宁沈阳110044; 2 吉林大学新能源与环境学院,吉林长春130021; 3 四川省环境保护地下水污染防治工程技术中心,四川成都610000)
引 言
对硝基苯酚(PNP)常用于燃料、杀虫剂、塑化剂以及农药等化工行业的产品制备过程[1],因其在环境中物-化性质较稳定、溶解度较高(16 g·L-1,辛醇水分配系数为lgKow=1.91)、迁移能力强且半衰期较长,因此能够在水生生物体内传递和富集[2],并长期积累残留在土壤和水体中,对动物和人体的皮肤、血液、眼睛、肾脏、肝脏等产生更加深远的危害。美国环保署将对硝基苯酚规定为环境优先控制污染物之一,且在饮用水中的质量浓度限值要低于10 ng·L-1[3]。
水环境中对硝基苯酚污染的处理方法可分为物理吸附法[4-6](吸附树脂、生物炭、活性炭等)、化学催化还原法[7-8]及微生物降解法。对硝基苯酚的酚羟基对位为硝基,对称的苯环结构使得该物质结构稳定,加之硝基的存在使得电子被吸附至其周围,进而导致该物质更加难以微生物降解。目前,分离筛选的对硝基苯酚降解菌主要有Pseudomonas[9-12]、Rhodococcus[13-15]、Arthrobacter[16-17]、Methylobacterium[18]、Rhodobacter[19]等。Lei等[10]从对硝基苯酚污染的垃圾场中分离得到Pseudomonas putida JS444 降解菌株,对其进行基因编辑,利用冰晶核蛋白质(INP)将有机磷水解酶定位到Pseudomonas putida JS444 上,使其可同时降解对硝基苯酚和有机磷农药,具有一定的土壤农药污染修复的应用潜力。Zhang 等[13]从制备农药的工业废水产生的底泥中分离出菌株Rhodococcus sp. CN6,在30℃条件下,12 h 内能够完全降解100 mg·L-1的对硝基苯酚,62 h 可完全降解300 mg·L-1的对硝基苯酚。Subashchandrabose 等[14]从含硝基苯酚和三氯乙烯污染的地下水中分离到Rhodococcus wratislaviensis strain 9,在23℃、pH 为7.5条件下,14 h 内有效地修复了含有900 μmol·L-1对硝基苯酚的实验室废水(废水中总氮、总有机碳、总磷酸盐浓度分别为2.32、4.5、0.12 mg·L-1),证实了其在对硝基苯酚污染水体生物修复方面的巨大潜力。Labana 等[16]分 离 得 到Arthrobacter protophormiae RKJ100,在pH 为7.5、20~40℃范围内能够降解1.4 ~210 mg·L-1的对硝基苯酚,在对硝基苯酚污染的原位生物修复中具有一定的应用潜力。Zohar 等[17]从农业土壤中分离到菌株Arthrobacter sp.4Hβ,在24 h内对400 mg·L-1和800 mg·L-1对硝基苯酚的降解率分别为100%和17%,且对高浓度对硝基苯酚具有较强的耐受性。目前,对硝基酚降解菌株的分离筛选工作主要为20~40℃之间,而耐低温对硝基酚降解菌的相关研究较少。
众所周知,温度为调控微生物降解过程的重要因素,对细胞蛋白的表达及酶和微生物的活性影响显著[20]。研究表明在7~35℃之间,微生物生物量和降解能力与环境温度呈负相关[21]。地下水常年温度为13℃左右,微生物活性往往受到抑制且降解能力降低,使得在地下水污染修复过程中,低温降解菌的降解作用权重较高。低温降解菌可以分为嗜冷菌和耐冷菌[22],嗜冷菌(psychorphile)是嗜冷细菌或古菌,其生存温度须在20℃以下,最适温度为-15~20℃[23];在0℃以 下 可 生 长 繁 殖。 耐 冷 菌(psychrotrophs)是一种耐寒细菌或古菌,它们能在5℃下生长,但最佳生长温度在20~25℃之间[24]。耐低温降解菌具有较宽的温度耐受性且在低温条件下依旧保持较高活性和降解特性。目前,针对耐低温对硝基酚降解菌的相关研究较少。Zhang 等[25]研究了低温条件下土壤含水层的生物强化修复技术,实验结果表明HEPD-bacterium 能够在15℃条件下降解对硝基苯酚,其最高耐受浓度为200 mg·L-1,强化修复实验结果表明,该菌株能够有效地提高寒冷地区的土壤含水层处理技术的处理效率。
由于对硝基苯酚具有一定的细胞毒性,对菌株生长产生抑制作用,为深入了解菌株的降解特性,探讨污染物浓度与降解菌作用的相关关系,多数研究由降解动力学向抑制降解动力学方向延伸[26-29]。Sahoo 等[26]研 究 了Arthrobacter chlorophenolicus A6 在30℃条件下对硝基苯酚的降解动力学模型,结果表明其降解过程符合Webb 动力学模型,比生长速率(μ)为0.161 h-1,半饱和系数(KS)为0.15 mg·L-1,底物抑制系数(Ki)为128 mg·L-1,模型拟合参数(K)为100 mg·L-1,说明该降解菌株降解的抑制浓度为128 mg·L-1。截止目前,尚未发现针对低温条件下对硝基苯酚降解动力学研究。因此,分离筛选耐低温对硝基苯酚降解菌株并研究其降解动力学特征对研发原位高效低耗的地下水污染修复技术具有显著的科学意义与实际意义。
综上,本研究分离筛选了一株对硝基苯酚低温高效降解菌Pseudomonas sp. ZL,利用单因素实验、细胞疏水性实验、细胞膜通透性等实验研究,结合低温降解动力学模型的拟合,对该菌株的低温降解特性进行综合表征。该研究成果有望解决菌株在低温环境(土壤及地下水)下对硝基苯酚去除效率较低这一问题,同时为地下水与土壤中对硝基苯酚污染修复提供一株新型耐低温菌株。进一步通过降解动力学模型的研究为菌株在实际污染修复工程及其优化运行等方面提供理论依据和数据支撑。
1 实验材料与方法
1.1 主要材料
实验菌株(保存于中国微生物菌种保藏管理委员会普通微生物中心,CGMCC No:17078)。对硝基苯酚(PNP),分析纯,上海麦克林试剂公司。氯化钠,分析纯,天津市恒兴化学试剂制造有限公司。氯化钾,分析纯,天津市瑞金特化学品有限公司。磷酸氢二钠、七水合硫酸镁,分析纯,天津市化学试剂厂。磷酸二氢钾,分析纯,西陇化工股份有限公司。蛋白胨、琼脂粉、牛肉膏,生物试剂,solarbio 公司。乙腈,99.97%,赛默飞世尔(中国)有限公司。
1.2 培养基及缓冲溶液配制方法
牛肉膏蛋白胨培养基:牛肉膏0.5 g,蛋白胨1 g,NaCl 0.5 g,琼脂2.5 g,超纯水100 ml。无机盐液体 培 养 基:Na2HPO43.8 g,KH2PO41.0 g,MgSO4·7H2O 0.2 g,KCl 3.0 g,超纯水1000 ml。LB 培养基:胰蛋白胨1 g,NaCl 1 g,酵母粉0.5 g,超纯水100 ml,pH 调至7。乳糖诱导培养基:KH2PO40.3 g,Na2HPO4·7H2O 1.28 g,乳 糖0.5 g,NaCl 0.05 g,NH4Cl 0.1 g,MgSO40.05 g,CaCl20.001 g,乳糖0.5 g,超纯水100 ml。β-半乳糖缓冲液:KH2PO40.024 g,Na2HPO4·12H2O 0.29 g,NaCl 0.8 g,KCl 0.02 g,MgSO4·7H2O 0.025 g,β-巯基乙醇0.39 ml,超纯水100 ml。磷酸盐缓冲液:KH2PO47.26 g,K2HPO422.2 g,超纯水1000 ml,pH调至7。
1.3 对硝基苯酚分析及OD600测试方法
对硝基苯酚的检测采用高效液相色谱法,利用赛默飞检测系统,C18 柱(4.6 mm×150 mm,5 μm),柱温为30℃,流动相为乙腈和水(乙腈∶水=70∶30),流速为1.0 ml·min-1,进样量为10 μl,317.1 nm 为最大吸收波长,采集时间为14 min,该方法在0.96~79.22 mg·L-1的线性范围良好,样品加标回收率为60.0%~93.0%。OD600采用紫外-可见分光光度计法,于波长为600 nm 测试其吸光度,以灭菌的无机盐培养基为空白,以OD600表示细菌生物量。
1.4 对硝基苯酚对Pseudomonas sp. ZL 疏水性及细胞膜通透性影响
1.4.1 细胞膜通透性 将菌悬液调节OD600值至0.700,按照1%(体积)的比例接种到100 ml 的LB 培养基中,培养24 h 后离心收集全部菌体,重悬于灭菌后0.9%的氯化钠溶液中,接入到100 ml的乳糖诱导培养基中继续培养24 h。将乳糖诱导培养基中的菌株在8700 r·min-1的条件下,高速离心20 min收集菌体,无菌水洗涤3 次后重悬于β-半乳糖缓冲液中,取1 ml 分别接入到对硝基苯酚浓度为0~300.44 mg·L-1的100 ml 无机盐培养基中,每个浓度设置4个平行样品。为了考察低温和常温下污染物对细胞的通透性影响,分别将样品置于10℃和30℃进行培养,120 r·min-1,待底物全部降解后,加入5 mg 邻硝基苯-β-D-吡喃半乳糖苷,培养1 h,用紫外-可见分光光度计测试OD504值(波长为504 nm),绘制对硝基苯酚浓度与OD504的关系图,判断对硝基苯酚浓度对菌株细胞膜通透性的影响[30]。
1.4.2 细胞的疏水性 制备OD600值为0.700的菌悬液,按照1%(体积)的比例将菌悬液分别接种到对硝基苯酚浓度0~200.58 mg·L-1的100 ml 无机盐培养基中,每个浓度3个平行样品,分别置于10℃和30℃的摇床中,待样品完全褪色后离心浓缩,用灭菌后的磷酸盐缓冲液混匀离心洗涤2 次,用磷酸盐缓冲液将样品OD600值调节到0.6~0.7 范围内,计为A0,取3 ml 放入玻璃试管内,加入1 ml 二甲苯剧烈晃荡2 min 后,静止40 min,抽取下层有机相测定其OD600值,计为Ai。利用式(1)计算每个浓度的CSH 值,判断细胞的疏水性[31]。

CSH >55%:高度疏水性
54% >CSH >30%:中等疏水性
29% >CSH >10%:中等亲水性
CSH <10%:高度亲水性
1.5 Pseudomonas sp.ZL菌株低温降解性能研究
1.5.1 pH对菌株ZL降解的影响 将菌株调节OD600值为0.600 的菌悬液,按照1%(体积)的比例接种到pH 分别为5.0、6.0、7.0、8.0、9.0、11.0 的对硝基苯酚浓度为100.48 mg·L-1的无机盐培养基中,在10℃、120 r·min-1条件下培养76 h,测定对硝基苯酚浓度及OD600。
1.5.2 盐度对菌株ZL 降解的影响 将OD600值为0.600 的菌悬液按照体积比1%接种到盐度分别为0.01%、0.5%、1.0%、3.0%、3.5%的无机盐培养基中,对硝基苯酚浓度为100.36 mg·L-1,在10℃、120 r·min-1、最佳pH 条件下培养56 h,测定对硝基苯酚浓度及OD600值。
1.5.3 外加氮源对菌株ZL 的影响 为了考察外加氮源种类及浓度对其降解的影响,将菌株按照上述方法制备菌悬液并分别接种到0.5 g·L-1和1.0 g·L-1的NaNO3、0.5 g·L-1和1.0 g·L-1的NH4NO3及0.5 g·L-1和1.0 g·L-1的(NH4)2SO4的无机盐培养基中,在10℃、120 r·min-1、对硝基苯酚浓度为100.11 mg·L-1、最佳pH及盐度条件下培养,间隔4 h取样,分别测定对硝基苯酚浓度和OD600值。
1.5.4 接种量对菌株ZL 降解特性的影响 将OD600值为0.196、0.299、0.450、0.504、0.706、0.903 的菌悬液按照体积比1%接种到无机盐培养基中,在10℃、120 r·min-1、对硝基苯酚浓度为100.34 mg·L-1以及最佳pH、氮源及盐度的条件下培养83 h,测定对硝基苯酚浓度和OD600。经式(2)计算的菌株接种浓度分别为54.08、95.68、144.00、161.28、225.92、288.96 mg·L-1。式(2)为Pseudomonas sp.ZL 菌株OD600值与其浓度的线性关系式,相关系数R2为0.995,拟合情况良好。
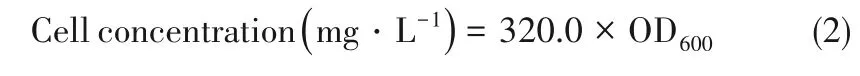
1.5.5 对硝基苯酚初始浓度对菌株ZL降解的影响 为了考察底物浓度对菌株降解的影响,按照最佳接种量将ZL 分别接种到对硝基苯酚浓度为11.23、16.57、22.11、28.31、47.27、55.46、82.31、108.87、145.31 mg·L-1的无机盐培养基中。在10℃、120 r·min-1以及最佳pH、氮源及盐度的条件下培养,隔段时间取样,测定对硝基苯酚浓度和OD600值,分析不同对硝基苯酚浓度对其降解的影响。
1.6 Pseudomonas sp. ZL 低温降解对硝基苯酚动力学研究
为了探讨Pseudomonas sp. ZL 的低温降解动力学模型,分别配制浓度为6.65~303.71 mg·L-1的对硝基苯酚新鲜培养基,将培养基的pH、氮源、盐度以及接种量调节至最佳。每个浓度3 个平行样品,10℃、120 r·min-1条件下培养,定时取样,实时监测OD600值和对硝基苯酚浓度,绘制OD600和浓度随时间的变化曲 线,采 用Haldane model[32]、Aiba model[33]、Yano model 和Webb model[34]进行拟合,探讨Pseudomonas sp. ZL 的抑制动力学模型,考察低温条件下菌株的降解特性。

式中,μ 为比生长速率,h-1;μmax为模型中的最大比生长速率,h-1;K 为Yano、Webb 模型拟合参数,mg·L-1;Ks为半饱和系数,mg·L-1;Ki为底物抑制系数,mg·L-1;S为对硝基苯酚的浓度,mg·L-1。
2 结果与讨论
2.1 对硝基苯酚对菌株疏水性和细胞膜通透性的影响
2.1.1 菌体形态 Pseudomonas sp. ZL 透射电镜照片如图1 所示,该菌为革兰阴性菌,呈椭圆状,无鞭毛,无芽孢,表面透明,边缘光滑整齐。菌落呈白色,不透明且圆润。
2.1.2 菌株ZL 的细胞膜通透性 当细胞的外界条件改变(污染物、浓度和温度等)而导致细胞通透性增加,乳糖诱导培养基诱导细胞内部产生大分子β-半乳糖苷酶,在加入邻硝基苯-β-D-吡喃半乳糖苷后,还原产生的邻硝基苯酚浓度增加。由于细胞膜通透性的改变,邻硝基苯酚被释放到细胞外,溶液由无色变成亮黄色,通过测定邻硝基苯酚浓度(OD504)来判断细胞通透性的改变[30]。由图2 可知,在温度分别为10℃和30℃,低温条件下细胞通透性略高于常温条件。而在相同温度条件下,细胞膜通透性随着对硝基苯酚浓度的增加而呈现先升高后降低的特性,该结论与前人的研究结果一致。

图1 菌株透射电镜图Fig.1 Transmission electron microscopy of the strain

图2 菌株ZL的细胞膜通透性Fig.2 Cell membrane permeability of ZL strain
2.1.3 菌株ZL 的细胞疏水性 研究表明细菌对有机物的吸附能力与其表面疏水性相关[35]。细胞的疏水性会受外界的刺激产生变化,同时细胞的疏水性可以表示细胞对底物毒性的反应[36],底物毒性会增加对细胞的刺激性,导致细胞疏水性增强。由图3可知,30℃下细胞的总体疏水性略低于低温10℃的细胞疏水性,10℃条件下的菌株CSH 值在30%~54%阶段,呈现中等疏水性,而30℃条件下的菌株呈现亲水性,表明低温培养会提高细胞疏水性[37]。由于其低温条件下,疏水性处于中等程度,该菌株对底物的吸附能力增强,从而促进菌株对污染物质的降解。而此时细胞的通透性也较强,对硝基苯酚更容易进入到细胞中,因此该菌株在低温修复过程具有很大应用的潜力。

图3 菌株ZL的细胞疏水性Fig.3 Cell hydrophobicity of ZL strain
2.2 Pseudomonas sp.ZL菌株降解性能的研究
2.2.1 初始pH 对菌株ZL 的影响 pH 会影响微生物的表面电荷[38]、离子有机化合物的电离[39],从而影响微生物的降解特性。由图4 可知,在10℃条件下对硝基苯酚降解率和生物量随pH 的升高呈先上升后下降的趋势。pH 为5.0 时,对硝基苯酚降解率仅为20.52%。当pH 为7.0 和9.0 时,对硝基苯酚降解率分别为61.82%和52.92%,且pH 为8.0 时对硝基苯酚降解率最高,为63.94%。由图中OD600值随pH的变化可知,在酸性条件下菌株的生长受到抑制,pH 为5.0 时OD600值为0.008;pH 为8.0 时OD600值为0.071,而pH达到11.0时,OD600值下降明显。研究结果表明,菌株ZL 最佳降解pH 为8.0。产生这种现象的主要原因是微生物降解过程中pH 会改变底物和酶的带电状态,从而影响酶促反应[13]。
2.2.2 盐度对菌株ZL 的影响 盐度对菌株的生长繁殖影响很大,菌株能承受的渗透压不同,盐度过高导致菌株脱水死亡,盐度过低导致细胞吸水涨破死亡。由图5 可知,当盐度超过0.5%后对硝基苯酚降解率和OD600值均呈下降趋势。当盐度达到3.0%,对硝基苯酚降解率低于20%,菌株死亡率升高。相比对照组(0%),高盐度条件下菌株降解能力和细胞生长均受到抑制,产生此现象的主要原因是当盐度变化,细胞与外界渗透压失衡,细胞内水分流失,菌株生长受到抑制[40]。添加0.5%的NaCl的降解率和OD600值比对照组分别高出39.4%和0.01,因此菌株最适盐度为0.5%的NaCl。

图4 不同pH下对硝基苯酚降解率及其OD600Fig.4 The degradation rate of p-nitrophenol and OD600 in different pH
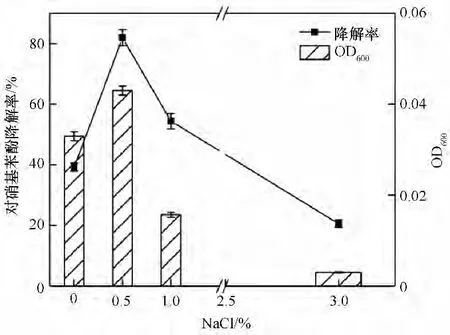
图5 不同盐度下对硝基苯酚降解率及其OD600值随时间的变化情况Fig.5 Degradation rate of p-nitrophenol and OD600value with time at different salinity
2.2.3 外加氮源对菌株ZL 的影响 氮源是微生物生长不可或缺的营养物质,外加氮源可为菌株降解过程补充氮元素用于合成蛋白质[41]。为了给后续污染场地修复提供有效的修复药剂,本文探讨了三种不同种类的氮源对菌株降解的影响。图6为不同外加氮源及浓度对底物降解率的影响,结果表明在相同时间下,氮源的添加均促进了菌株的降解和生长。且1.0 g·L-1的NH4NO3和0.5 g·L-1的(NH4)2SO4对对硝基苯酚降解率的影响较为明显,58 h 后可完全降解100.11 mg·L-1的对硝基苯酚,大大缩短了反应的迟滞时间。由图7 可知,外加氮源NH4NO3比(NH4)2SO4更能够促进菌株的生长,而NaNO3对其降解未产生促进作用,添加1.0 g·L-1的NH4NO3菌株在72 h后OD600值依旧呈上升趋势,96 h后OD600值可达0.111。由此可知,菌株的最适外加氮源为1.0 g·L-1的NH4NO3。
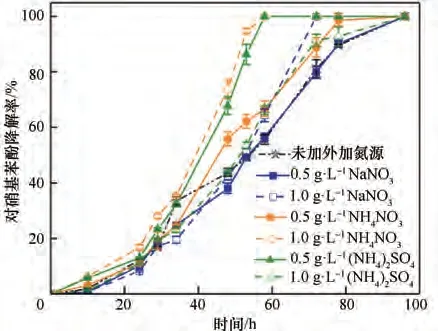
图6 不同氮源对硝基苯酚降解率的影响Fig.6 Effects of different nitrogen sources on the degradation rate of p-nitrophenol
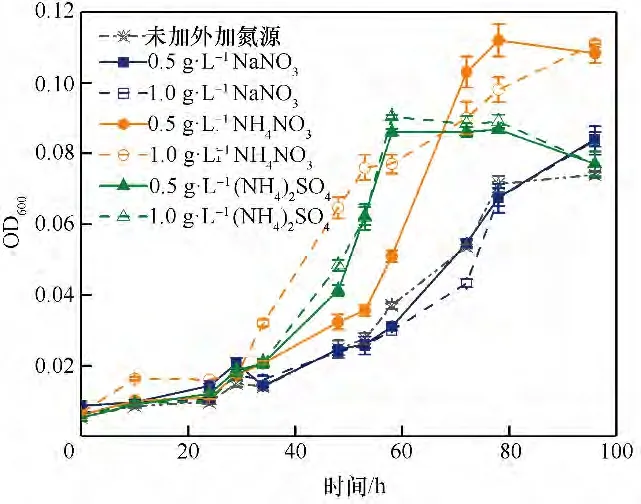
图7 不同氮源下菌株的生长曲线Fig.7 Growth curves of strain at different nitrogen sources
2.2.4 接种量对菌株ZL 的影响 由图8 可知,对硝基苯酚降解率与接种量呈现正相关的趋势;当接种菌株浓度为225.92 mg·L-1、对硝基苯酚浓度为100.34 mg·L-1,低温培养83 h后,对硝基苯酚降解率和OD600值分别达到99.94%和0.068。当接种菌株浓度超过225.92 mg·L-1后,对硝基苯酚降解率和OD600值均有略微下降趋势。由此可知,菌株的最适菌株接种浓度为225.92 mg·L-1。
2.2.5 对硝基苯酚初始浓度对菌株降解的影响 污染物质的浓度对于菌株的降解具有一定的计量效应。由图9、图10可知,对硝基苯酚的初始浓度对菌株的降解影响较大。对硝基苯酚初始浓度越小其降解时间越短,当对硝基苯酚浓度为108.87 mg·L-1时,降解时间为106 h。由于对硝基苯酚对于微生物具有一定的生物毒性,因此当底物浓度增加,降解的迟滞期增加。
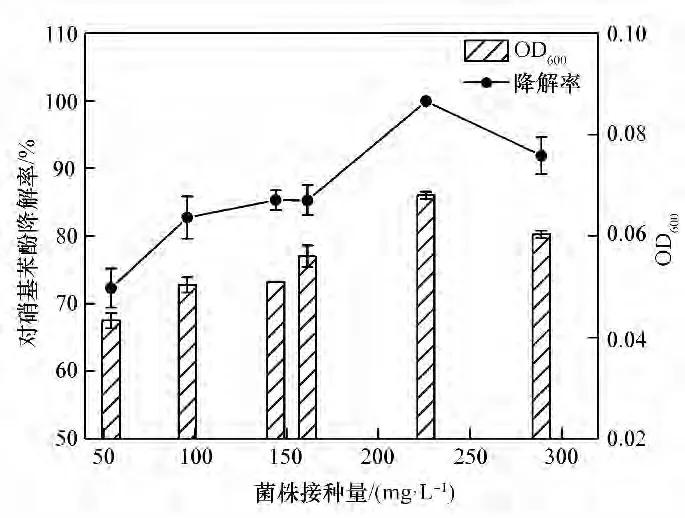
图8 不同接种量下对硝基苯酚降解率及其OD600Fig.8 Degradation rate of p-nitrophenol and OD600 at different inoculations
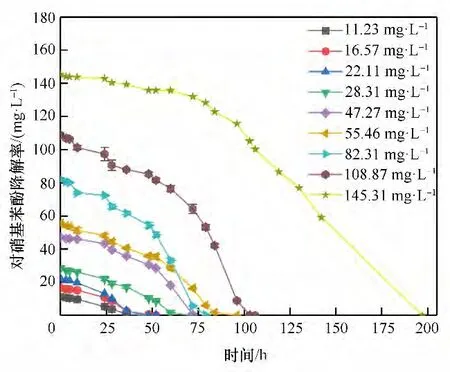
图9 不同对硝基苯酚浓度下菌株对对硝基苯酚降解的影响Fig.9 Influence on degradation at different p-nitrophenol concentrations
2.3 Pseudomonas sp.ZL低温降解动力学研究
为了研究10℃条件下Pseudomonas sp. ZL 降解特性并计算其动力学参数,在菌株的最佳降解条件下,分别配制了不同浓度的对硝基苯酚溶液,低温培养并全程采样。图11、图12 为菌株Pseudomonas sp.ZL的降解曲线。由图11可知,菌株可在108 h内降解106.98 mg·L-1对硝基苯酚,降解率为99.34%,且对106.98~303.71 mg·L-1的对硝基苯酚依然有降解趋势。当对硝基苯酚浓度为139.44 mg·L-1时,抑制作用较为明显,菌株生长速率缓慢,迟缓期延长。当初始浓度为346.31 mg·L-1,菌株未发生降解。由此可知,该菌株在低温条件下,菌株ZL 能够耐受并降解的对硝基苯酚浓度为303.71 mg·L-1。
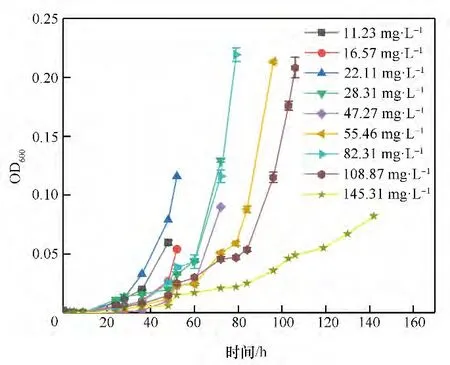
图10 不同对硝基苯酚浓度下菌株OD600值随时间的变化Fig.10 The variation of OD600 value with time under different p-nitrophenol concentration
由于对硝基苯酚的剂量效应产生的抑制作用,菌株的比生长速率会受到影响。由图13可知,通过对Haldane 模型、Aiba 模型、Yano 模型和Webb 模型的拟合,菌株的比生长速率均呈现随着对硝基苯酚浓度的升高先上升后下降的趋势。其中Ks为最大速率一半时的底物浓度[42]。Ki表示底物对菌株的抑制作用,Ki值越高,底物的抑制浓度越小,菌株耐受对硝基苯酚能力越强[43]。表1为菌株ZL在10℃条件下的模型拟合参数,Aiba 模型拟合的R2值为0.988,拟合情况良好,μmax和Ks值分别为0.205 h-1和3.40 mg·L-1,Ki为166.86 mg·L-1。由拟合结果可知,当对硝基苯酚浓度高于166.86 mg·L-1时比生长速率下降,因此166.86 mg·L-1即为该条件下菌株的抑制浓度。目前,针对对硝基苯酚降解菌动力学研究均在25~30℃之间,而10℃条件下的抑制降解动力学的研究尚未发现。表2为不同对硝苯酚降解菌的抑制降解动力学模型参数比较结果,模型中μmax/Ks值为低浓度的对硝基苯酚的一级降解速率常数[27]。在10℃条件下,菌株ZL 的一级降解速率常数为0.060,明显高于大多数30℃下对硝基苯酚降解菌株,由此可知在10℃条件下,菌株ZL对对硝基苯酚的降解能力优于其他对硝基苯酚降解菌。此外,模型中Ks/Ki值可表示菌株受到的抑制作用大小[28],由此可知菌株ZL受到的抑制作用相对于其他菌株更小,而能够耐受的对硝基苯酚浓度和污染物的有效利用率相对于其他菌株来说更高,因此该菌株在修复低温地下水及土壤污染方面具有一定的应用潜力。

图11 对硝基苯酚降解随时间变化情况Fig.11 Degradation of p-nitrophenol changes with time
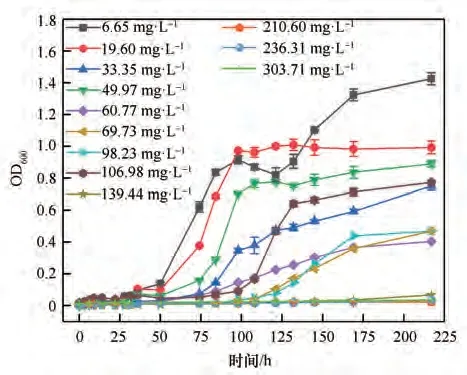
图12 生物量随时间变化情况Fig.12 The variation of biomass with time
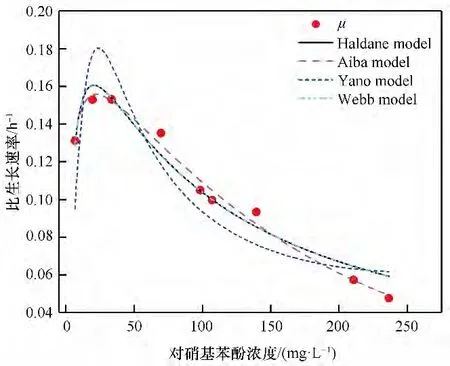
图13 低温降解动力学模型拟合Fig.13 Fitting of degradation kinetic model at low temperature
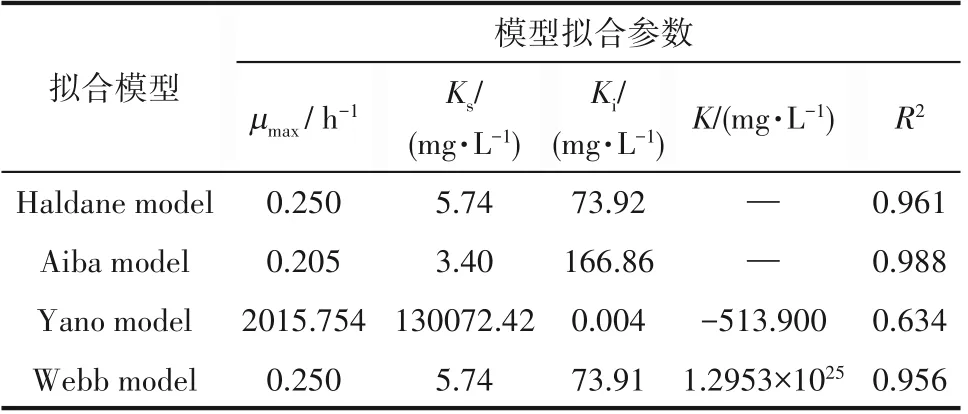
表1 不同模型拟合菌株ZL降解对硝基苯酚动力学参数Table 1 Kinetic parameters of degradation of pnitrophenol by ZL strain fitted by different models
3 结 论
(1)在10℃条件下菌株Pseudomonas sp.ZL 的细胞通透性略高于30℃,而疏水性处于中等程度,说明该菌株在低温条件下对对硝基苯酚的吸附能力较强,因此对污染物质的降解能力也较强。
(2)在10℃条件下菌株Pseudomonas sp.ZL 能够耐受并降解303.71 mg·L-1的对硝基苯酚,该菌株的最 佳 降 解 条 件 为pH=8.0,0.5% NaCl,1 g·L-1NH4NO3,最适初始菌株的接种浓度为225.92 mg·L-1,该条件能够有效促进对硝基苯酚的降解速率并大大缩短降解的延迟时间。
(3)在10℃、最佳单因素条件下,菌株ZL的抑制降解动力学模型符合Aiba 模型,菌株ZL 的最大比生长速率为0.205 h-1,半饱和系数为3.40 mg·L-1,抑制系数为166.86 mg·L-1,即为该条件下菌株的抑制浓度。此外,模型中Ks/Ki值可表示菌株受到的抑制作用大小,由此可知菌株ZL受到的抑制作用相对于其他菌株更小,而能够耐受的对硝基苯酚浓度和物质的有效利用率相对于其他菌株来说更高,因此该菌株在修复低温地下水及土壤污染方面具有较高的应用潜力。
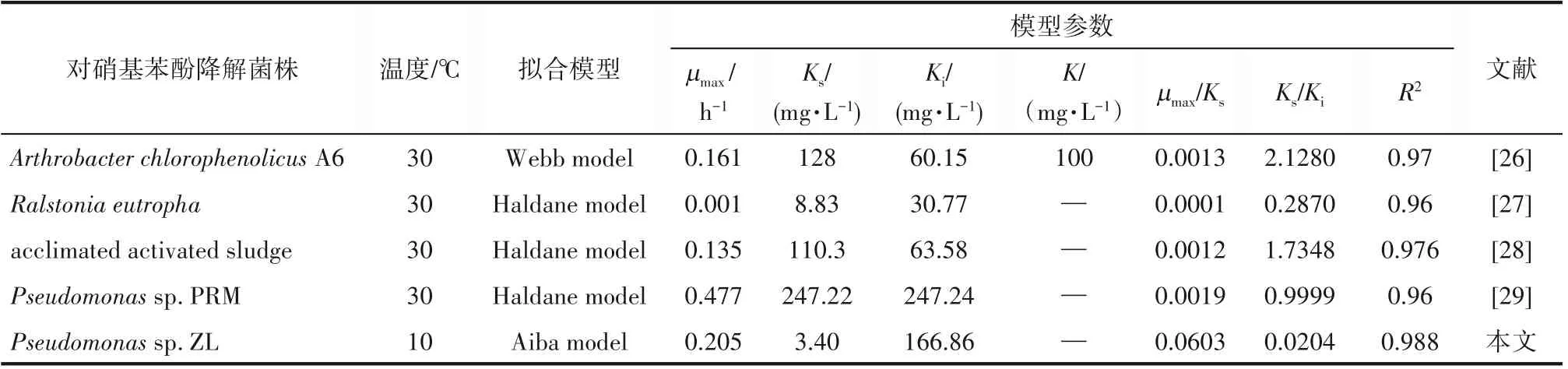
表2 不同对硝基苯酚降解菌降解动力学模型及参数Table 2 Degradation kinetic model parameters of different p-nitrophenol degrading bacteria

