外泌体为载体的微小RNA-1基因运送抑制人口腔鳞状细胞癌CAL-27细胞增殖的研究
伍宝琴 黎春晖 张梦莲 聂敏海
1.西南医科大学口腔医学院口颌面修复重建和再生实验室,泸州646000;2.西南医科大学附属口腔医院牙周黏膜病科,泸州646000
口腔鳞状细胞癌(oral squamous cell carcino‐ma,简称口腔鳞癌)是严重危害人类健康的恶性肿瘤之一,易复发、转移,预后差[1],探索安全高效的口腔鳞癌治疗方案具有重要的科学意义及临床转化价值。外泌体介导的基因及药物运送为肿瘤治疗提供了新的思路。外泌体是由细胞膜两次内陷形成的具有双层膜结构的囊泡状小体,直径30~150 nm[2]。外泌体装载了“发生细胞”的多种信号分子,如DNA、RNA、蛋白质、脂质等[3],并通过与受体细胞的细胞膜融合,将信号分子传递给受体细胞,进而调控受体细胞的生理及病理过程[4]。外泌体具有较低的免疫原性,不引起炎症反应,能够穿过血脑屏障,并且双层膜结构对其携带的内含物有很好的保护作用[5]。2015 年,Toffoli等[6]发现,用外泌体运送阿霉素可在有效抑制乳腺癌生长的同时,显著减少药物在心脏的聚集,降低药物的心脏毒性。Mao 等[2]研究发现,外泌体运送人食管癌相关基因4(esophageal cancer related gene 4,ECRG4)mRNA,可有效抑制口腔鳞癌的生长。Xie 等[7]研究发现,miR-101-3p 过表达的骨髓间充质干细胞外泌体能显著抑制口腔鳞癌的增殖、侵袭及迁移。因此,以外泌体为载体,运送肿瘤抑制基因或化学药物对口腔鳞癌的靶向治疗具有重要的意义。
微小RNA(microRNA,miR)-1 是在肺癌[8]、胃癌[9]、食管癌[10]、前列腺癌[11]等肿瘤组织中显著低表达的非编码RNA,增强miR-1 的表达可显著抑制肿瘤细胞生长、增殖,促进肿瘤细胞凋亡。miR-1 对口腔鳞癌细胞的抑制作用已在SCC-4 细胞系中得以证实[12],是极具潜力的一种肿瘤抑制因子。如何使miR-1在外泌体中大量富集以及外泌体的大规模量化生产是外泌体用于口腔鳞癌治疗的技术难点。本研究用供体细胞基因过表达的方法,通过基因工程技术调控外泌体中miR-1的表达,研究外泌体介导的miR-1基因运送在口腔鳞癌治疗中的作用,旨在为探索安全高效的口腔鳞癌治疗方案准备条件。
1 材料和方法
1.1 实验材料
miR1 过表达质粒pri-miR1-3p-pLVX 由本实验室前期构建,人胚胎肾细胞(human embryonic kidney cell,HEK)293 及人舌鳞癌细胞CAL-27 细胞购自中国医学科学院基础医学研究所细胞中心。脂质体(lipofectamine)2000、DMEM(Dulbecco’s modified eagle medium)培养基、胎牛血清(fetal calf serum,FBS)血清、抗生素、CM-DiⅠ荧光探针、逆转录试剂盒(Thermo fisher 公司,美国),miR-1逆转录、定量聚合酶链反应(quantitative polymerase chain reaction,qPCR)试剂盒及引物(Gene‐Copoeia公司,美国),Quanti Nova SYBR Green聚合酶链反应(polymerase chain reaction,PCR)Kit试剂盒(QIAGEN 公司,德国),异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的鬼笔环肽(phalloidin)(FITC-Phalloidin,北京索莱宝科技有限公司),anti-CD9(sc-13118)、anti-Tsg101(sc-7964)、anti-Alix(sc-53540)抗体(Santa Cruz 公司,美国),PI/RNase Staining Buffer细胞周期检测试剂盒(BD 公司,美国)。引物由成都擎科梓熙生物科技有限公司合成。
1.2 实验仪器
细胞培养箱(Thermo 3111,Thermo fisher 公司,美国)、实时荧光定量PCR仪(CFX96 Touch,Bio-rad 公司,美国)、超高速离心机(Optima L-100XP, Beckman 公司,美国)、酶标仪(Infinite M200,Tecan公司,美国)、透射电子显微镜(Hi‐tachi-7500,Hitachi公司,日本)、纳米颗粒分析仪(NanoSight NS300,Malvern公司,美国)、倒置荧光显微镜(IX51,Olympus 公司,日本)、流式细胞仪(Gallios,Beckman公司,美国)。
1.3 细胞培养及转染
将HEK293及CAL-27细胞培养于含10%FBS、1%青霉素/链霉素的DMEM 培养基,人口腔黏膜上皮角化细胞(normal oral keratinocyte,NOK)培养于Defined Keratinocyte SFM 培养基。采用脂质体转染法建立过表达miR-1 的HEK293 细胞(miR1-HEK293)。转染前1 d接种3×106个HEK293细胞于10 cm 培养皿中,次日取15µg pri-miR1-3ppLVX 质粒及30 µL 脂质体2000,分别经750 µL Opti-MEM 培养基稀释后混匀,室温静置10 min,均匀滴入HEK293 细胞中,细胞在含5% CO2的37 ℃恒温培养箱培养48 h,收集细胞用于后续的qPCR检测。
1.4 外泌体提取与鉴定
外泌体提取采用超速离心法。HEK293细胞及miR1-HEK293 细胞培养至密度约90%后,更换为无血清的DMEM 培养基,继续培养48 h,收集培养基,分别经4 ℃300 g 离心15 min,取上清;4 ℃2 000 g离心15 min,取上清;4 ℃10 000 g离心30 min,取上清;4 ℃100 000 g 离心70 min,弃上清,沉淀溶于预冷的磷酸盐缓冲液(phos‐phate buffer saline,PBS);4 ℃100 000 g 离心70 min,沉淀为外泌体,重悬于预冷的PBS 溶液,-80 ℃保存备用。BCA 试剂盒检测外泌体蛋白质浓度,透射电子显微镜放大150 000 倍检测外泌体的形态,纳米颗粒分析仪检测外泌体的粒径,West‐ern blot 检测外泌体标志蛋白CD9、Alix、Tsg101,qPCR 检测HEK293 细胞外泌体(CON-EXO)及miR1-HEK293 细胞外泌体(miR1-EXO)中miR-1的表达水平。
1.5 外泌体向细胞转运
采用亲脂性红色荧光探针标记外泌体。将1 mmol·L-1的CM-DiI(C7000)加入到外泌体中,终浓度1µmol·L-1,置于37 ℃孵育30 min,4 ℃孵育15 min;4 ℃100 000 g 离心70 min,弃上清;用预冷的PBS 重悬,4 ℃100 000 g 离心70 min,弃上清,沉淀用预冷的PBS重悬。
CAL-27 细胞中加入CM-DiI 荧光标记的miR1-EXO(10 µg·mL-1),培养24 h 后,细胞用PBS 清洗3 次;4%多聚甲醛室温固定15 min,PBS 清洗5 min,重复3 次;用0.5% Triton X-100/PBS 室温孵育10 min,PBS 清洗5 min,重复3 次;FITCPhalloidin 室温孵育细胞30 min,PBS 清洗5 min,重复3 次;DAPI 标记细胞核后封片,荧光显微镜下放大200倍进行检测。
1.6 qPCR检测
CAL-27细胞分别加入miR1-EXO(10µg·mL-1)、CON-EXO(10 µg·mL-1)和等体积的PBS,置于细胞培养箱中培养24 h 后,细胞用PBS 清洗3 次,用qPCR检测细胞中miR-1及下游靶基因MET的表达水平。细胞总RNA 提取使用TRIzol 试剂进行。miR-1 表达检测使用All-in-One™RT-PCR Detection Kit 试剂盒,以U6 为内参。mRNA 表达检测使用逆转录试剂盒Revert Aid First Strand cDNA Synthe‐sis Kit、实时荧光定量PCR 试剂盒SYBR Green PCR Kit。引物序列如下。MET上游引物:5’-AG‐CAATGGGGAGTGTAAAGAGG-3’,下游引物:5’-CCCAGTCTTGTACTCAGCAAC-3’。GAPDH 上游引物:5’-GAGTCCACTGGCGTCTTCA-3’,下游引物:5’-TCTTGAGGCTGTTGTCATACTTC-3’。
1.7 细胞增殖实验
采用噻唑蓝比色法(methyl thiazolyl tetrazolium,MTT)检测miR1-EXO 对CAL-27、NOK 细胞增殖的影响。
将CAL-27 细胞接种于96 孔板中(每孔5 000个)培养过夜后,将培养基分别更换为含10µg·mL-1CON-EXO、miR1-EXO、等体积PBS和0.5µmol·mL-1阿霉素的DMEM 完全培养基,其中0.5 µmol·mL-1阿霉素作为抑制CAL27 细胞增殖的阳性对照,PBS 作为抑制CAL27 细胞增殖的阴性对照,继续培养48 h,细胞中加入10 µL MTT(5 mg·mL-1),37 ℃培养箱中放置4 h,吸干培养基,每孔中加入150µL的二甲基亚砜(dimethyl sulfoxide,DMSO),室温低速震荡10 min,酶标仪检测吸光度(OD490)。
NOK 细胞接种于96 孔板中(每孔5 000 个)培养过夜后,将培养基分别更换为含10 µg·mL-1CON-EXO、miR1-EXO、等体积PBS 的DMEM 完全培养基,继续培养了48 h 之后,再进行MTT 检测。
1.8 细胞周期实验
采用流式细胞术进行细胞周期检测。CAL-27细胞接种于6 孔板中(每孔0.2×106个),培养过夜,细胞经无血清培养基同步化培养12 h 后,分别更换为含10 µg·mL-1CON-EXO、miR1-EXO 及等体积PBS的DMEM 完全培养基,继续培养48 h。细胞经胰蛋白酶消化后,PBS清洗2次,用预冷的70%乙醇4 ℃下固定过夜,PBS 清洗2 次,加入500 μL PI/RNase 染液室温避光染色15 min,流式细胞仪进行检测。
1.9 统计学分析
采用Graphpad prism 9.0软件进行统计学分析。数据结果以均数±标准差表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析(one-way ANOVA),P<0.05为差异有统计学意义。

图1 外泌体的鉴定Fig 1 Identification of exosomes
2 结果
2.1 miR1-EXO的分离纯化
通过pri-miR1-3p-pLVX 质粒转染HEK293 细胞,建立过表达miR-1 的HEK293 细胞(miR1-HEK293)。qPCR结果显示,miR1-HEK293细胞中miR-1的相对表达量为3 053.00±85.51,HEK293细胞中miR-1 的相对表达量为0.89±0.15,二者间有统计学差异(P<0.000 1),表明miR-1 在HEK293细胞中过表达成功。
超速离心法提取外泌体,透射电子显微镜以及纳米颗粒分析仪检测结果显示,miR1-EXO 及CON-EXO 均呈典型的球形或者杯状结构,直径主要集中在110 nm,Western blot 结果显示,miR1-EXO 以及CON-EXO 均高表达外泌体标志性蛋白CD9、Alix及Tsg101,且二者的形态结构及粒径无明显差异,均符合外泌体的经典特征(图1)。
qPCR 结 果 显 示,miR1-EXO 中miR-1 的表达量为285.80±14.33,CON-EXO 的表达量为1.00±0.06,二者间有统计学差异(P<0.000 1)。这表明,供体细胞基因过表达的方法可使外泌体成功装载大量miR-1,并且大量装载miR-1 并未改变外泌体的形态结构。
2.2 外泌体介导miR-1转运
免疫荧光检测结果显示,与CAL-27 共培养后,miR1-EXO 被CAL-27 细胞摄取,主要分布在细胞质中,围绕在细胞核周围(图2)。qPCR 结果显示,miR1-EXO 组CAL-27 细胞的miR-1 表达水平高于CON-EXO组及PBS组(P<0.000 1),CONEXO 组与PBS 组间无统计学差异(miR1-EXO,5.75±0.23;CON-EXO,1.23±0.23;PBS,1.03±0.13。图3A),表明miR1-EXO 将携带的miR-1 运送到了CAL-27细胞。
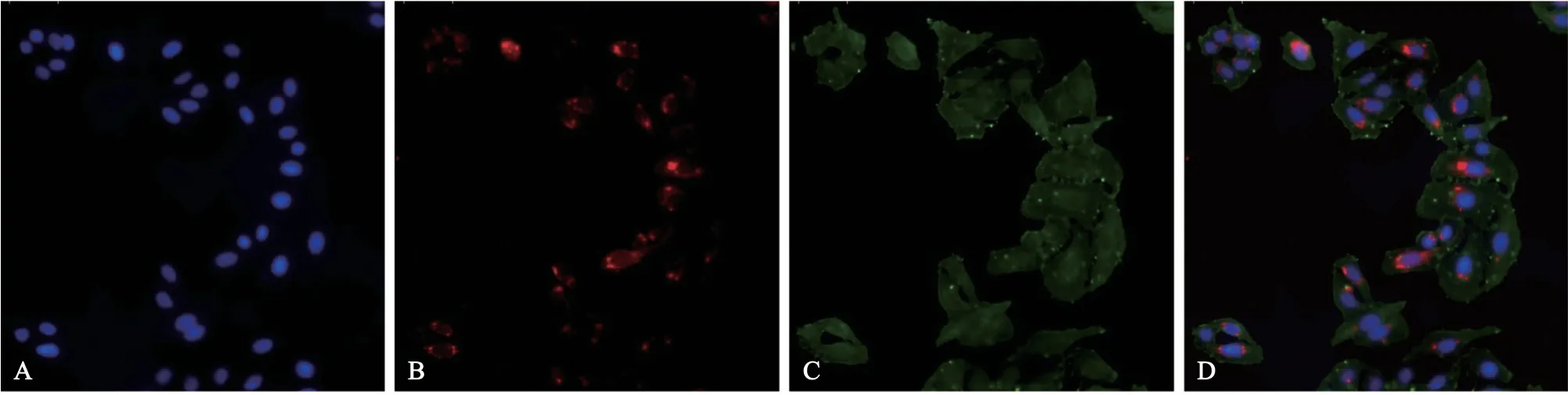
图2 CAL-27细胞摄取外泌体Fig 2 Uptake of exosomes by CAL-27 cells
qPCR 检测CAL-27 细胞中miR-1 下游靶基因MET mRNA 的表达变化,结果显示,miR1-EXO组MET mRNA 的表达水平下调,与CON-EXO 组、PBS 组间有统计学差异(miR1-EXO,0.27±0.04;CON-EXO,0.92±0.03;PBS,1.00±0.04)(图3B),表明miR1-EXO 具有生物学活性,与CAL-27 细胞融合后,显著抑制了miR-1下游靶基因MET mRNA的表达。
2.3 miR1-EXO抑制CAL-27细胞增殖
MTT 及细胞周期检测结果显示,miR1-EXO组CAL-27 细胞活力低于CON-EXO 组和PBS 组,CON-EXO 组和PBS 组间无统计学差异(miR1-EXO,0.79±0.03;CON-EXO,0.93±0.02;PBS,1.00±0.07;阿霉素,0.59±0.03)(图3C);miR1-EXO组G0/G1期细胞比例高于CON-EXO组和PBS组,S 期及G2/M 期细胞比例呈现略低于CONEXO组和PBS组的趋势,但无统计学差异(图4)。这表明,CON-EXO 不影响CAL-27细胞增殖过程,而miR1-EXO 使CAL-27 细胞大量停滞在G0/G1期,阻滞细胞由G0/G1 期进入S 期,最终抑制CAL-27细胞增殖。
NOK细胞MTT检测结果显示,miR1-EXO组、CON-EXO 组的NOK 细胞活力略低于PBS 组(mi-R1-EXO,0.93±0.03;CON-EXO,0.95±0.03;PBS,1.00±0.04)(图3D)。虽然miR1-EXO、CON-EXO与PBS 之间的差异具有统计学意义,但差值很小,miR1-EXO 和CON-EXO 对NOK 细胞活力的影响微乎其微,可以排除2种外泌体对正常口腔上皮细胞具有细胞毒性的风险。
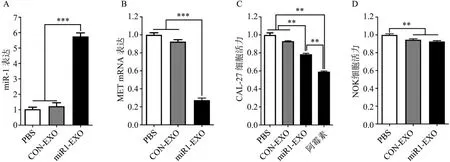
图3 外泌体运送miR-1抑制CAL-27细胞增殖Fig 3 miR-1 was delivered into CAL-27 cells by exosomes and inhibited cell proliferation
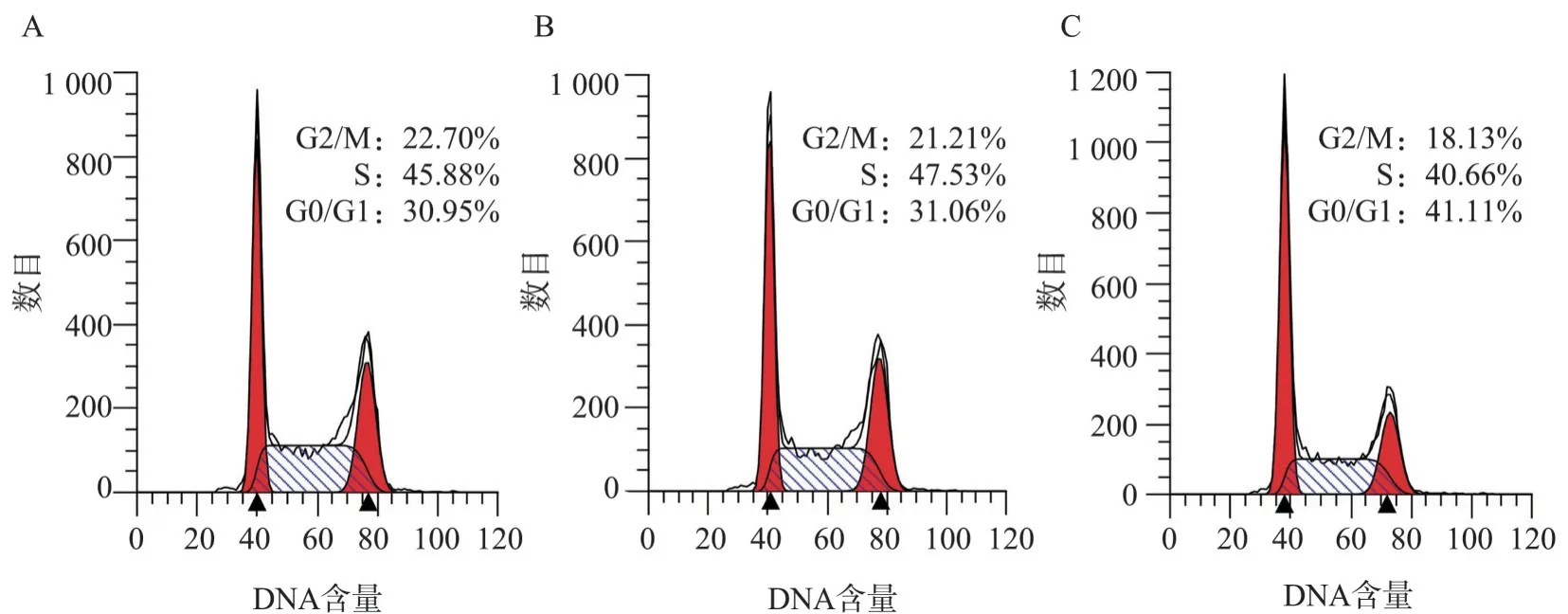
图4 外泌体运送miR-1阻滞CAL-27细胞分裂Fig 4 miR-1 was delivered into CAL-27 cells by exosomes and inhibited cell division
3 讨论
外泌体是细胞内源分泌的纳米尺寸囊泡,无免疫原性,不引起炎症反应,可作为一种潜在的药物运送载体。因此,如何使具有治疗作用的外源基因和药物在外泌体中富集是外泌体治疗的技术难点。研究显示,反复冻融[13]、电穿孔[14]、超声波处理[15]及基因工程[2]等方式都可以用于外源基因、化合物在外泌体中的富集。反复冻融、电穿孔及超声波处理是将外泌体提纯后,通过物理手段改变外泌体的膜结构,使外源基因或药物进入到外泌体中,可以理解为外泌体被动装载的过程。
本研究根据外泌体形成的生物学过程,用基因工程的方式将miR-1在供体细胞过表达,进而供体细胞的细胞膜内陷形成外泌体时,就会主动包裹胞浆中大量存在的miR-1,可以理解为外泌体主动装载的过程。本研究中miR1-HEK293 细胞外泌体的miR-1 含量大量增加,并且miR-1 的大量富集并没有改变外泌体的形态结构。用抗生素筛选、流式分选等方法建立miR1-HEK293 稳定表达的细胞株,就可以用于源源不断的产生大量富集miR-1的外泌体。因此,供体细胞基因工程修饰的方式不仅可以作为外泌体装载外源基因的有效手段,而且为大量富集外源基因的外泌体的大规模量化生产奠定了重要的基础。
外泌体介导的基因及药物运送为肿瘤靶向治疗提供了新的思路。Hadla 等[16]证实,外泌体可提高阿霉素对小鼠乳腺癌和卵巢癌的治疗效果,并降低药物的心脏毒性。Mao 等[2]证实,用外泌体运送人食道癌相关基因4,可有效抑制口腔鳞癌的生长。Naseri 等[17]用骨髓间充质干细胞外泌体运送miRNA-142-3p拮抗剂,可抑制乳腺癌的发生。
miR-1是骨骼肌细胞发育的重要调控因子,在骨骼肌中广泛存在,在肿瘤组织中其表达量显著降低。研究显示,在前列腺癌[9,18]、肺癌[19]和结肠癌[20]模型中,miR-1 通过抑制原癌基因MET 的表达,抑制肿瘤细胞生长。miR-1可通过与原癌基因MET mRNA 的3’UTR 结合,抑制基因表达,通过负调控Met/Akt/mTOR 信号通路,抑制肿瘤细胞的增殖和迁移[18]。本研究发现,大量装载miR-1的外泌体可以将miR-1运送到CAL-27细胞,使MET表达下调,延缓细胞由G0/G1期进入S期,抑制细胞生长。由此推测,外泌体介导的miR-1运送可能通过负调控MET 及其下游信号通路,抑制CAL-27细胞增殖。
外泌体是否具有潜在的细胞毒性是决定其能否用于肿瘤临床治疗的重要问题。本研究结果表明,miR1-EXO 显著抑制了口腔鳞癌CAL-27 细胞增殖,而对NOK 细胞不具有细胞毒性,证明了外泌体运送miR-1用于口腔鳞癌治疗的有效性和安全性。本研究用供体细胞过表达的方法实现了外泌体装载并运送肿瘤抑制基因,抑制肿瘤细胞生长,为外泌体介导的口腔鳞癌的靶向治疗准备了必要的条件。
利益冲突声明:作者声明本文无利益冲突。

