芦笋-杏鲍菇发酵型饮料制备与组分检测*
刘 飞,王黎明,董玉玮**,王克勤,周天宇,陈学红,苗敬芝
(1.徐州康汇百年食品有限公司,江苏 徐州 221743;2.徐州工程学院食品与生物工程学院,江苏 徐州 221018)
随着生活水平的提高,消费者对饮料的喜好和需求发生了巨大的变化,近几年具有营养兼保健功能的饮料,销售量大幅度增长,但这类饮料中,对人体健康有益的发酵饮料、食用菌饮料占比较小,并且食用菌饮料中又有相当一部分直接采用子实体为原料生产,无法最大限度的发挥食用菌的营养和功能。采用深层发酵技术生产食用菌饮料,能很好的保留食用菌的功效[1],同时原料中部分成分被降解,形成许多新的营养和保健成分及新的风味物质,是其他饮料所无法比拟和代替的,因此开发新型发酵型食(药) 用菌饮料的发展前景广阔。
芦笋(Asparagus officinalis L.),属于百合科(Liliaceae) 天门冬属(Asparagus),富含蛋白质、矿物质等营养成分[2],还含有多酚、皂苷、多糖等功能成分[3],具有抗癌[4]、抗衰老、抗紫外线[5]等作用。芦笋根茎中含有大量木质素、纤维素[6],略影响其口感。杏鲍菇(Pleurotus eryngii)又名刺芹侧耳,因具有杏仁香味和鲍鱼口感而得名,隶属担子菌门(Basidiomycota) 伞菌目 (Agaricales) 侧耳科(Pleurotaceae) 侧耳属 (Pleurotus)[7]。杏鲍菇富含高蛋白、人体必需的各种氨基酸[8]和丰富的生物活性物质,如多糖、脂类、多肽、三萜类化合物等[9],具有降血糖、降血脂、增强人体免疫力、美容养颜等功效[10]。杏鲍菇具有分解、利用纤维素、木质素的能力[11],同时芦笋根茎中含有的蛋白质、维生素、矿物质等营养成分[12]也可作为食(药) 真菌生长的原料。因此以芦笋根茎为液体培养基,液体发酵食用菌生产饮料,融合了真菌和植物营养的成分,具有天然绿色、健康、原料成本低等优势,提升了饮料的价值,有利于扩大发酵型饮料市场,具有较好的开发潜力和市场应用价值[13]。
以芦笋为主要原料,杏鲍菇为发酵菌种,采用液体深层发酵技术,制备芦笋-杏鲍菇发酵型饮料,充分利用了杏鲍菇自身营养,并结合芦笋的营养成分,形成了独特的营养价值,为提升芦笋和杏鲍菇的深加工提供了技术支持。
1 材料与方法
1.1 材料、试剂和仪器
1.1.1 材料和试剂
芦笋,由徐州山崎农产品技术研发有限公司提供;杏鲍菇为实验室保存的高活性杏鲍菇菌种;羧甲基纤维素钠(CMC-Na)、黄原胶、β-环状糊精、柠檬酸购于河南经斯达食品添加剂有限公司;蜂蜜产于河南长生园蜂业有限公司;单糖、氨基酸标准品(鼠李糖、阿拉伯糖、木糖、赖氨酸、苏氨酸、脯氨酸等)、乙腈(色谱纯)购于国药集团化学试剂有限公司;其他试剂均为国产分析纯购于天津市恒兴化学试剂股份有限公司。
1.1.2 试验仪器
DNP-9096电热恒温培养箱,苏州威尔实验用品有限公司;HH-1电热恒温水浴锅,常州蒙特仪器制造有限公司;XFH-40MA高压蒸汽灭菌锅,上海坤天实验室仪器有限公司;GZX-DH.730-Ⅱ电热恒温干燥箱,深圳市哈赛科技有限公司;QOP-205E/B冷藏冷冻箱,上海双旭电子有限公司;7230G可见分光光度计,上海双旭电子有限公司;80-1低速离心机,常州金坛三和仪器有限公司;JA7603N电子天平,河北双鑫试验仪器制造有限公司;1260液相色谱仪,美国安捷伦科技有限公司。
1.2 培养基
1.2.1 液体发酵培养基
将芦笋洗净并用粉碎机粉碎,称取6.3%的鲜芦笋倒入500 mL三角瓶中,加入3.5%的酵母膏及250 mL纯水,封口灭菌。
1.2.2 斜面培养基
配制马铃薯葡萄糖琼脂斜面培养基:按照GB 4789.15-2010食品卫生微生物学检验霉菌和酵母计数的方法配制培养基[14],用于菌种的复苏及保存。
1.3 菌种活化与发酵
在无菌操作台内将杏鲍菇菌种接入斜面培养基中,28℃培养箱培养6 d~8 d。挑选长势较好菌种,接种于芦笋液体发酵培养基中,28℃、120 r·min-1摇床培养7 d~9 d。
1.4 稳定剂单因素试验
将发酵液研磨后装入离心管中离心。4 000 r·min-1离心机离心10 min,取上清液。单因素试验重复3次,取平均值。
1.4.1 黄原胶的添加量
在装有上清液的离心管中分别加入0.04%、0.05%、0.06%、0.07%和0.08%的黄原胶,静置12 h以上,计算稳定系数。
1.4.2 羧甲基纤维素钠的添加量
在装有上清液的离心管中分别加入0.05%、0.10%、0.15%、0.20%和0.25%的羧甲基纤维素钠,静置12 h以上,计算稳定系数。
1.4.3 β-环状糊精的添加量
在装有上清液的离心管中分别加入0.20%、0.30%、0.40%、0.50%和0.60%的β-环状糊精,静置12 h以上,计算稳定系数。
1.4.4 稳定性测量
将杏鲍菇发酵液于离心机3 000 r·min-1离心10 min,在750 nm下测定吸光度,计算稳定性系数R。R值越大,表示悬浮粒子在发酵液中的沉降速度越小,饮料越稳定[15],其计算公式为:

式中:A1为离心前的吸光度值;A2为离心后的吸光度值。
1.5 稳定剂正交试验
将饮料使用的β-环状糊精、黄原胶、羧甲基纤维素钠几种稳定剂用L9(34)正交表进行设计试验,根据正交表确定试验内容,得到主次影响因素。
1.6 调配剂单因素试验
在饮料中分别加入1%、1.5%、2%、2.5%和3%的蜂蜜,溶解均匀后品尝并打分;在饮料中分别加入6%、7%、8%、9%和10%的蔗糖,溶解均匀后品尝并打分;在饮料中分别加入0.05%、0.10%、0.15%、0.20%和0.25%的柠檬酸,溶解均匀后品尝并打分。单因素试验均重复3次,取平均值。
1.7 调配剂响应面试验设计
在单因素实验后,取最优结果及附近的一共3组数据使用Design-Expert 8软件,设计方案,并进行试验。因素水平见表1。

表1 试验因素与水平Tab.1 Factors and levels of experiment
1.8 饮料的感官评定
饮料的感官评定会从甜度、酸度、香味、色泽给出结果。随机邀请15位具有一定食品感官评定基础的专业人员进行品尝,打出分数,每次品尝前都用温水漱口。感官评分标准见表2。

表2 饮料感官评分标准Tab.2 Sensory evaluation criteria for beverages
综合感官评价分值(W,分)计算公式为:

式中:a为甜度分满分25分;b为酸度分满分25分;c为香味分满分25分;d为色泽分满分25分。
1.9 多糖的提取和测定
1.9.1 粗多糖的提取
将制备后的饮料4 000 r·min-1离心10 min,取上清置于50℃烘箱中烘至原体积1/5,再加入5倍体积95%乙醇,4℃冰箱中过夜醇沉后,4 000 r·min-1离心5min,取沉淀于50℃烘箱烘干,得粗多糖。
1.9.2 粗多糖纯化
粗多糖采用Sevag法脱蛋白[16]。将1 g粗多糖加入10 mL纯水溶解,加入2.5 mL Sevag试剂(氯仿∶正丁醇=5∶1),将混合溶液装入分液漏斗中震荡18 min~20 min,取上层溶液 4 000 r·min-1离心 15 min,弃下层液体,上清液重复上述操作,至无蛋白质层,合并上清液备用。取截流分子量为6 000 kDa~8 000 kDa的半透膜袋,沸水水浴5 min,纯水将其冲开,封住一端,将上述所得上清液倒入后封住开口另一端,置于装有纯水的烧杯中,用磁力搅拌器透析,每隔2 h换1次水,2 d后烘干即为精制多糖。
1.9.3 多糖测定
将1 g粗多糖加入100 mL蒸馏水充分溶解,取2 mL多糖溶液,加1 mL 6%苯酚,5 mL浓硫酸,混匀,100℃水浴15 min,冷却至室温,于490 nm处测定吸光度值,对照组为蒸馏水。经标准曲线计算多糖含量。
1.9.4 葡萄糖标准曲线制作
将40 g葡萄糖放入500 mL的烧杯中,加蒸馏水定容。分别吸取0.4 mL、0.6 mL、0.8 mL、1.0 mL、1.2 mL、1.4 mL、1.6 mL、1.8 mL、2.0 mL 的葡萄糖溶液于试管中,并编号为1~9,加蒸馏水定容到2.0 mL,再在试管中加入1 mL 6%的苯酚溶液与5 mL的浓硫酸,充分混匀后放入100℃水浴锅中水浴15 min,冷却后于波长490 nm处测量各个试管中溶液的吸光度值。
1.10 高效液相色谱法检测单糖和氨基酸组分
称取适量多糖样品,加入2 mol·L-1三氯乙酸溶液0.5 mL,在116℃水解100 min,吹干。试管中加入5 μL单糖标准品,加入2 mol·L-1三氯乙酸溶液0.5 mL,在116℃下水解100 min,吹干。在处理后的单糖样品中加入溶于无水甲醇的0.5 mol·L-1的1-苯基-3-甲基-5-吡唑啉酮(PMP) 试剂和0.3 mol·L-1的NaOH溶液各0.5 mL,68℃水浴28 min。冷却后,加入0.3 mol·L-1HCl 0.5 mL。加入0.5 mL氯仿,充分震荡萃取后,5 000 r·min-1离心5 min去除氯仿层。水层用0.22 μm滤膜过滤。色谱柱为SHISEIDO C18柱 (4.6 mm×250 mm,5 μm),柱温 25℃,波长为245 nm,流动相为0.1 mol·L-1pH 6.8磷酸盐缓冲液 ∶乙腈为 82∶18 (v/v),流速为 1.0 mL·min-1,进样量 10 μL。
HPLC检测氨基酸:样品中加入20 mL盐酸后,干燥,110℃水解,降温,比色管中定容。取1 mL在85℃下氮气流吹干。加入10 mL 0.02 mol·L-1盐酸,震荡。分取 500 μL,加 250 μL 0.1 mol·L-1异硫氰酸苯酯乙腈和250 μL 1 mol·L-1三乙胺乙腈,衍生1 h。加2 mL正己烷,震荡,静置,取下层,过0.45 μm有机膜上机。色谱柱为SHISEIDO C18柱(4.6 mm×250 mm,5 μm),流动相为 A:0.1 mol·L-1无水乙酸 ∶乙腈为97∶3(调pH 6.5);流速为1.0 mL·min-1;柱温 40℃;进样量 10 μL,波长为 245 nm。采用外标法对饮料样品的高效液相色谱图中各氨基酸的峰面积进行积分测定氨基酸种类,并计算质量百分比。
1.11 微生物检测
按照GB 4789.2-2016食品安全国家标准 食品微生物学检验菌落总数测定方法进行菌落总数测定[17],按照GB 4789.3-2016食品安全国家标准食品微生物学检验大肠菌群计数方法对进行大肠杆菌计数[18],按照GB 29921-2013食品安全国家标准食品中致病菌限量标准进行致病菌检测[19]。
1.12 数据分析
所有数据均采用表示,用Origin 2017软件作图。
2 结果与讨论
2.1 稳定剂的单因素实验
2.1.1 黄原胶添加量的确定
黄原胶添加量变化时,发酵液的稳定性结果见图1。

图1 黄原胶添加量不同时发酵液的稳定系数Fig.1 Stability coefficient of fermentation broth with different xanthan gum addition
如图1所示,当黄原胶的添加量在0.06%时,饮料稳定系数最大,为93.4%,因此选择添加黄原胶的量为0.06%。张政等[20]制备灵芝—蜂花粉—蜂蜜的液体发酵饮料时,黄原胶添加量在0.05%~0.15%,与上述测定结果基本一致。
2.1.2 羧甲基纤维素钠添加剂的确定
羧甲基纤维素钠添加量变化时,发酵液的稳定性结果见图2。

图2 羧甲基纤维素钠添加量不同时发酵液的稳定系数Fig.2 Stability coefficient of fermentation broth with different amount of sodium carboxymethyl cellulose
如图2所示,当羧甲基纤维素钠的添加量在0.15%时,饮料稳定系数最大,为92.2%,因此确定其添加量为0.15%。黄梅华[21]等以火龙果皮为原料,用乳酸菌发酵后制作饮料,羧甲基纤维素钠的添加量为0.06%~0.12%,在0.12%时饮料最稳定,与上述测定结果基本一致。
2.1.3 β-环状糊精添加量的确定
β-环状糊精添加量变化时,发酵液的稳定性结果见图3。

图3 β-环状糊精添加量不同时发酵液的稳定系数Fig.3 Stability coefficient of fermentation broth with different addition of β-cyclodextrin
如图3所示,当β-环状糊精的添加量在0.4%时,饮料稳定系数最大,为91.2%,所以选择添加β-环状糊精的量为0.4%。王丹[22]在对发酵型牡蛎饮料研究时发现,添加2.5%β-环状糊精时饮料最稳定。
2.2 稳定剂正交试验
为了确定试验稳定剂黄原胶(A)、羧甲基纤维素钠(B)、β-环状糊精(C) 的最佳用量,水平分析见表3,根据正交表进行试验获得数据见表4。

表3 稳定剂添加量水平表Tab.3 Stabilizer addition level table

表4 稳定剂正交表Tab.4 Orthogonal table of stabilizers
由表4可知,对比极差项R,B>A>C,即羧甲基纤维素钠对发酵液稳定性影响最大,其次是黄原胶,最后是β-环状糊精。正交试验得出最优组合是B2A2C2,即0.15%羧甲基纤维素钠,0.06%黄原胶,0.4%β-环状糊精。通过验证,在最优组合下发酵液的稳定系数为91.2%。
2.3 调配剂的单因素试验
2.3.1 蜂蜜添加量
在蜂蜜添加量不同时,饮料的感官评分结果见图4。

图4 不同蜂蜜添加量条件下的评分结果Fig.4 Evaluation results of different honey addition
由图4可知,当蜂蜜的添加量为1.5%时评分最高,为94分。因此选择1.0%、1.5%和2.0%的蜂蜜添加量为作为响应面的试验数据。董玉玮[23]等在制备灵芝、金针菇发酵型饮料时,蜂蜜的添加量是1.0%~2.0%,在1.5%时,饮料获得最好的口感,与上述试验结果相近。
2.3.2 蔗糖添加量
饮料在蔗糖添加量不同时,感官评分结果见图5。
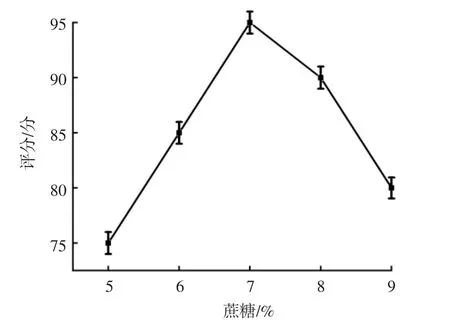
图5 不同蔗糖添加量条件下的评分结果Fig.5 Scoring results under different sucrose addition
从图5可知,当蔗糖添加量为7%时评分最高,为95分。因此选择6%、7%和8%的蔗糖添加量为作为响应面的试验数据。冉景盛[24]等制备灵芝发酵饮料时,蔗糖添加量为6%~12%,与试验结果相似。
2.3.3 柠檬酸添加量
饮料在柠檬酸添加量不同时,感官评分结果见图6。
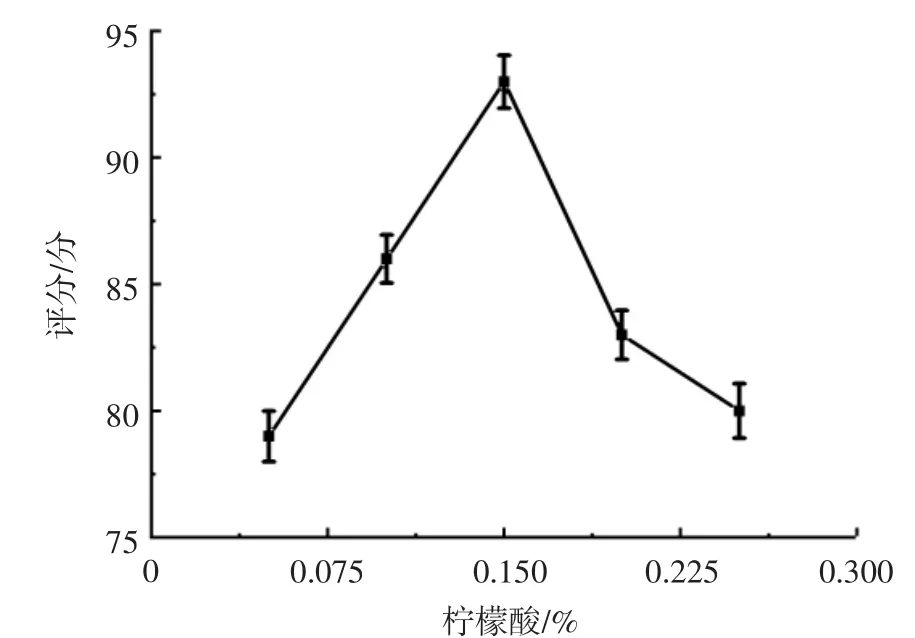
图6 不同柠檬酸添加量条件下的评分结果Fig.6 Scoring results under different citric acid addition
从图6可知,当柠檬酸添加量为0.15%时评分最高,为93分。因此选择0.10%,0.15%和0.20%的柠檬酸添加量为作为响应面的试验数据。赵磊等[25]对植物乳杆菌发酵紫薯饮料研究时发现,柠檬酸的添加量为0.1%~0.2%,0.1%时口感最好,接近试验的添加量。
2.4 响应面试验设计
通过响应面软件给出的17种条件进行试验,得到的感官评分结果见表5。

表5 响应面分析方案与结果Tab.5 Response surface methodology and results
从表5可以看出,当蜂蜜(X1) 添加量为1.5%、蔗糖(X2) 添加量为7%、柠檬酸(X3) 添加量为0.15%时,感官评分最高,为93.09分,应将此范围作为最佳响应区域。
2.5 回归模型的建立和检验
对蜂蜜(X1)、蔗糖(X2) 柠檬酸(X3) 3单因素进行回归拟合,回归方程为:

其具体统计分析结果如表6所示。

表6 回归模型方差分析Tab.6 Analysis of variance in regression model
回归模型达到了极显著水平;失拟项 P值>0.05,影响不显著,试验无失拟因素存在,能充分反映实际情况;决定系数R2为0.991 6,说明实际结果与模型预测结果的一致性良好;R2adj=0.980 8,试验结果有98.08%受试验因素影响。该模型拟合程度好,可以用该模型对芦笋-杏鲍菇发酵型饮料制备工艺进行分析和预测。由回归方程和方差分析可知,模型中X2、X1X2、X1X3对芦笋-杏鲍菇发酵型饮料感官评分的影响为极显著,X1、X3对芦笋-杏鲍菇发酵型饮料感官评分的影响为显著。各因素对感官评分的影响依次为 X2>X1>X3,即蔗糖>蜂蜜>柠檬酸。
2.6 两因素间交互作用分析
各因素间的交互作用分析见图7。

图7 响应面分析图和等高线图Fig.7 Response surface analysis chart and contour map
由图7a可知,蔗糖添加量与柠檬酸添加量的交互作用最显著,蔗糖添加量对试验结果影响的显著性大于柠檬酸添加量。由图7b可知,蜂蜜添加量与柠檬酸添加量的交互作用较显著,且蜂蜜添加量影响的显著性大于柠檬酸添加量。由图7c可知,蔗糖添加量与柠檬酸添加量的交互作用不显著。比较3组图可知,蔗糖添加量对感官评分结果的影响最显著,表现为曲线较陡,蜂蜜添加量、柠檬酸添加量的影响较显著,表现为曲线较平滑。3因素对感官评分结果的影响及各个因素间的交互影响与回归分析结果吻合。
2.7 调味剂最优分析和结果验证
回归模型确定的最佳制备工艺为蜂蜜、蔗糖、柠檬酸的最佳添加量分别为1.34%、7.06%、0.15%,此条件下对饮料最高的感官评分是93.22分。为了验证此最佳方案,按该最优调味剂添加量进行后续的验证试验,重复3次,试验结果取平均值,得到评分结果为92.74分。与响应面分析结果很接近,说明该模型具有较高可靠性。
2.8 饮料成品卫生指标检测
检测得到菌落总数95 CFU·mL-1,未检出大肠杆菌和致病菌,符合国家食品生产卫生标准。
2.9 芦笋-灵芝发酵型饮料营养成分的检测
2.9.1 多糖红外光谱检测结果
饮料多糖的红外光谱检测图见图8。
从图8可知,芦笋-杏鲍菇发酵型饮料多糖具有典型的多糖特征吸收峰,3 422 cm-1处有强的-OH伸缩振动吸收峰,1 631 cm-1处为酰胺基的振动吸收峰,2 925 cm-1、1 419 cm-1、1 263 cm-1处有-CH3、-CH2、-CH等的-CH变角振动吸收峰,1 349 cm-1为-OH变角振动吸收峰,1 218 cm-1处有-COOH中-OH变角振动吸收峰,1 127 cm-1有吡喃糖环醚键中的C-O伸缩振动,1 031 cm-1处的则是醇羟基的变角振动吸收峰,1 097 cm-1和1 031 cm-1分别代表C=O的环醚C-O-C伸缩振动和C-O-H的-OH可变角振动,803 cm-1处是甘露糖的振动吸收峰。综合后可推断,饮料多糖是吡喃型多糖类化合物。

图8 饮料多糖红外光谱检测图Fig.8 Infrared spectra of beverage polysaccharide
2.9.2 多糖中单糖组分的检测
标准曲线回归方程(R2=0.990 2)为:

最佳工艺制备的饮料,含有杏鲍菇多糖1.74 mg·mL-1。多糖中单糖组分色谱图见图9。

图9 饮料多糖中单糖组分的高效液相色谱图Fig.9 High performance liquid chromatography of monosaccharide components in beverage polysaccharide
由图9可知,饮料多糖单糖组分包含甘露糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、木糖和阿拉伯糖。罗懿洋等[26]研究了杏鲍菇多糖中单糖的组成分析是甘露糖、核糖、鼠李糖、葡糖醛酸、葡萄糖、木糖、半乳糖和岩藻糖,与本结果相比多了核糖和岩藻糖。伍善广等[27]采用高效液相色谱法检测获得杏鲍菇多糖的单糖组成为甘露糖、核糖、鼠李糖、葡萄糖、半乳糖和木糖,与本结果相比多了核糖、鼠李糖、和岩藻糖。可能原因是杏鲍菇分解了芦笋中的纤维素、木质素,利用其作为碳源,重组了多糖组分。该饮料中单糖的组分含量见图10。

图10 单糖组分含量结果Fig.10 Monosaccharide content results
通过图10可知,饮料多糖的单糖组分含量中,葡萄糖、甘露糖、半乳糖、木糖和阿拉伯糖含量较高,其中葡萄糖的含量最高,为33 285.26 mg·kg-1。罗懿洋等[26]研究表明杏鲍菇多糖中葡萄糖、甘露糖与半乳糖含量较高,葡萄糖含量最高,伍善广等[27]研究结果中,发现杏鲍菇多糖中葡萄糖含量占比也最大,与研究结果基本一致。
2.9.3 氨基酸组分测定
氨基酸组分高效液相色谱图见图11,其基本组分见图12。

图11 氨基酸组分高效液相色谱图Fig.11 High performance liquid chromatography of amino acids

图12 饮料中氨基酸组分Fig.12 Amino acids in beverages
由图11及图12可知,饮料中富含天冬氨酸、胱氨酸、甘氨酸等17种氨基酸。其中脯氨酸含量最高,为914.57 mg·kg-1,必需氨基酸与氨基酸总量比值为27.60%,必需氨基酸与非必需氨基酸的比值为38.12%,天冬氨酸和谷氨酸2种呈鲜味氨基酸含量占25.67%,9种药效氨基酸含量高达58.07%,说明制备的芦笋-杏鲍菇发酵型饮料口感鲜美,营养价值高,具有良好的营养和保健功效。
3 结论
通过单因素试验,3种稳定剂的最佳配方为黄原胶为0.06%,羧甲基纤维素钠为0.15%,β-环状糊精为0.4%。调味剂单因素和响应面试验确定最佳配方为蜂蜜1.34%,蔗糖7.06%,柠檬酸0.15%,此时饮料感官鉴评评分最高,为93.22分;每两个因素间的交互作用对饮料口感影响的大小为:蔗糖和柠檬酸>蜂蜜和柠檬酸>蜂蜜和蔗糖,未检测出大肠杆菌和致病菌,符合国家食品安全标准。
饮料多糖的提取含量为1.74 mg·mL-1。经高效液相色谱分析得出杏鲍菇多糖中的单糖成分有甘露糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、木糖和阿拉伯糖,其中葡萄糖、甘露糖、半乳糖、木糖和阿拉伯糖含量较高。氨基酸组成为天冬氨酸、胱氨酸、甘氨酸等17种,其中脯氨酸含量最高,为914.57 mg·kg-1。

