略论公共健康权优先与药品专利强制许可制度的完善
苟思旭

摘 要:药品专利强制许可制度是在疫情严峻形势下解决药品可及性的重要制度。在传染性极强的突发疫情下,强制许可制度在管控性、可行性、操作性等方面具有独特优势。我国虽已建立药品专利强制许可制度,但一直处于“零实施”的状态,其原因不仅在于相关的法律法规不够完善,还有外部实施环境的缺乏。本文从分析我国药品专利强制许可的缺陷入手,并讨论其他国家相关实践经验,在此基础之上,提出构建更科学且完善的法律制度设计与良性的外部实施环境,以此切实提高药品的可及性,更好地保障我国公民的公共健康权。
关键词:药品专利;强制许可;公共健康
众所周知,药品专利保护制度对维护公共健康起着十分重要的作用。而作为私权的药品专利权与作为人权的公共健康权之间有着根源性冲突,药品专利保护会使部分公众因为无力支付垄断价格而不能及时获得药物治疗。此冲突在重大公共卫生事件中尤为明显。当前,新冠肺炎疫情(COVID-19)对世界公共健康造成了严重的威胁,被世界卫生组织(WHO)列为“国际关注的突发公共卫生事件”。即使是在发达国家仍有许多COVID-19患者因为药品费用过高而难以获得有效的治疗,药品专利权俨然成为人类生命健康乃至公共健康的“阻碍”,如何平衡二者冲突成为一大难题。在此背景下,许多国家的政府决定适用极具强制力的药品专利强制许可制度来解决疫情下的药品可及性问题[1]。药品强制许可作为国家利用其强制力限制专利权,以解决专利保护所带来的问题,能在一定程度上平衡二者冲突。国际上,利用药品专利强制许可制度解决公共健康危机已在一定程度上成为共识,许多国家已经使用药品专利强制许可制度提高药品可及性并卓有成效。国外研究指出,可以成为通过制造和出口专利药品在卫生系统中获得药品的潜在替代或补充[2],“柳叶刀”基本药物政策委员会也建议国家基本药物的有效许可专利立法允许在缺乏自愿许可下进行[3]。
但是不恰当地运用药品专利强制许可制度将侵犯药品专利权,甚至可能导致无人实施药品创新,从而造成“有病却无药”的局面。据此,我国学界对要不要运用以及如何运用药品专利强制许可制度一直有着较大分歧。事实上,我国药品专利强制许可制度已经初步确立,但是一直处于“零实施”的状态。本文将对我国药品专利强制许可制度的缺陷及其他国家对此制度运用的实践经验进行分析,以求在突发的重大公共安全问题的形势下,基于我国国情提出具有中国特色的法律解决方案。
一、我国药品专利强制许可制度的发展演变历程
我国药品专利强制许可制度从无到有,从笼统规范到有专门的实施细则,目前已经建立了符合《TRPIS协议》框架的法律体系。但是,我国药品专利强制许可制度仍存在许多问题,还不能适应我国人口众多、社会环境复杂的基本国情,未能平衡保护药品专利与公共利益之间的关系。
(一)被动初创时期(1984年—2000年)
1984年颁布的我国第一部《中华人民共和国专利法》(以下简称《专利法》),就已经规定了专利强制许可制度。但是在该部《专利法》中排除了对药品的专利权保护,因而此部专利法事实上没有关于药品专利强制许可的规定。1992年,我国与美国签署了《中华人民共和国政府与美利坚合众国政府关于保护知识产权的谅解备忘录》,此条约将药品纳入专利保护范围,并且进一步完善了强制许可的事由,据此我国药品专利强制许可制度初现雏形。
(二)主动形成阶段(2000年—2005年)
进入21世纪以来,国家对知识产权的保护意识加强。《专利法》于2000年进行第二次修改,增加了国家知识产权局及时通知强制许可决定的义务、强制许可的终止事由及司法审查制度,增强了对专利权人的保障。2003年6月国家知识产权局颁布了首部针对强制许可的行政法规《中华人民共和国专利法实施强制许可办法》,细化规定了强制许可的申请事由、许可费用、决定及终止事由等,使得强制许可更具可操作性,但是未对关于药品专利的强制许可进行特别规定。
(三)积极重视阶段(2005年—2008年)
在此阶段,我国充分认识到药品专利权与本国公共利益、公共健康之间的矛盾以及药品专利强制许可制度的必要性。基于“非典”“禽流感”等全國重大传染性疾病的爆发以及国际公约中规定的国内法予以适用的要求,我国颁布了《涉及公共健康问题的专利实施强制许可办法》。该办法将传染性疾病与“公共利益行为”“国家紧急状态”挂钩,并且规定了进口及出口药品专利强制许可的实施事由。2008年修改的《专利法》第六章以十一个条文对专利强制许可进行了更为科学精准的规定,并增加“为了公共健康目的”的强制许可事由,力求平衡药品专利权与公共健康权。
(四)细化实施阶段(2008年至今)
虽然《专利法》明确了专利强制许可的许可事由,但是其有着过于笼统、可操作性不强等问题。2010年以来,我国先后出台《专利法实施细则》《专利强制许可办法》,增设“公共健康危机”作为许可事由,细化了从申请人提出到相关主管部门受理、审查、决定等程序性事项。国务院亦颁布《国务院关于新形势下加快知识产权强国建设的若干意见》《关于改革完善仿制药供应保障及使用政策的意见》,提出了完善强制许可启动、审批和实施程序的重要性及依法分类实施药品专利强制许可,以此提高药品可及性。2020年最新修订的《专利法》并没有关于强制许可制度的变动,但其增设“开放许可”,允许专利权人自愿允许单位和个人使用其专利。此项改动在一定程度上鼓励了在疫情或者其它紧急情形下专利权人积极主动地开放其专利权,为解决冲突提供除强制许可之外的可能性。
二、我国药品专利强制许可制度的关键内容及存在的缺陷
(一)药品专利强制许可的申请主体、申请理由及其缺陷
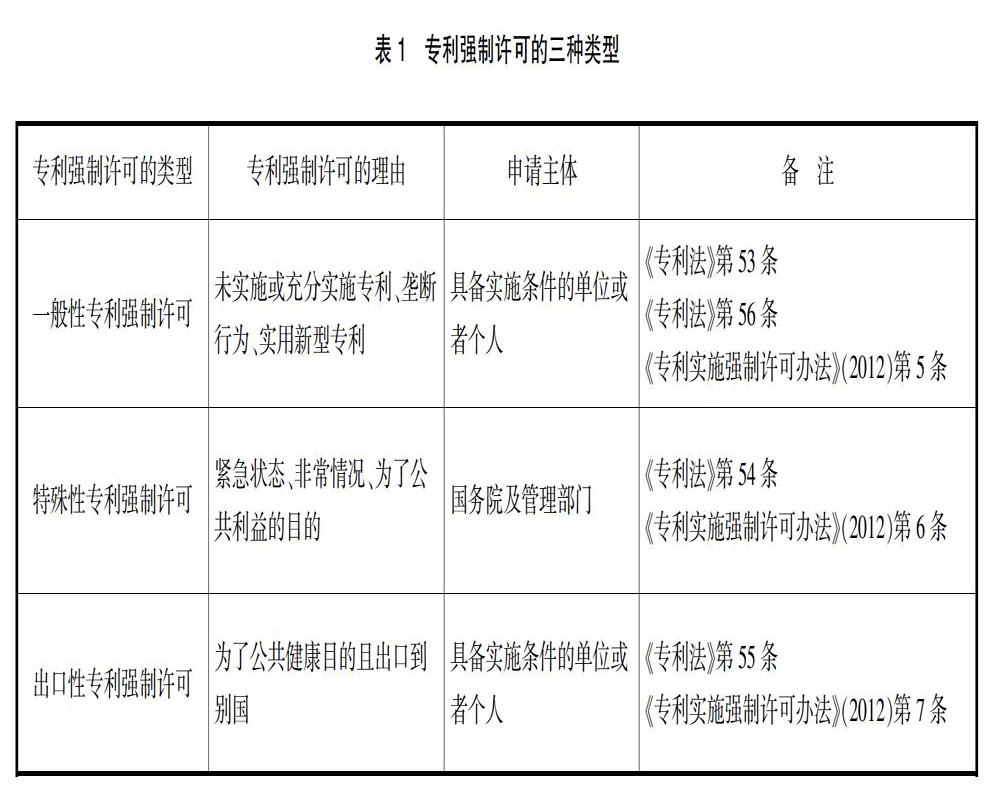
1.药品专利强制许可的申请主体及理由。根据2020年《专利法》,可以将专利强制许可划分为三种类型,即一般性、特殊性以及出口性。一般性及出口性专利强制许可的申请主体都为具备实施条件的单位或者个人,只有特殊性专利强制许可因状态的紧迫性其申请主体规定为国务院及管理部门。不同类型专利强制许可需要不同的申请理由(如表1),虽并不排除使用一般性强制许可作为药品专利强制许可的申请事由,但是药品专利强制许可一般以《专利法》第54条、第55条作为其申请依据更具可行性。
2.申请主体资格要求较为严苛。我国的药品专利强制许可申请主体限制较国际条约及其他国家来说更为严格,一定程度上限制了强制许可制度的实施。根据我国《专利法》的规定,只有“具备实施条件的单位或者个人”才能申请专利强制许可,但“具备实施条件”的限制条件实则排除了“个人”这一申请主体,并且在实践中单位在申请药品专利强制许可时也极易因不具备实施条件而被拒绝。由于药品是挽救人类生命的重要物质,国家对药品的制造、销售、进口等实施行为把控非常严格,药品专利的实施难度极大,在实践中普通的制药企业都很难具备相应实施条件。此外,特殊性专利强制许可的申请主体限制为“国务院及管理部门”,限制了社会主体的申请权利。
3.许可事由抽象不清。特殊性及出口性专利强制许可的许可事由存在表意不清、逻辑不洽的问题。《TRIPS协议》为了让各国根据自身国情利用此制度解决国家问题,将“公共利益”作为协定的基本原则,是一个极具概括性和不确定性的上位概念。《专利法》依据《TRIPS协议》第8条规定,为了“公共利益”的目的可以给予强制许可。在强制许可事由中使用此概念极易造成许可事由不清,导致在实践中相关部门难以判断,从而使得难以适用强制许可。另外,对于出口性强制许可专利的事由亦存在表意不明的问题,我国相关法律法规并未指明“公共健康”的基本含义及范围。从其他国家的法律规定及实践来看,强制许可制度中的“公共健康”并不仅限于传染性疾病,也包括长期并大范围影响公众健康的其它非传染性疾病。而我国法律并未指出是否只限于传染性疾病且我国并无相关的实践,在适用此条款时极易引发争议,导致审批强制许可效率低下及实施困难等问题。
(二)药品专利强制许可的授予流程及缺陷
1.药品专利强制许可的授予流程。根据《专利实施强制许可办法》,专利强制许可的程序性规定共四项,分别为提出申请、受理申请、审查申请及作出决定。三种类型的强制许可程序整体流程是相似的,都是申请主体向国家知识产权局提出申请或建议,再由国家知识产权局作出裁决。若对作出的决定有异议的当事人均可以在收到通知15日内陈述
意见(见图1)。只是特殊性专利强制许可及出口性专利强制许可由于其主要是应对国家紧急状态或为了公共健康的目的而采取的,考虑到时效的重要性并未像一般专利强制许可设定听证程序。
2.许可程序性期限过长。我国药品专利强制许可审批程序繁琐、耗时长。根据《专利法》,一般性强制许可需要经历申请人申请并提交证据、听证、国家知识产权局审查、当事人提出异议等环节;针对“公共利益”及“公共健康”的特殊性及出口性专利强制许可也仅仅是豁免了听证程序。相较其他国家,我国专利强制许可的程序性事项较多。另外,为了保护当事人的利益,我国《专利法》规定了当事人对强制许可决定或许可费用裁决不服时提起行政诉讼的司法救济制度。司法救济程序确实为专利权人及申请人提供了强有力的救济保障路径,但鉴于我国采取两审终审制且强制许可决定及裁决的生效时间为终审判决生效之后,造成了司法救济制度成为强制许可审查通过的障碍,使得原本就实施艰难的制度在申请程序上难上加难。[4]应对国际公共卫生紧急事件最关键的就是及时高效地解决药品可及性的问题,而相关的法律法规并无任何针对公共健康危机的豁免程序,这样复杂的程序将降低药品专利强制许可在应对危机时的效用。
(三)药品专利强制许可的其它缺陷
1.强制许可的时间、范围及许可费用不够明确。《专利法》粗略地规定了强制许可的实施范围、时间及许可费用,并未规定指出需要考量的因素。尤其是在药品专利强制许可中,药品专利的特殊性使得以上问题尤其凸显。当药品专利与公共健康发生冲突时是应当在严重地区许可还是全国范围内许可?当病情发展在难以预料的情况下如何确定许可时间长短?等等这些,都需要更细化的规定,才能使得专利强制许可制度在危机发生时迅速发挥其应有的作用。《专利法》第57条雖规定了先协商后部门裁决的许可费用决定方式,但是《专利法实施细则》以及《专利法实施强制许可办法》都没有明确指出“合理的使用费”的标准,这使得实践中使用费的确定缺乏相应的计算标准,极易导致对专利权人权益的侵犯或是增加被许可者使用此专利的负担。并且此规定会产生许可费用确定耗时长的问题,在突发性疫情时,极易导致强制许可难以迅速发挥效用。
2.保障措施不完善。在强制许可实施后,对专利人的保障及补偿措施不完善。研究一种新药推向市场花费大、时间成本高且成功率极低。为保障公共利益,国家运用强制力通过行政程序直接允许申请人实施专利将会对专利权人的权利及社会研究创新环境产生重大影响。而我国并未对补偿费用标准、计算方法及其它的补偿方式作出规定,这不利于对专利权人的保护。
三、药品专利强制许可制度的比较法实践
实际上已有许多国家运用药品专利强制许可制度或利用其强制性获取有效谈判以解决药品可及性的成功案例,在COVID-19期间世界各国更是积极主动颁发强制许可证或是颁布法律为实施强制许可制度奠定法律基础。国际上的实践极具借鉴意义,为探索如何完善我国药品专利强制许可制度以应对国际公共卫生紧急事件提供了经验。
(一)各国药品专利强制许可实践的总体趋势
自WTO成立以来,大约有20个国家对一种或多种药品颁发了强制许可或利用强制许可作为谈判筹码获取专利权人的自愿许可。在全球的药品专利强制许可实践中,不难发现发展中国家和发达国家有着不同的处理方式。大多数发展中国家对药品专利强制许可的实施条件宽松,并且有相应的实践经验;而大多数发达国家对药品专利的强制许可适用有着更严格的条件,在具体的实践中也更倾向于审慎使用。此外,药品专利强制许可的对象主要是针对极具传染性并且需长期维持治疗的疾病,尤其是针对艾滋病毒(HIV)/艾滋病(AIDS)有关的治疗。当然根据其实践发展的规律,逐渐许可非传染性疾病的相关药物已成必然趋势。
(二)COVID-19时期药品专利强制许可的实践
考虑到此次疫情的突发性、严重性等特征,一些国家已经公开宣布将强制许可制度作为其应对COVID-19的重要措施。在COVID-19期间,相关领域的专家学者发现一种抗逆转录病毒药物lopinavir/ritonavir(AbbViesKaletra)可以为COVID-19患者提供有效治疗。泰国、巴西政府都对此种抗逆转录病毒药物签发许可证,以求其能更好地治疗COVID-19患者。以色列卫生部于2020年3月24日,颁布了一项强制许可证允许该国从印度进口lopinavir/ritonavir的仿制药物。以色列政府的这一举动意义重大,因为在授予许可证之前,国家并不需要与专利持有者协商。此外,专利权人没有司法审查的权利。虽然,Abbvie已经宣布,它将不会在当前大流行的情况下实施专利。[5]但是,以色列政府的应对措施减少了专利强制许可制度的程序性事项的实施时间,极大地增速了实施的进程,有利于更好地应对突发的国际公共卫生事件。
为了能够更好地使用强制许可制度,各国的国内法律必须具备授权此类政府行动的程序。一些国家已经采取立法步骤,确保其政府能够迅速发放强制性许可证,以此应对COVID-19疫情。2020年3月,加拿大、智利、厄瓜多尔、德国及法国等国家的立法机构为签发应对COVID-19的临时许可证奠定了法律基础。加拿大通过《COVID-19紧急应对法》(COVID-19EmergencyResponseAct)修订了《加拿大专利法》(CanadianPatentAct),以求加快以公共卫生为由颁发强制许可的程序进程。该修正允许加拿大政府为必要的创新颁发强制许可证,并允许在以后协商重新使用专利。[6]智利众议院(国会下议院)通过了一项决议,允许使用强制性许可证来预防和治疗COVID-19。该决议宣布,新型冠状病毒的全球化大流行是对COVID-19相关技术给予强制許可的充分理由。[7]同样,厄瓜多尔的国家委员会通过了一项决议,要求厄瓜多尔总统和卫生部长通过使用强制性许可证,向公众免费或以普通公众能够负担得起的价格提供与COVID-19相关的预防、诊断和治疗技术。德国立法机构通过了一项名为《人类传染病预防和控制法案》的新立法,根据这项法案,德国联邦卫生部有权根据《德国专利法》的现有规定颁发强制许可证,政府可以据此为了公共福利或公共安全的利益而规避专利权。法国采取了更为全面的措施,其立法机构颁布了一项新法律(No.2020-290),试图引入一个全新的国家公共卫生法典,允许政府没收商品和服务以对抗卫生灾难,政府有权暂时控制产品的价格并且采取任何必要的措施为患者提供相关药物。这将意味着,如果有必要,法国政府将能够查封药品,并在专利到期前在法国境内直接推出非专利药品。此举被视为COVID-19期间采取的最为强有力的强制许可措施。
四、国际公共卫生紧急事件背景下我国药品专利强制许可制度的完善
药品专利保护有其必要性,但是在面临诸如COVID-19此类疫情的情形下,我国应当通过引领和控制药品专利的方式来维护公共健康安全。学习国际强制许可实践经验及相关立法经验,可以弥补我国药品专利强制许可制度的不足,为在国际公共卫生紧急事件下高效使用强制许可制度,解决药品可及性问题提供基础。
(一)放松申请主体资格限制
建议将《专利法》中关于申请强制许可主体规定的“具备实施条件的单位或者个人”作扩张性解释。“具备实施条件”的规定对申请主体的限制过多,使许多有主观意图申请强制许可的主体不具备申请的基本条件,这就在很大程度上限制了强制许可制度的实施可能性。国际上,相关国际条款及各国法律规定都没有像我国《专利法》对申请主体有着如此严苛的规定。《TRIPS协议》31条(b)项规定的申请主体为“拟使用者”,其并不要求申请主体具备完全的实施条件,而是要求申请主体具有实施的意图。其他国家针对申请主体的相关规定亦是如此,并未对申请主体的实施能力有所限制要求。将申请主体规定中的“具备实施条件的单位或个人”扩张解释为具备一定程度的实施条件即可,并不要求其具备完全的实施条件。这样的做法不仅对申请主体的限制有所放松,为强制许可的实施提供更多的可能性;又能避免完全不具备实施能力的小型企业频繁申请实施增加相关政府部门工作难度。其既符合国际趋势,也契合了我国众多医药企业的客观环境。
(二)明确许可事由
首先,可将“为了公共利益的目的”作为《专利法》第六章专利强制许可的原则性条款,避免包含其它条款内容,导致逻辑不洽的问题。“为了公共利益”实际上能够含括“国家出现紧急状况或者非常情况”的许可事由,且“公共健康”实则也是公共利益的一种。其次,需明确以目标正当性原则来把握“紧急状态或者非常情况”或“公共健康”等相关概念与适用标准,明确了专利强制许可的目标,以便在实践中采取以目的为导向的方法对许可事由进行审核。并且在目的正当性原则的指导下,对相关概念作具体解释也至关重要。尤其是,在国际疫情突发事件频发、公民健康问题愈发严峻且重要的大趋势下,对“公共健康”的定义需格外谨慎。公共健康关注的不是生物医学上被视为“主体”的个人,而是群体人的健康,它涉及的是个体属性度量的集合。[8]因而公共健康问题自然不能仅仅包括大规模的传染病暴发情形,还理应包括患病人数多且长期难以治疗的恶性疾病。并且,从比较法视野来看,许多国家在实践中并没有将许可对象仅限缩于传染性疾病的治疗药物。在我国,慢性非传染性疾病导致的死亡人数占我国总死亡人数的88%。[9]据此,在《专利法实施细则》中理应明确“公共健康”的外延,其不仅包括传染性疾病,也应包括非传染性疾病,以免在具体的实践中限制了该条款的运用。可立足我国国情将心脑血管疾病、癌症、慢性呼吸系统疾病、糖尿病等慢性非传染性疾病纳入公共健康的范围。
(三)简化许可程序规范
首先,应简化审批程序,增加行政机关复审的机制,加快药品专利强制许可制度实施进程。根据《TRIPS协议》第31条第1项有关审查机制的规定,我国选用司法审查制度,并未选用行政机关复审。但行政机关复审的救济方式效率更高,更有助于简化程序性进程。其次,可引入在国际公共卫生紧急事件的情形下司法程序豁免制度,比如限定此情形下直接由最高人民法院或者专门法院审理,以此加快救济进程。再次,效仿英国《专利法》“强制许可制度一经设立立即生效”的规定,不因救济制度阻碍生效时间亦是可行之法。
(四)明确强制许可时间、范围及专利许可费用等细节条款
需在《专利强制许可实施细则》中明确专利强制许可时间及许可范围的考量标准。确认专利强制许可的时间可以通过以申请人的主张为基础,结合强制许可理由的严重程度、专利有效期、药品注册时限等因素进行综合考量。[10]针对专利强制许可的范围,可以同时间考量因素一样,以申请人的主张为基础,注重考虑药品需求的地域范围、受众范围等因素。明确的考量标准将增强强制许可实施的科学性及专利强制许可的可预测性,有利于专利权人未来实施专利规划,更好地保护专利权人的利益。
强制许可使用事实上是一种营利性使用,它限制了知识产权人根据法律规定应当维持的获酬权。[11]因此,即便是在强制许可的情形下,被许可人也不能无偿使用知识产品,必须向专利权人支付合理的许可费用。而如何确认使用费标准是不容忽视的问题,如果标准过低不利于保护专利权人的利益,如果标准过高会导致实际上难以实现强制许可目的。因而,可采用“固定比例法”“成本加利润法”“最高值比较法”等方式[12],综合考虑研发成本、专利的经济价值、强制许可的收益、公众可承担的专利产品价格等因素确定专利许可费用。并且,对许可费用的确认需最大限度地保障意思自治原则,需根据双方的协商确定许可费用。但是在实践中双方协商成功的难度大、耗时长,因此建议在紧急突发事件情况下,允许知识产权局或其它相关部门合理考虑相关因素直接裁决使用费用。
(五)完善保障制度
保障制度对保护专利权人合法权益至关重要,是确保强制许可制度合理有效实施的必要保障。强制许可实际上是一种非自愿的行政许可行为,专利权人的合法权益会因此受到侵害,需明确实施强制许可后政府对专利权人的补偿标准。要扩充补偿方式,可充分考量相关因素,借鉴欧美国家的专利期限延长制度,适当延长被强制许可专利的专利期限。2017年10月中共中央办公厅、国务院办公厅发布了《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,提出开展药品专利期限补偿制度试点,但该《意见》并未得到很好地实施。应根据此《意见》细化相关法律法规,并将此列为强制许可制度的重要补偿措施之一,允许被强制许可的专利权人申请延长专利的期限。
(六)借鉴国际经验完善其它相关制度法规
借鉴国际经验完善其它相关制度法规,优化我国实施专利强制许可的大环境。提高制度改革层次、部门协调能力,完善我国药品专利链接制度,充分发挥使用行政、司法两种程序启动模式的优势性。学习加拿大、德国、法国等国在应对COVID-19疫情中及时颁布相应的紧急应对法、公共卫生法典的做法,为颁布强制许可制度奠定更好的法律基础。及时修订并贯彻《中华人民共和国突发事件应对法》《专利强制许可实施细则》《药品管理法实施条例》等法律法规,为更好地利用相关制度法规应对国际公共卫生紧急事件提供法律保障。
五、余论
实际上,国际公共卫生紧急事件的应对过程中运用强制许可制度可能并不是必要的。COVID-19或是其它疫情的治愈方法可能是一种没有获得专利的现有药物,即使已发现的治疗方法受到专利保护,也可能会有药物捐赠、折扣,或者专利持有人以可承受的价格提供自愿许可等情况的发生。但我们必须认识到完善药品强制许可制度应对公共卫生紧急事件的效用。在实践中何时运用此制度而不采取諸如平行进口、价格管制、Bolar例外等方式,如何处理此制度与其它制度或解决方式的关系,如何科学地利用此制度解决公共健康危机并且充分地保护专利权人的权益,都是值得关注的问题。
参考文献:
[1]燕楠,李林.对完善药品专利强制许可制度的思考[J].中国发明与专利,2017,14(09):42-45.
[2]SON K.Importance of the intellectual property system in attempting compulsory licensing of pharmaceuticals:a cross-sectional analysis[EB/OL].(2019-12-01)[2020-09-12].https://doi.org/10.1186/s12992-019-0485-7.
[3]WIRTZ VJ,HOGERZEIL HV,GRAY AL,BIGDELI M,DE JONCHEERE CP,EWEN MA,et al.Essential medicines for universal health coverage[J].Lancet,2017,389(10067):403-76.
[4]赵月.我国药品专利强制许可实施问题研究[D/OL].长春:吉林大学,2020:16.[2020-6-3].https://kns.cnki.net/kcms/detail/detail.aspx?dbcode=CMFD&dbname=CMFD202002&filename=1020643696.nh&v=5PlOFTGvV6pBCvvlUmAgsEz%25mmd2FFQHla5%25mmd2BQ1AJcSZWAQapKxvj7pdYl7EcwRjfCrF%25mmd2Bc.
[5]Kass D.Israel Defies AbbVie IP To Import Generic Drugs For COVID-19[EB/OL].(2020-03-19)[2020-06-03].https://www.law360.com/articles/1255079?scroll=1amp;related=1.
[6]COVID-19 Emergency Response Act,S.C.2020,C-13(Can.)[Z].2020-03-01.
[7]CHAMBER OF DEPUTIES(Chile). Proyecto de Resolución NO.896,Resolution for Involuntary Licensing of Patents Relating to Coronavirus,Cámara de Diputadasy Diputados[Z].2020-03-17.
[8]常红,蔡立彬.群体建构、划界问题与因果推断:关于公共健康的哲学问题探讨[J].长沙理工大学学报(社会科学版),2020,35(01):36-41.
[9]黄丽萍.论我国现行药品专利强制许可立法的不足与完善[J].法学杂志,2012,33(05):92-97.
[10]陈学宇.我国药品专利强制许可制度分类实施探讨:基于仿制药供应保障的视角[J].华侨大学学报(哲学社会科学版),2019(05):99-110.
[11]吴汉东.著作权合理使用制度研究[M].北京:中国政法大学出版社,1996.57.
[12]周娟.专利强制许可药品的补偿方法研究[J].现代商贸工业,2019,40(31):148-149.

