UPLC-MS/MS法同时测定人血浆中5-FU及其代谢产物5-FUH2的浓度及应用
佟志强 吴东媛 张娟 程梦飞 张硕 董梅
摘 要 目的:建立同時测定人血浆中5-氟尿嘧啶(5-FU)及其代谢产物5-氟-5,6-二氢尿嘧啶(5-FUH2)浓度的方法,并应用于临床。方法:血浆样品经乙酸乙酯二次萃取处理后,以5-溴尿嘧啶(5-Bru)为内标,采用超高效液相色谱-串联质谱技术(UPLC-MS/MS)测定。色谱柱为Acquity UPLC HSS T3,流动相为甲醇-水(30 ∶ 70,V/V),流速为0.3 mL/min,柱温为20 ℃,进样量为5 μL。采用电喷雾离子源,以多反应监测进行负离子扫描,毛细管电压为1.5 kV,锥孔电压为20 V,脱溶剂温度为450 ℃,脱溶剂气流为850 L/h,锥孔气流速为50 L/h;用于定量分析的离子对分别为m/z 129.00→41.90(5-FU)、m/z 130.87→82.92(5-FUH2)、m/z 189.00→42.10(5-Bru)。选择2020年8-10月哈尔滨医科大学附属肿瘤医院接受5-FU持续静脉滴注46 h为基础化疗方案治疗的晚期结直肠癌患者10例,测定其持续静脉滴注18~30 h时的5-FU稳态血药浓度及5-FUH2血药浓度,计算5-FU药-时曲线下面积(AUC)和5-FUH2/5-FU浓度比值。结果:5-FU、5-FUH2检测质量浓度的线性范围均为20~1 000 ng/mL(R 2均大于0.990),定量下限均为20 ng/mL;精密度试验的RSD均小于20%,相对误差在±10%范围内;提取回收率、基质效应均不影响待测物的测定。10例晚期结直肠癌患者中,5-FU稳态血药浓度为180.04~622.83 ng/mL,AUC为8.28~28.65 mg·h/L;5-FUH2血药浓度为336.48~948.43 ng/mL;5-FUH2/5-FU浓度比值为0.93~4.21;10例患者的5-FU AUC存在约3~4倍的个体差异。结论:所建方法精密度、准确性均较好,灵敏度较高且操作简便,可用于晚期结直肠癌患者体内5-FU血药浓度的监测。
关键词 超高效液相色谱-串联质谱法;5-氟尿嘧啶;5-氟-5,6-二氢尿嘧啶;血药浓度
ABSTRACT OBJECTIVE: To establish the method for simultaneous determination of 5-fluorouracil (5-FU) and its metabolites 5-fluoro-5,6-dihydrouracil (5-FUH2) in human plasma, and apply it in the clinic. METHODS: After plasma samples were processed twice by ethyl acetate, UPLC-MS/MS method was adopted using 5-bromouracil (5-Bru) as internal standard. The determination was performed on Acquity UPLC HSS T3 column with mobile phase consisted of methanol-water (30 ∶ 70, V/V) at the flow rate of 0.3 mL/min. The column temperature was 20 ℃, and sample size was 5 μL. An electrospray ion source was used to carry out negative ion scanning with multiple reaction monitoring. The capillary voltage was 1.5 kV; the taper hole voltage was 20 V; the desolvent temperature was 450 ℃; the desolvent air flow was 850 L/h; the cone hole gas velocity was 50 L/h. The ion transitions for quantitative analysis were m/z 129.00→41.90(5-FU),m/z 130.87→82.92(5-FUH2), m/z 189.00→42.10(5-Bru), respectively. From Aug. to Oct. 2020, 10 patients with advanced colorectal cancer were treated with continuous intravenous drip of 5-FU for 46 hours were collected from Harbin Medicinal University Cancer Hospital. Steady-state plasma concentration of 5-FU and plasma concentration of 5-FUH2 were determined at 18-30 h of continuous intravenous drip. The area under the curve (AUC) for 5-FU and concentration ratio of 5-FUH2/5-FU were calculated. RESULTS: The linear range of 5-FU and 5-FUH2 were 20 to 1 000 μg/mL (R 2>0.990). The quantification limits were 20 ng/mL. RSDs of precision test were all lower than 20%, and relative error ranged ±10%. The extraction recovery and matrix effects didnt affect the determination of substance to be measured. Among 10 patients with advanced colorectal cancer, the steady-state concentration of 5-FU were 180.04-622.83 ng/mL, and AUC of 5-FU ranged from 8.28 to 28.65 mg·h/L. The concentration of 5-FUH2 ranged 336.48-948.43 ng/mL, and concentration ratio of 5-FUH2/5-FU ranged 0.93-4.21. AUC of 5-FU in 10 patients had about 3-4 fold individual differences. CONCLUSIONS: The established method has good precision and accuracy, high sensitivity, and simple operation. It can be used for plasma monitoring of 5-FU in patients with advanced colorectal cancer.
KEYWORDS UPLC-MS/MS; 5-FU; 5-FUH2; Plasma concentration
氟尿嘧啶(5-fluorouracil,5-FU)可同时抑制肿瘤细胞DNA和RNA的合成,是晚期结直肠癌患者化疗的基石[1-3]。其作为抗代谢类细胞毒性药物,治疗窗相对较窄,能在浓度暴露水平重叠的情况下发挥疗效并产生毒性[4]。在临床应用中,5-FU和卡培他滨、奥沙利铂等化疗药物相似,其给药剂量均根据患者的体表面积(BSA)确定。但有研究发现,基于BSA给药时,5-FU体内清除率存在较大的个体差异,差异高达10~100倍[5]。目前,5-FU的治疗药物监测(TDM)研究发现,药动学参数药-时曲线下面积(AUC)与疗效和安全性具有相关性,在5-FU持续静脉滴注的方案中,5-FU AUC可以用5-FU稳态血药浓度(css)和持续静脉滴注时间(TCI)的乘积来计算[4]。由此,笔者认为基于5-FU 的AUC来调整其临床剂量是可行的。
二氢嘧啶脱氢酶(DPD)可清除体内80%~90%的5-FU,是该药体内分解代谢的关键限速酶[4]。有研究表明,一般人群中,DPD酶活性偏低和完全缺乏者分别占全部人群的3%~5%和0~0.1%,DPD酶活性偏低或缺乏会造成患者体内5-FU血药浓度升高而致蓄积中毒,从而引发严重的骨髓抑制和胃肠道反应等,因此DPD酶活性是预测5-FU相关不良反应的生物标志物之一[4-6]。DPD酶由DPYD基因编码,目前除检测患者DPYD基因多态性外,还可将二氢尿嘧啶(UH2)/尿嘧啶(U)浓度比值或5-氟-5,6-二氢尿嘧啶(5-FUH2)/5-FU浓度比值作为DPD酶活性的表型指标[4]。5-FUH2是5-FU在体内经DPD酶分解产生的主要代谢产物,已有研究证实,5-FUH2的血药浓度与5-FU引起的不良反应具有相关性[7-8]。因此,测定5-FU和5-FUH2血药浓度既可用于计算5-FU的AUC,又可用于评估DPD酶活性。
目前,5-FU TDM的常用方法包括高效液相色谱法(HPLC)、液相色谱-串联质谱法(LC-MS/MS)和免疫分析法,其中HPLC法和LC-MS/MS法是测定5-FU血药浓度的经典方法,准确度、灵敏度较高,但分析速度较慢[9-10]。超高效液相色谱-串联质谱技术(UPLC-MS/MS)具有较高的准确度和灵敏度,且分析时间较短,更适合于临床样本的批量检测[4]。基于此,本研究建立了同时测定人血浆中5-FU和5-FUH2浓度的UPLC-MS/MS法;同时,采用该方法对哈尔滨医科大学附属肿瘤医院使用以5-FU为基础化疗方案的晚期结直肠癌患者的5-FU和5-FUH2血药浓度进行检测,并计算5-FU的AUC,旨在为调整下一周期5-FU的化疗剂量调整以及患者的个体化用药提供参考。
1 材料
1.1 主要仪器
實验所用主要仪器有:Waters ACQUITY H-Class型UPLC仪(配有UPLC系统和质谱检测器)、Waters Xevo TQ-MS检测器(美国Waters公司),TI-H20型多频超声波清洗仪(德国ELMA公司),BS14-TM-1F型数显涡旋震荡器(德国WIGGENS公司),D-35720型低温高速离心机(美国Thermo Fisher Scientific公司),EX324型十万分之一电子天平[奥豪斯仪器(上海)有限公司],JT-DCY-12SL型水浴氮吹仪(杭州聚同电子有限公司)。
1.2 主要药品与试剂
实验所用主要药品与试剂有:5-FU对照品(上海麦克林生化科技有限公司,批号F100149,纯度99%)、5-FUH2对照品(美国Cayman公司,批号0496883-6,纯度99%)、5-溴尿嘧啶对照品(5-Bru,内标,美国Sigma-Aldrich公司,批号852473,纯度98%)等;人空白血浆由哈尔滨医科大学附属肿瘤医院提供;甲醇、乙腈、甲酸均为质谱级,乙酸乙酯为色谱纯,水为去离子水。
2 方法与结果
2.1 色谱与质谱条件
2.1.1 色谱条件 以Acquity UPLC HSS T3(100 mm×2.1 mm,1.8 μm)为色谱柱,以甲醇-水(30 ∶ 70,V/V)为流动相,流速为0.3 mL/min,柱温为20 ℃,进样量为5 μL。
2.1.2 质谱条件 离子源为电喷雾离子源(ESI),扫描模式为多反应监测(MRM) 模式,扫描方式为负离子模式,毛细管电压为1.5 kV,锥孔电压为20 V,脱溶剂温度为450 ℃,脱溶剂气流为850 L/h,锥孔气流速为50 L/h;用于定量分析的离子对分别为m/z 129.00→41.90(5-FU)、m/z 130.87→82.92(5-FUH2)、m/z 189.00→42.10(5-Bru)。
2.2 溶液的制备
2.2.1 对照品溶液 精密称取5-FU、5-FUH2对照品各10.00 mg,分别置于100 mL棕色量瓶中,加50%甲醇定容,混匀,制成5-FU、5-FUH2质量浓度均为100 mg/L的单一对照品贮备液。精密吸取上述各单一对照品贮备液适量,分别加50%甲醇稀释,制成5-FU、5-FUH2质量浓度均为10 mg/L的单一对照品溶液,置于4 ℃冰箱中保存,备用。
2.2.2 内标溶液 精密称取5-Bru对照品10.00 mg,置于100 mL棕色量瓶中,加50%甲醇定容,混匀,制成质量浓度为100 mg/L的5-Bru贮备液。精密吸取上述贮备液适量,加50%甲醇稀释,制成质量浓度为2 000 ng/mL的内标溶液,置于4 ℃冰箱中保存,备用。
2.2.3 质控样品溶液 取“2.2.1”项下5-FU、5-FUH2单一对照品溶液适量,分别加空白血浆稀释,制成质量浓度分别为20、50、400、800 ng/mL的5-FU、5-FUH2质控样品溶液。
2.3 血浆样品的处理
取空白血浆适量,置于37 ℃水浴中融解,精密吸取200 μL,置于1.5 mL离心管中,加“2.2.2”项下内标溶液25 μL,涡旋30 s,混匀,加乙酸乙酯1 mL,涡旋1 min;于4 ℃下以14 600 r/min离心10 min,吸取上清液500 μL,置于另一1.5 mL 离心管中;在原离心管中再加乙酸乙酯500 μL,涡旋30 s,于4 ℃下以14 600 r/min离心10 min,吸取全部上清液;合并两次上清液,置于40 ℃水浴中以氮气流吹干,残渣加流动相100 μL复溶,涡旋2 min,经0.45 μm滤膜滤过,取续滤液,置于自动进样瓶中备测。
2.4 专属性考察
分别取空白血浆、空白血浆+5-FU+5-FUH2+内标、晚期结直肠癌患者血浆样品+内标,按“2.3”项下方法处理后,再按“2.1”项下色谱与质谱条件进样分析,记录色谱图。结果,5-FU、5-FUH2、5-Bru的保留时间分别为1.22、1.18、1.55 min;空白血浆中的内源性物质(如自身体内的神经递质、激素等)对5-FU、5-FUH2的测定无干扰,色谱峰峰形对称、特异性好,分离度均大于>1.5,详见图1(空白血浆图略)。
2.5 线性关系考察
分别取“2.2.1”项下5-FU、5-FUH2对照品溶液适量,加50%甲醇稀释,制成质量浓度分别为100、250、500、1 000、2 000、2 500、3 750、5 000 ng/mL的5-FU、5-FUH2系列溶液。分别精密吸取上述系列溶液各40 μL,加“2.2.2”项下内标溶液20 μL,于40 ℃下以氮气流吹干后,残渣加空白血浆200 μL,制成质量浓度分别为20、50、100、200、400、500、750、1 000 ng/mL的5-FU、5-FUH2系列单一线性工作溶液,按“2.3”项下方法处理后,再按“2.1”项下色谱与质谱条件进样分析,记录峰面积。以待测成分的质量浓度(X,ng/mL)为横坐标、待测成分与内标的峰面积比值(Y)为纵坐标进行线性回归,得5-FU的回归方程为Y=0.014 4X-0.065 4(R 2=0.998 7)、5-FUH2的回归方程为Y=0.002 1X-0.010 3(R 2=0.996 1),表明5-FU、5-FUH2检测质量浓度的线性范围均为20~1 000 ng/mL,定量下限均为20 ng/mL。
2.6 精密度与准确度试验
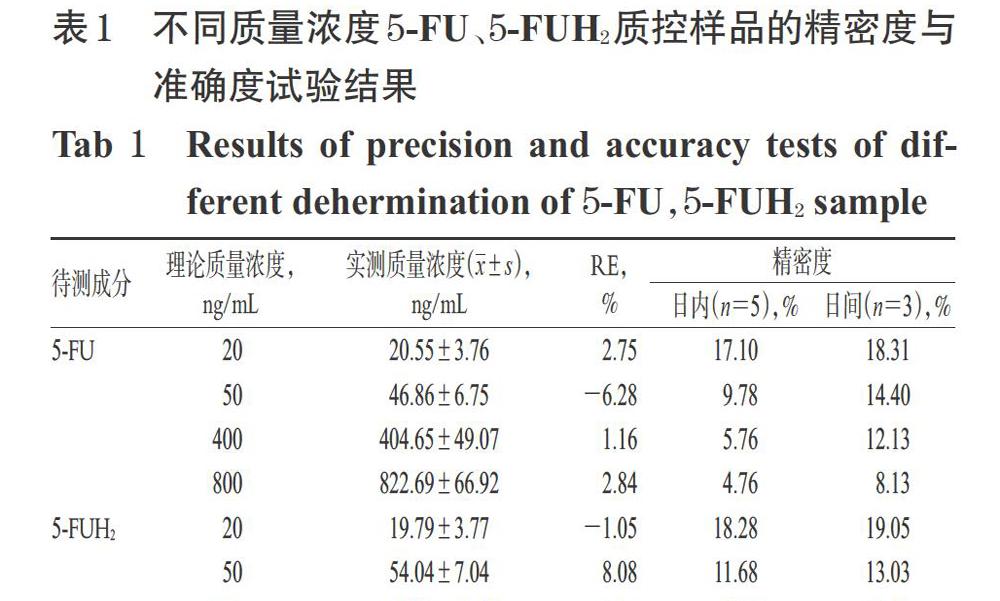
分别取“2.2.3”项下20、50、400、800 ng/mL的5-FU、5-FUH2质控样品溶液,每个质量浓度各取5份,分别于1 d内按“2.3”项下方法处理后,再按“2.1”项下色谱与质谱条件连续进样分析,考察日内精密度;连续3 d按“2.3”项下方法处理后,再按“2.1”项下色谱与质谱条件进样分析,考察日间精密度。以实测质量浓度与理论质量浓度进行比较,用相对误差(RE)来考察准确度。结果,5-FU和5-FUH2日内、日间精密度均小于20%,RE在±10%范围内,符合体内生物样品定量分析的要求[11],详见表1。
2.7 稳定性试验
分别取“2.2.3”项下50、400、800 ng/mL的5-FU、5-FUH2质控样品溶液,每个质量浓度各取5份,分别于室温下放置 24 h、低温(4 ℃)下放置24 h、-80 ℃冷冻保存30 d、3次冻融循环(-20 ℃~室温)、在自动进样器中放置 24 h后,按“2.3”项下方法处理,再按“2.1”项下色谱与质谱条件进样分析,记录峰面积。以实测质量浓度与理论质量浓度进行比较,用RE来考察稳定性。结果,RE在±7%范围内,提示样品在上述条件下稳定性良好详见表2。
2.8 提取回收率和基质效应考察
取“2.2.3”項下50、400、800 ng/mL的5-FU质控样品溶液,每个质量浓度各取5份,按“2.3”项下方法处理后,再按“2.1”项下色谱与质谱条件进样分析,测得5-FU质控样品/5-Bru峰面积的比值(A);另取空白血浆适量,按“2.3”项下方法处理后,取上清液适量,加5-FU对照品溶液适量,制成质量浓度分别为50、400、800 ng/mL的对照品样品,每个质量浓度各取5份,按“2.1”项下色谱与质谱条件进样分析,测得5-FU对照品样品/5-Bru峰面积比值(B);按“2.2.3”项下方法,将空白血浆改为50%甲醇制成质量浓度为分别为50、400、800 ng/mL的5-FU甲醇样品,按“2.3”项下方法处理后,再按“2.1”项下色谱与质谱条件进样分析,测得5-FU甲醇样品/5-Bru峰面积比值(C)。提取回收率=A/B×100%,基质效应=B/C×100%。5-FUH2按上述同法操作。结果,5-FU的平均提取回收率为52.93%~58.89%(RSD≤5.89%),平均基质效应为99.40%~102.31%(RSD≤7.65%);5-FUH2的平均提取回收率为54.60%~62.01%(RSD≤8.08%),平均基质效应为97.21%~101.87%(RSD≤7.57%),均符合体内生物样品定量分析的要求[11],详见表3。
2.9 临床应用
2.9.1 纳入与排除标准 纳入标准:(1)经组织病理学和/或细胞生物学检查确诊为晚期结直肠癌;(2)至少有1个可测量的病灶;(3)美国东部肿瘤协作组(EGCO)全身状态评分为0~1分;(4)接受以5-FU为基础药物持续静脉滴注的全身化疗方案;(5)血常规、肝肾功能等检查均符合化疗标准;(6)预期生存时间≥12周;(7)年龄18~80岁;(8)体质量≥40 kg。排除标准:(1)妊娠期或哺乳期或有妊娠可能的女性患者,首次用药前妊娠检测呈阳性者;(2)具有临床意义的电解质异常者;(3)既往或现在存在中枢神经系统转移或脑转移者;(4)存在临床可检查出的第二原发恶性肿瘤,或在过去5年内出现过其他恶性肿瘤(已充分治疗的皮肤基底细胞癌或宫颈原位癌除外) 者;(5)有未控制的活动性感染(如急性肺炎、乙肝或丙肝活动期)者;(6)有消化道疾病或研究者判定的可能引起消化道出血或者穿孔的其他状况,或既往有肠穿孔、肠瘘史者;(7)入组前6个月内有动脉血栓或深静脉血栓史,或入组前2个月内有出血倾向证据或病史且无论严重程度如何者;(8)部分凝血酶原时间或凝血酶原时间超出正常值1.5倍者;(9)入组前6个月内有急性心肌梗死、严重/不稳定心绞痛或者冠状动脉搭桥术史、或美国纽约心脏病协会(NYHA)心功能分级2级及以上者;(10)严重心理疾病或精神异常者;(11)既往4周内参加过其他药物临床试验者;(12)正在其他临床试验中接受其它药物治疗者。
2.9.2 一般资料 收集2020年8-10月于哈尔滨医科大学附属肿瘤医院接受以5-FU持续静脉滴注46 h为基础化疗方案治疗的晚期结直肠癌患者10例,其中男性7例、女性3例,平均年龄(57.5±5.6)岁。本研究方案经哈尔滨医科大学附属肿瘤医院医学伦理委员会批准(伦理批号KY2017-18),所有患者均签署了知情同意书。
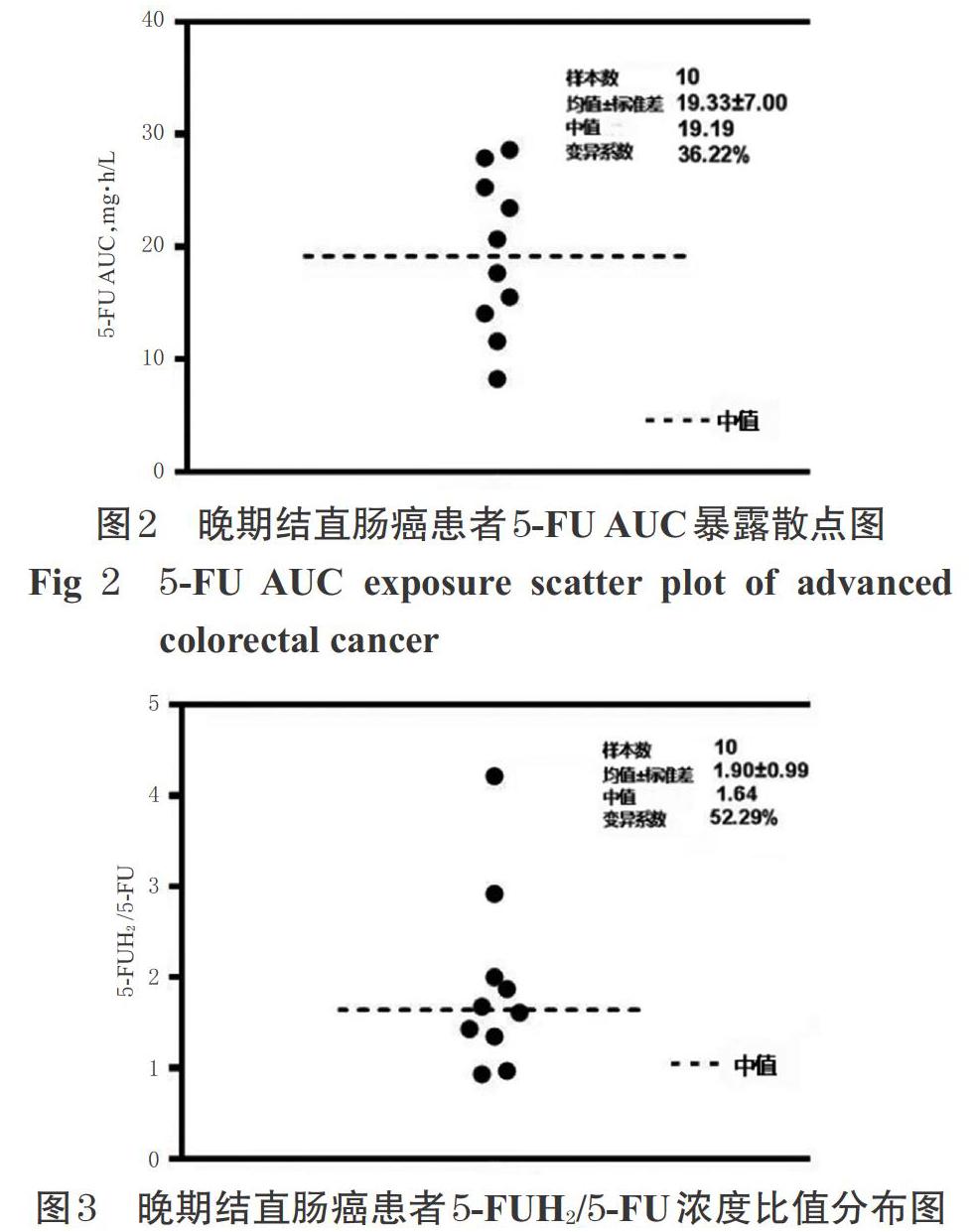
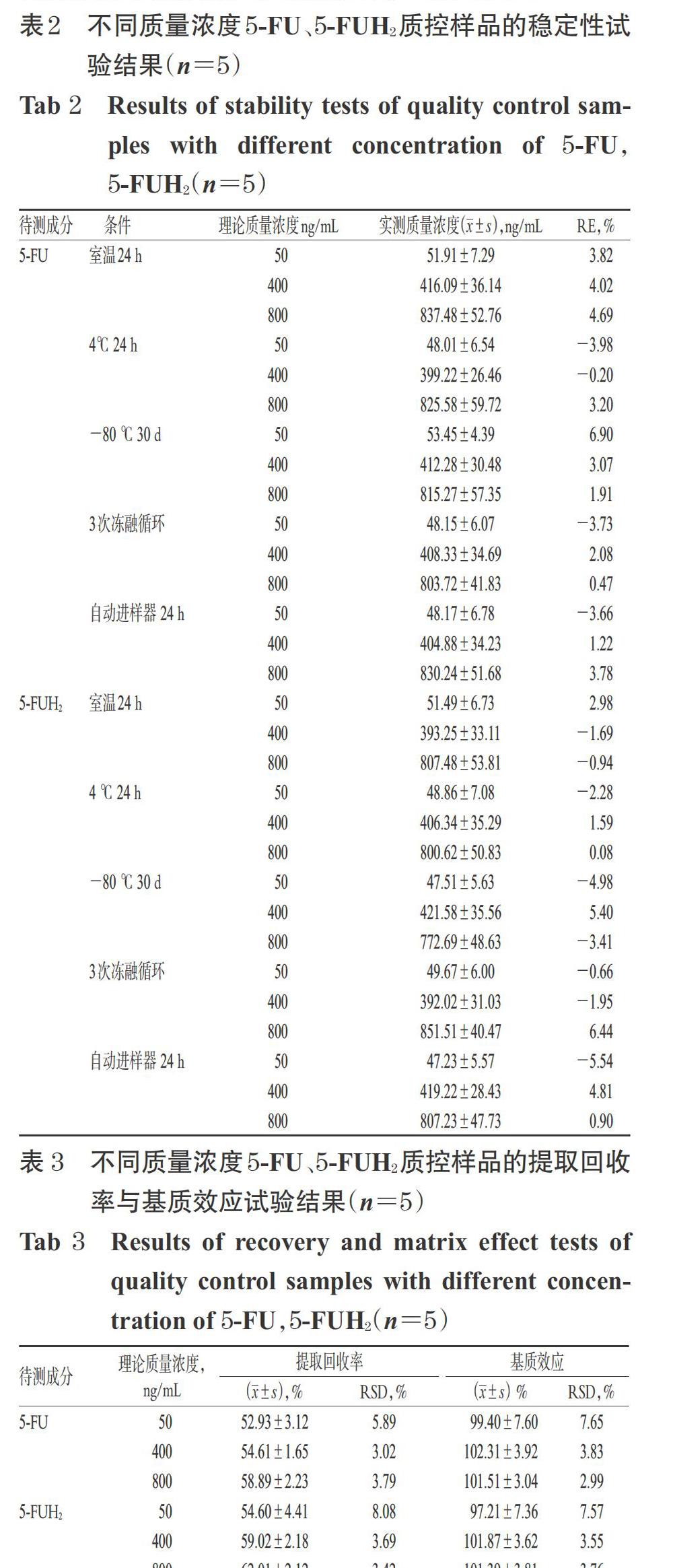
2.9.3 检测结果 所有患者于5-FU持续静脉滴注18~30 h时采集外周静脉血,置于乙二胺甲乙酸二钾抗凝管中,采样后立即置于冰浴中,并于4 ℃以3 000 r/min离心10 min,将上层血浆置于-80 ℃保存。按本研究所建方法检测患者5-FU的css和5-FUH2的血药浓度,并按公式计算患者5-FU的AUC:AUC=css×TCI[4]。结果,5-FU的css为180.04~622.83 ng/mL,5-FU的AUC为8.28~28.65 mg·h/L,其AUC可达3~4倍个体差异;5-FUH2的血药浓度为336.48~948.43 ng/mL;5-FUH2/5-FU浓度比值为0.93~4.21。这提示不同患者个体间5-FU的AUC暴露量差异较大。晚期结直肠癌患者5-FU AUC暴露散点图和5-FUH2/5-FU浓度比值分布图分别见图2、图3。
3 讨论
5-FU的分子式为C4H3FN2O2,分子量为130.08;5-FUH2的分子式为C4H5FN2O2,分子量为132.08,均为小分子物质,加之两者亲水性强,因此在选择色谱柱时应注意选择适用于水溶性物质分离的色谱柱[12]。本研究前期试验曾尝试Waters UPLC BEH C18色谱柱,结果发现,5-FU和5-FUH2在C18色谱柱上保留时间极短(<0.5 min),分离效果不理想。经查阅资料后发现,T3柱是一种可以耐受100%水相且可长时间冲洗的特殊色谱柱,其键合相由多孔硅胶基质组成,可延长极性组分的保留时间[13],故本研究选用Acquity UPLC HSS T3小颗粒填料色谱柱。
因5-Bru与5-FU、5-FUH2具有相同的母核,只有卤素取代不同,本研究前期试验结果显示,5-Bru在离子化和色谱保留方面均对5-FU、5-FUH2的测定无干扰,方法学验证也满足生物样本定量分析的要求[11],故选择5-Bru为内标。与现有文献相比,本研究所建UPLC-MS/MS法分析时间短、血浆用量少、定量下限更低,且不需要使用同位素标记的内标,因此在临床5-FU的TDM应用中更有优势[12-13]。
本研究发现,不同患者个体间5-FU和5-FUH2血药浓度暴露量差异较大,5-FU AUC差异可达3~4倍,推测其原因可能与个体间DPD酶的活性不同有关。有研究认为,5-FU AUC在 20~30 mg·h/L范围内疗效最好且不良反应发生率最低[4],但仅有约25%患者能达到上述有效治疗范围,约10%~20%患者会因血药浓度较高而导致严重的不良反应发生[5-6]。而本研究中,有5例患者的5-FU AUC在20~30 mg·h/L范围内,且未见严重不良反应发生;有5例患者的5-FU AUC 小于20 mg·h/L,也未见严重不良反应发生;另外,虽然有2例患者的5-FUH2/5-FU浓度比值小于1,但均未观察到3/4级不良反应发生,其关联性尚需扩大样本量进一步研究。
综上所述,所建方法精密度、准确性均较好,灵敏度较高且操作简便,可用于晚期结直肠癌患者体内5-FU血药浓度的监测。
參考文献
[ 1 ] CARRILLO E,NAVARRO SA,RAM?REZ A. 5-fluorouracil derivatives:a patent review:2012-2014[J]. Expert Opin Ther Pat,2015,25(10):1131-1144.
[ 2 ] 吴丽敏,王鸿梅,李军.氟尿嘧啶药理学及其相关代谢酶的遗传药理学进展[J].浙江临床医学,2014,16(3):481-483.
[ 3 ] 钱鸣杰,眭振宇,唐文,等. 3种药物联合治疗晚期结直肠癌的治疗[J].重庆医学,2015,44(22):3112-3114.
[ 4 ] BEUMER JH,CHU E,ALLEGRA C,et al. Therapeutic drug monitoring in oncology:IATDMCT recommendations for 5-fluorouracil therapy[J]. Clin Pharmacol Ther,2019,105(3):598-613.
[ 5 ] UNDEVIA SD,GOMEZ-ABUIN G,RATAIN MJ. Pharmacokinetic variability of anticancer agents[J]. Nat Rev Cancer,2005,5(6):447-458.
[ 6 ] LEE JJ,BEUMER JH,CHU E. Therapeutic drug monitoring of 5-fluorouracil[J]. Cancer Chemother Pharmacol,2016,78(3):447-464.
[ 7 ] CAO S,BACCANARI DP,RUSTUM YM,et al. Alpha- fluoro-beta-alanine:effects on the antitumor activity and toxicity of 5-fluorouracil[J]. Biochem Pharmacol,2000,59(8):953-960.
[ 8 ] CASALE F,CANAPARO R,SERPE L,et al. Plasma concentrations of 5-fluorouracil and its metabolites in colon cancer patients[J]. Pharmacol Res,2004,50(2):173-179.
[ 9 ] 董秋美,黄赛花,郑伟华,等.高效液相色谱法检测结直肠癌患者5-FU血药浓度的临床意义[J].中华肿瘤防治杂志,2010,17(18):1476-1478、1481.
[10] DERISSEN EJ,HILLEBRAND MJ,ROSING H,et al. Development of an LC-MS/MS assay for the quantitative determination of the intracellular 5-fluorouracil nucleotides responsible for the anticancer effect of 5-fluorouracil[J]. J Pharm Biomedical Anal,2015,110:58-66.
[11] 國家药典委员会.中华人民共和国药典:四部[S]. 2020年版.北京:中国医药科技出版社,2020:466-472.
[12] CHAVANI O,JENSEN BP,STROTHER RM,et al. Development,validation and application of a novel liquid chromatography tandem mass spectrometry assay measuring uracil,5,6-dihydrouracil,5-fluorouracil,5,6-dihydro-5-fluorouracil,α-fluoro-β-ureidopropionic acid and α-fluoro-β-alanine in human plasma[J]. J Pharm Biomed Anal,2017.DOI:10.1016/j.jpba.2017.04.055.
[13] DHERSIN A,ATG B,MARTINEZ B,et al. Biomonitoring of occupational exposure to 5-FU by assaying α-fluoro-β-alanine in urine with a highly sensitive UHPLC-MS/MS method[J]. Analyst,2018,143(17):4110-4117.
(收稿日期:2020-10-23 修回日期:2021-01-05)
(编辑:陈 宏)

