蔗糖浓度对葡萄试管苗生长及光合作用的影响*
赵 鑫,毛 娟,刘 雪,吴巧兰
(1宜宾学院农林与食品工程学部,香料植物资源开发与利用四川省高校重点实验室,四川644000)(2甘肃农业大学园艺学院)
蔗糖支持绝大多数植物离体培养物的旺盛生长[7]。蔗糖经常以被动运输的形式进入细胞,当外界糖浓度大于植物细胞中时,细胞就会失水[8]。不同糖浓度对植物生长产生不同影响。植物组织培养过程中,培养基中糖类物质为植物生长提供碳源和能量,同时还有调节培养基渗透压的作用[9]。在植物组织培养初期,由于植物组织或细胞不能进行光合作用,因此需要外源糖供给植物碳源和能源。
外源糖可以提高植物叶片碳同化能力,能够增加光合速率和维持叶片的气孔开放,对受到胁迫下的叶片维持较高的光合作用有帮助[10]。但蔗糖在不同浓度如何影响植物试管苗的生长发育,不同浓度蔗糖对试管苗光合能力是否有影响并不清楚。因此,本试验以酿酒葡萄品种‘黑比诺’为材料,通过GS培养基不同蔗糖浓度处理,研究葡萄试管苗的各项生理及光合变化,为进一步研究培养基不同糖浓度对葡萄生长的影响提供基础。
1 材料与方法
1.1 材料与处理
选择生长整齐一致的‘黑比诺’葡萄试管苗,从顶部向下依次剪成单芽段,选取第2~4个茎段转接到GS培养基中培养。转接后将葡萄试管苗放入人工气候箱处理,27 ℃、16 h光照/8 h黑暗进行培养。本试验设置3个蔗糖浓度处理:GS0(0 g/L)、GS(30 g/L)、GS2(60 g/L),以GS(30 g/L)为对照。每个处理设置3个独立重复,每个重复30株试管苗。
1.2 测定指标及方法
(1)试管苗生长指标的测定。试管苗转接后第15 d开始用直尺测量试管苗株高,每5 d测定1次,共测定6次。每个处理随机测定15株试管苗的株高,然后求平均值。
(2)试管苗干鲜重的测定。试管苗转接后第25 d开始测定试管苗干鲜重,每5 d测定1次,共测定4次。采用烘干法(80 ℃)测定植株干鲜重,每个处理随机取10株试管苗进行测定,然后求平均值。
(3)叶片可溶性蛋白、可溶性糖及总糖含量的测定。分别采用Bradford法与蒽酮硫酸比色法测定试管苗第30 d叶片可溶性蛋白、可溶性糖、总糖含量。
(4)叶片叶绿素及光合参数的测定。采用丙酮提取法测定试管苗叶片叶绿素含量。采用CIRAS-2便携式光合仪测定系统(PP SYSTEM,USA)测定试管苗转接处理后第30 d叶片光合参数,包括叶片蒸腾速率(E)、气孔导度(Gs)、净光合速率(Pn)。光合仪测定系统参数设定为:25 ℃,光照强度为1 000 μmol·m-2·s-1,CO2浓度为380 μmol/mol,相对湿度为75%。9:00—11:00进行测定,每个处理随机选取5株发育天数相同的试管苗功能叶片进行快速测定。
(5)叶片叶绿素荧光参数的测定。采用叶绿素荧光成像仪(IMAG-PAM,Heinz Waltz,Germany)进行不同蔗糖浓度处理试管苗叶片叶绿素荧光参数的测定。
故障特征值是故障诊断的核心内容,它提取的好与坏将直接对故障诊断的可靠性和有效性产生影响。故障特征值的提取过程就是将电路中的波形信号转化成数字信号,即信号的处理过程。时域分析法与频域分析法是目前最为常见的信号处理方法[13]。时域分析法原理简单,但是操作和实现困难,所以在这里采用实用性更高的频域分析法。利用快速傅里叶变换(FFT)把时域里的波形变化到频域中来,利用其频谱特性进行更深入的分析。
(6)叶片内源激素的测定。采用液相高效色谱法测定不同处理试管苗叶片IAA、GA、ABA、ZR 4种内源激素的含量。
1.3 数据统计分析
采用Excel 2010、SPSS 19.0软件进行数据统计与分析,差异显著性分析采用LSD法(P<0.05),采用ORIGIN PRO 8.5软件绘图。
2 结果与分析
2.1 蔗糖浓度对试管苗株高的影响
在不同蔗糖浓度处理下,葡萄试管苗株高随培养时间的延长而增加。由图1可知,GS处理从第25 d开始株高显著高于其他2个处理,这表明正常蔗糖浓度能够有效促进葡萄试管苗的生长。GS0处理试管苗株高在第15~20 d显著低于GS2处理,但GS0处理株高第35~40 d显著高于GS2处理。无蔗糖条件下试管苗株高不断增加且到后期显著高于高浓度蔗糖胁迫下的试管苗株高,这可能是由于无糖环境促进了试管苗的光合作用,从而促进了试管苗的生长。
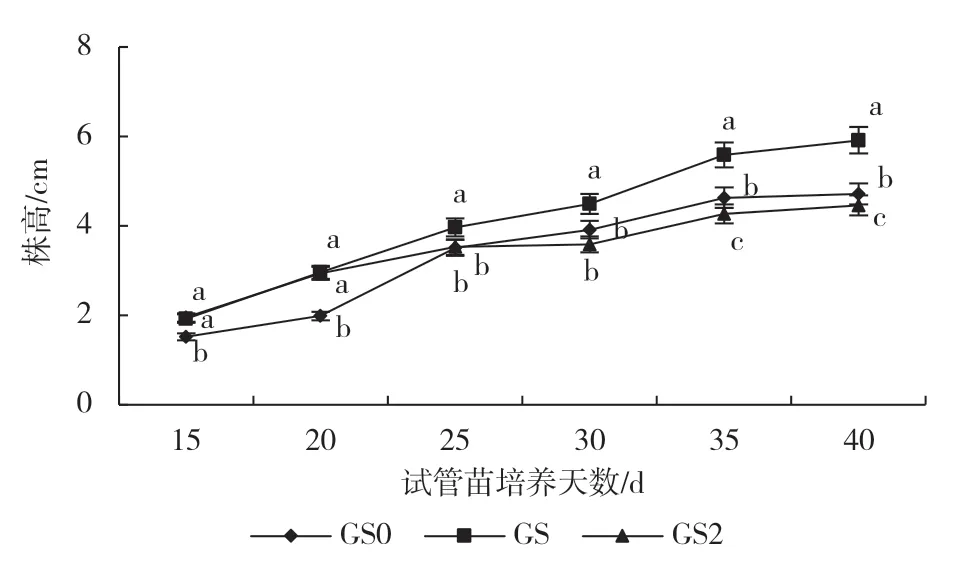
图1 不同蔗糖浓度对试管苗株高的影响
2.2 蔗糖浓度对试管苗干鲜重的影响
从表1可以看出,GS处理在试管苗生长过程中植株地上部鲜重显著高于GS2处理,地上部干重显著高于GS0和GS2处理,说明正常蔗糖浓度处理葡萄试管苗地上部干物质积累量明显大于无糖与高糖。而GS处理地下部干鲜重在35 d之前显著低于GS2处理,在40 d时显著高于GS2处理。GS2处理地上部干鲜重在第40 d时显著高于GS0处理,这可能是由于GS0处理缺乏试管苗生长所需的碳水化合物,干物质增加最为缓慢。

表1 不同蔗糖浓度对试管苗干鲜重的影响
2.3 蔗糖浓度对试管苗可溶性蛋白、可溶性糖、总糖含量的影响
由图2可知,蔗糖浓度对葡萄试管苗叶片可溶性蛋白含量影响显著。GS2处理下叶片可溶性蛋白含量最高,达到了8.2 mg/g,显著高于其他2个处理;GS与GS0处理之间无显著性差异,但GS0处理可溶性蛋白含量最低,为5.9 mg/g。不同蔗糖浓度条件下试管苗叶片可溶性蛋白含量表现出不同,可溶性蛋白含量与蔗糖浓度变化可能呈正相关,随蔗糖浓度的升高而增加。

图2 不同蔗糖浓度对试管苗叶片可溶性蛋白含量的影响
由图3可知,蔗糖浓度对葡萄试管苗叶片可溶性糖含量的影响显著,但对总糖含量影响较小。CS处理可溶性糖含量显著高于GS0、GS2处理,这表明叶片可溶性糖含量可能与植物生长相关。叶片总糖含量3个处理间无显著性差异。

图3 不同蔗糖浓度对试管苗叶片可溶性糖和总糖含量的影响
2.4 蔗糖浓度对试管苗叶绿素及光合参数的影响
由图4可知,GS处理试管苗叶片叶绿素a、叶绿素b及总叶绿素含量均显著高于其他2个处理;GS0与GS2处理的叶绿素含量无显著性差异。

图4 不同蔗糖浓度对试管苗叶片叶绿素含量的影响
试验结果表明:在GS处理下试管苗叶片蒸腾速率(E)、气孔导度(Gs)与净光合速率(Pn)均显著高于其他2个处理;GS0与GS2处理的蒸腾速率和光合速率无显著性差异,但GS2处理的气孔导度显著高于GS0处理(表2)。这表明培养基蔗糖浓度对葡萄试管苗叶片的光合参数有显著影响,正常蔗糖浓度下试管苗叶片气孔开张大,蒸腾速率高,同时净光合速率最高;而无糖及高蔗糖浓度胁迫试管苗降低了蒸腾速率与气孔导度,降低了叶片净光合速率,其中高蔗糖浓度下净光合速率最低。
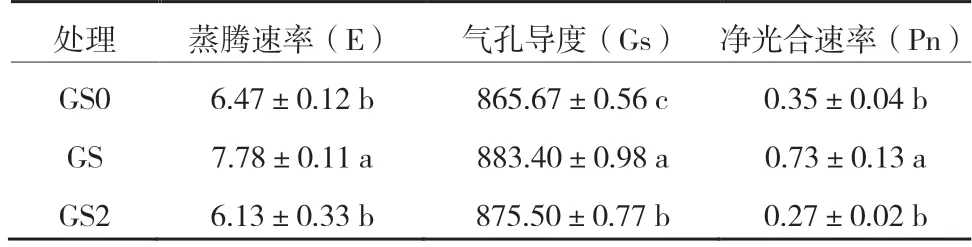
表2 不同蔗糖浓度对试管苗光合参数的影响
2.5 蔗糖浓度对试管苗叶绿素荧光参数的影响
试验结果表明,不同蔗糖浓度处理下,葡萄试管苗叶片相对电子传递速率(ETR)各不相同(图5-A),其中GS0处理的电子传递速率显著高于其他2个处理,说明培养基无糖条件有效促进了叶片光合电子传递速率,促进了试管苗光合作用,而高浓度蔗糖抑制了试管苗叶片光合电子传递速率。GS处理最大量子产量(Fv/Fm)显著高于其他2个处理(图5-B),说明培养基无糖处理及高浓度糖处理均对试管苗产生了胁迫,影响了试管苗正常的生长发育。

图5 不同蔗糖浓度对试管苗叶片叶绿素荧光参数的影响
由表3可知,葡萄试管苗叶片光化学淬灭系数(qP)在不同蔗糖浓度处理下表现不同。GS0处理的qP显著高于其他2个处理,表明在无糖条件下葡萄试管苗叶片光化学转化能力提高,将更多的光能转化为化学能。GS处理的非光化学淬灭系数(NPQ)显著低于其他2个处理,表明正常蔗糖浓度能够降低叶片对光能的非光化损耗,而在无糖或高糖浓度胁迫条件下试管苗叶片非光化学损耗增加。3个处理的实际量子产量(Y(II))无显著差异。

表3 不同蔗糖浓度对试管苗qP、NPQ与Y(II)的影响
2.6 蔗糖浓度对试管苗内源激素的影响
由图6可知,虽然培养基中含有生长素(IAA),但不同蔗糖浓度处理试管苗叶片中IAA含量并不相同,其中GS0处理的IAA含量显著高于其他2个处理,而GS与GS2处理之间无显著差异。GS处理的赤霉素(GA)含量显著高于其他2个处理,而GS0与GS2处理之间无显著差异。玉米素(ZR)在3个处理中无显著差异。试管苗叶片属于幼嫩组织,脱落酸(ABA)含量较低,在GS2处理中未检出ABA,GS处理中ABA含量非常低,但GS0处理中ABA含量显著高于GS处理,这可能是由于无外源糖分供给,环境胁迫试管苗叶片产生了较多ABA。

图6 不同蔗糖浓度对试管苗叶片内源激素的影响
3 讨论与结论
对试管苗培育而言,在培养基中添加一定浓度的糖为试管苗生命活动提供碳源和能量,也在为试管苗的形态建成提供能量和结构物质,还可以响应逆境以及参与调控植物生长发育的信号分子[11],其中,糖浓度的高低对植物生长有很大影响。
无糖培养条件无法给植物提供充足的能源与碳源,进而影响植物的生长发育和器官分化,甚至导致试管苗死亡。培养基中糖浓度过高,会对试管苗产生渗透胁迫,对试管苗的正常生长产生危害[12]。可溶性糖是植物体内比较活跃的一类碳水化合物,能够参与植物的糖分运输等代谢活动[13]。可溶性糖参与调节植物生长发育过程、影响基因表达[14-15]。植物体内酶许多由可溶性蛋白组成,这些酶在植物体内参与并调控多种代谢过程,影响植物生长发育、成熟衰老及抗逆性等。氨基酸可以调节细胞膜透性和离子吸收,可能对减轻干旱胁迫有着非常重要的作用[16]。部分氨基酸能够使细胞膜透性降低40%~100%,而部分氨基酸则没有这种效果[17]。在本研究中葡萄试管苗叶片可溶性蛋白、可溶性糖及总糖含量受培养基糖浓度的影响,我们推测可溶性糖与总糖在处理间的差异可能受植物体“源”“库”关系影响。在不含糖培养基中试管苗叶片为“源”器官,通过较低光合作用合成碳水化合物并运输到植物体其他组织中提供能量,叶片自身并无较多碳水化合物的积累。而试管苗在含糖培养基中生长时叶片可以作为“库”器官,不定根吸收的糖可以大量运输并积累到叶片中。
本研究中,无糖处理使植物能量和碳源缺乏,高糖浓度处理则可能导致植物受到养分毒害及渗透胁迫[18]。高温胁迫会导致稻米直链淀粉含量下降和蛋白质含量增加[19]。不同处理间可溶性蛋白含量不同,说明葡萄试管苗叶片对不同的胁迫响应机理不同。可溶性蛋白能够增加植物细胞在高温等逆境条件下的功能蛋白数量及渗透势,是植物提高抗逆能力的重要渗透调节物质[20],能够调节植物细胞在逆境条件下仍让其维持正常的代谢功能,提高植物抵抗逆境的能力。此外,由于叶片中糖含量及种类的不同,引起叶片内糖代谢相关各种酶的差异,引起了可溶性蛋白含量的变化。
组培环境内部生长条件相对湿度较大,因此试管苗在组培条件无法调控气孔开闭,叶片气孔一直保持开张状态,这导致试管苗水分大量散失[22]。Chaum等研究发现,水稻叶片中蔗糖和葡萄糖的累积在维持光反应中的电子传递、稳定光合色素及碳同化等光合作用过程中发挥着重要作用[23]。在胁迫条件下,葡萄试管苗叶片光合作用受到影响,净光合速率显著下降。目前研究表明,净光合速率下降主要有2个方面的因素:一是气孔导度的下降,阻止了CO2的供应;二是由于受到胁迫,PSⅡ的功能被破坏。本研究中不同蔗糖浓度处理的气孔导度差异明显,这表明净光合速率下降可能是气孔导度所引起的。Sulmon等[24]研究发现,外源蔗糖能够诱导PsbA基因的表达,加快PSⅡ功能的自我修复,影响光合速率,影响植株的正常生长发育及物质的积累。还有一些研究者认为,培养基中过量的糖导致光合速率下降与高浓度糖条件下核酮糖1,5-二磷酸(RuBP)羧化酶活性下降及呼吸作用增强有关,还发现可溶性糖的积累也是造成光合速率下降的原因[25]。本研究发现高糖及无糖处理都会引起葡萄试管苗为应对环境变化而发生各项形态及生理变化。

