燕麦劣变种子吸胀过程中线粒体AsA-GSH循环的生理响应
刘 备, 宋玉梅, 孙 铭, 毛培胜
(中国农业大学草业科学与技术学院, 草业科学北京市重点实验室, 北京 100193)
种子在合适的条件下吸水膨胀、胚重新恢复代谢、胚根突破胚乳和种皮等外围包被组织的一系列生理形态变化过程被称为种子萌发,这是植物发育的重要阶段,也是决定植物生产力的重要因素[1]。种子吸胀过程中种胚细胞内发生着一系列的生理生化变化,比如代谢活动的激活、细胞呼吸的恢复、线粒体生物发生、储藏mRNAs的翻译和降解、DNA修复、新mRNAs的转录和翻译以及储藏动员的开始[2]。由于细胞内外产物在吸胀早期的明显增加导致活性氧(reactive oxygen species,ROS)开始积累[3-4]。ROS的积累造成与种子活力丧失和老化相关的损伤[5]。线粒体是产生ROS的主要位点[6-7]。种子吸胀过程中线粒体内ROS积累、清除以及代谢调控是决定种子萌发的重要因素,相关研究也在逐步成为种子老化研究的重点与难点。
在低温、干旱等非生物胁迫下抗氧化酶的活性与种子萌发及幼苗的生长有着直接的关系[8]。过氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)等均能清除种子萌发阶段产生的ROS。该结论已经在多种植物种子材料研究中得到证实。在芍药(Paeonialactiflora)种子中,SOD和过氧化氢酶(peroxidase,POD)活性在萌发期间降低,而CAT活性升高,且SOD较POD,CAT更早发挥作用[9]。沙冬青(Ammopiptanthusmongolicus)种子则随聚乙二醇(polyethylene glycol,PEG)胁迫程度的加深,发芽率和鲜重降低,死亡率、丙二醛(malondialdehyde,MDA)含量和相对电导率升高,萌发过程SOD,CAT和POD活性均为先上升后下降[10]。而加速老化使大麦(Hordeumvulgare)种子的发芽率、发芽指数、正常种苗数、CAT和抗坏血酸过氧化物酶(ascorbate peroxidase,APX)活性明显降低,酶活性的降低使种子呼吸能力减弱,种子老化与酶活性的下降有着密不可分的联系[11]。此外,线粒体通过抗坏血酸-谷胱甘肽(ascorbate-glutathione,AsA-GSH)循环系统对过氧化氢(hydrogen peroxide,H2O2)等ROS进行清除[12-13]。该循环包括APX、单脱氢抗坏血酸还原酶(monodehydroascorbatereductase,MDHAR)、脱氢抗坏血酸还原酶(dehydroascorbatereductase,DHAR)和谷胱甘肽还原酶(glutathione reductase,GR),以及AsA/脱氢抗坏血酸(dehydroascorbate,DHA),GSH/氧化型谷胱甘肽(oxidized glutathione,GSSG)和烟酰胺腺嘌呤二核苷酸磷酸(还原型辅酶Ⅱ)(nicotinamide adenine dinucleotide phosphate,NADPH)/烟酰胺腺嘌呤二核苷酸(还原型辅酶Ⅰ)(nicotinamide adenine dinucleotide,NADP)三对独立的氧化还原对[14]。关于老化种子影响线粒体AsA-GSH循环的研究正在逐步引起关注,对4℃吸胀24 h豌豆(Pisumsativum)种子的研究发现,PEG处理之后子叶线粒体SOD,APX,MDHAR和GR等抗氧化酶活性升高,H2O2含量降低,种子耐寒性增强[15]。而在大豆(Glycinemax)种子的研究中发现,随着老化程度的加剧,吸胀24 h胚轴线粒体SOD,APX,GR和MDHAR活性降低[16]。同时种子劣变的内部生理变化与其水分状况密切相关[17]。在燕麦(AvenasativaL.)种子45℃老化40 d的研究中,与16%含水量的种子相比,4%含水量种子的种胚线粒体SOD,APX,MDHAR,DHAR和GR活性较强[18]。10%含水量燕麦种子随着老化时间延长,APX,DHAR,MDHAR,GR活性呈现先升高后下降的趋势[19]。但目前线粒体AsA-GSH循环在老化种子吸胀过程中的作用机理仍缺少深入研究。
燕麦(AvenaSativa.L)作为一种优质高产牧草,随着我国草地畜牧业的快速发展和奶牛饲养规模的不断扩大,其种植面积和市场需求都大幅度增加。正常燕麦种子在一定时间内可以保持活力,但随着储藏时间的延长,贮存条件及内外环境的胁迫,种子的生理代谢功能和细胞结构便会遭受不同程度的损伤,导致不可逆且不可避免的老化[20]。同时燕麦种子内不饱和脂肪酸含量较高,更容易导致老化的发生,从而降低其利用价值,故而近年来对燕麦劣变种子的研究已受到普遍关注[21]。本试验针对不同活力燕麦种子吸胀过程中发芽特性变化,探索种胚线粒体AsA-GSH循环的生理响应规律,以期揭示种胚线粒体AsA-GSH循环在保持种子活力方面的作用机制,为燕麦种质资源的长期保存提供理论指导和参考依据。
1 材料与方法
1.1 试验材料
供试材料燕麦(品种名:‘挑战者’,‘Challenger’)购买于北京阳光绿地生态科技有限公司。种子2018年收获于加拿大,发芽率为100%,含水量为8.7%。筛选大小均匀一致的种子保存至-20℃冰箱中,以备后续试验使用。
1.2 种子含水量测定与调整
参照国际种子检验协会(ISTA)种子检验规程测定种子含水量[22]。样品盒和盖从干燥器里取出后置于130℃烘箱中30 min,之后放入干燥器里冷却30 min,称得的重量记为M1(精确到0.001 g);称取4.5 g左右的燕麦种子放入样品盒,称得的重量记为M2(精确到0.001 g);样品盒、盖开启后放入烘箱内,温度达到130℃时开始计时2 h,到达规定的时间后,放入干燥器里冷却30 min,称得的重量记为M3。设置2个重复,根据公式算得种子含水量(%)=(M2-M3)/(M2-M1)×100%。
将已知质量和初始含水量的种子放入含有饱和硝酸钾溶液的干燥器中,多次称量种子的质量,直至达到含水量为10%时的目标质量,而后立即装入铝箔袋中密封,每袋40 g。根据公式计算目标质量(g)=(100-MC0)/(100-MCr)×W0。式中MC0为初始含水量(%);MCr为需要达到的含水量(%),本试验中为10%;W0为种子初始质量(g)。
1.3 种子控制劣变及吸胀处理
将10%含水量燕麦种子置于45℃恒温水浴箱中进行控制劣变处理,每隔1~2 d取出一袋,室温下平衡1 d,测定其发芽率。以劣变时间为横坐标,发芽率为纵坐标制作老化曲线。发芽率高于90%为高活力种子(HVS),大于80%而低于90%为中活力种子(MVS)。
选取HVS,MVS和未老化的正常种子(对照,CK)进行吸胀处理,吸胀的前6 h每隔1 h取出种子,吸干表面水分置于培养皿内称重,4次重复。以吸胀时间为横坐标,种子增重为纵坐标绘制吸胀曲线。根据种子吸胀的阶段性变化规律,分别在快速吸水阶段(阶段Ⅰ)中段区域选择第1个时间点,在缓慢吸水阶段(阶段Ⅱ)选择第2个时间点,在生长吸水阶段(阶段Ⅲ)露白之后曲线开始上升的区域选择第3个时间点。
1.4 粗线粒体的提取
采用Yin等[23]的方法提取线粒体。将100粒燕麦吸胀种子样品置于冰上剪取种胚。之后将其转入预冷的研钵中,用2 mL研磨液(pH7.5,0.3 M甘露醇,50 mM焦磷酸四钠,2 mM EDTA-2 Na,0.5% PVP,0.5% BSA,20 mM半胱氨酸)研磨成匀浆,倒入10 mL离心管中,再用2 mL研磨液冲洗研钵2次,分别倒入10 mL离心管中,一共6 mL。2 000 g离心10 min,取上清;将上清液移至新预冷的10 mL离心管中,12 000 g离心15 min,倒掉上清液留沉淀;用2 mL加BSA的洗涤液悬浮沉淀,12 000 g离心15 min,倒掉上清液留沉淀;用2 mL未加BSA的洗涤液悬浮沉淀,保存于4℃冰箱中用于后续生理生化指标的测定。
1.5 种子发芽特性的测定
参照国际种子检验协会(ISTA)种子检验规程(2019)规定的发芽条件[22],选取50粒大小均匀一致的燕麦种子,摆放于装有3张湿润滤纸的培养皿(11.5 cm×11.5 cm)中,然后置于温度20℃,光照时间8 h,黑暗时间16 h的光照培养箱(GXZ-380B)中进行培养,设4次重复。第5 d进行初次计数,第10 d末次计数,最终统计正常种苗数,并测量其根长(Root length,RL)、苗长(Shoot length,SL)以及鲜重(Fresh weight,FW),培养期间每24 h统计胚根突破2 mm的种子数。按下列公式计算发芽率(Germination percentage,GP)[24]、平均发芽时间(Mean germination time,MGT)[25]、发芽指数(Germination index,GI)[24]和活力指数(Vigour index,VI)[24]。GP(%)=(G10/N)×100%;MGT(d)=∑(n×t)/ ∑n;GI=∑(Nt/t);VI=∑(Nt/t)×FW。式中G10为第10 d所有正常种苗数;N为供试种子数;t为发芽天数;n为第td胚根突破2 mm的种子数;Nt为第td的发芽数。
1.6 抗氧化酶活性的测定
将粗制线粒体提取液用于SOD,APX,GR,MDHAR,DHAR以及可溶性蛋白的测定,具体测定方法参照苏州科铭生物技术有限公司生产试剂盒(SOD-2-Y,APX-2-W,GR-2-W,MDHAR-2-W,DHAR-2-W)说明书进行。
1.7 活性氧和抗氧化物质的测定
将粗制线粒体提取液用于MDA,H2O2,AsA,DHA,GSH,GSSH含量测定,具体测定方法参照苏州科铭生物技术有限公司生产试剂盒(MDA-2-Y,H2O2-2-Y,ASA-2A-W,DHA-2-G,GSH-2-W,GSSG-2-W)说明书进行。
1.8 数据统计与分析
试验数据在Microsoft Excel和SPSS 22.0中进行统计与分析,在GraphPad Prism 7中进行作图。多重比较采用Duncans法进行,结果以平均值±标准误表示。
2 结果与分析
2.1 种子老化曲线与吸胀曲线的制作
将含水量为10%燕麦种子在45℃恒温水浴条件下进行控制劣变处理,老化曲线的变化显示随着劣变处理时间的延长,种子发芽率呈现由慢到快的下降规律(图1A)。参照种子活力水平确定20 d为高活力(HVS),27 d为中活力(MVS)。
将HVS,MVS和CK种子进行吸胀处理,吸胀曲线变化显示CK吸胀曲线变化中0~6 h为快速吸水阶段,6~14 h为迟滞阶段,14 h种子露白,进入发芽阶段(图1B)。HVS,MVS吸胀曲线变化趋势与CK类似,但吸水进程相对延长,0~6 h为快速吸水阶段,HVS在吸胀6~24 h为迟滞阶段,24 h种子露白;MVS在吸胀6~36 h为迟滞阶段,36 h种子露白。综合各样品种子吸胀变化规律,确定选取试验样品的时间分别为吸胀4 h,12 h和24 h。

图1 燕麦种子老化和吸胀曲线
2.2 不同活力燕麦种子发芽特性变化规律
燕麦种子发芽特性的测定结果显示,随着种子活力的下降,发芽率、平均发芽时间、活力指数、发芽指数、根长和苗长呈显著变化(图2B,2C,2D和2E)(P<0.05)。HVS的发芽率和苗长与CK无显著差异,MVS的发芽率和苗长显著低于CK和HVS(图2A和2F)(P<0.05)。同时MVS的活力指数、发芽指数和根长显著降低(P<0.05),平均发芽时间显著增加(图2B,2C,2D和2E)(P<0.05)。
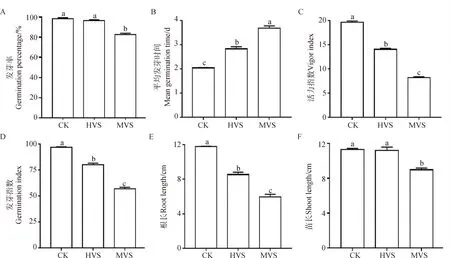
图2 不同活力水平燕麦种子发芽特性变化
2.3 不同活力燕麦种子吸胀过程中种胚线粒体抗氧化酶活性变化
燕麦种胚线粒体抗氧化酶活性检测结果显示,吸胀4 h时,GR,APX和MDHAR活性在CK,HVS,MVS内无显著差异,但HVS和MVS内SOD活性显著高于CK(P<0.05),且SOD活性在MVS内最高(图3A);HVS内DHAR活性显著低于HVS(图3E)(P<0.05)。
吸胀12 h时,CK,HVS,MVS内APX,MDHAR和DHAR活性无显著差异,但HVS内SOD活性显著低于CK和MVS(图3A,P<0.05);MVS内GR活性显著低于CK和HVS(P<0.05),且GR活性在CK,HVS内无显著差异(图3B)。
吸胀24 h时,GR,DHAR活性在CK,HVS,MVS内无显著差异,HVS内SOD活性显著高于CK和MVS(P<0.05),且MVS内SOD活性显著低于CK(P<0.05),变化规律与12 h时相反(图3A);APX活性在MVS内显著高于CK和HVS(P<0.05),但CK,HVS内APX活性无显著差异(图3C);MDHAR活性在HVS内显著低于CK和MVS(P<0.05),但在CK,MVS内MDHAR活性无显著差异(图3E)。
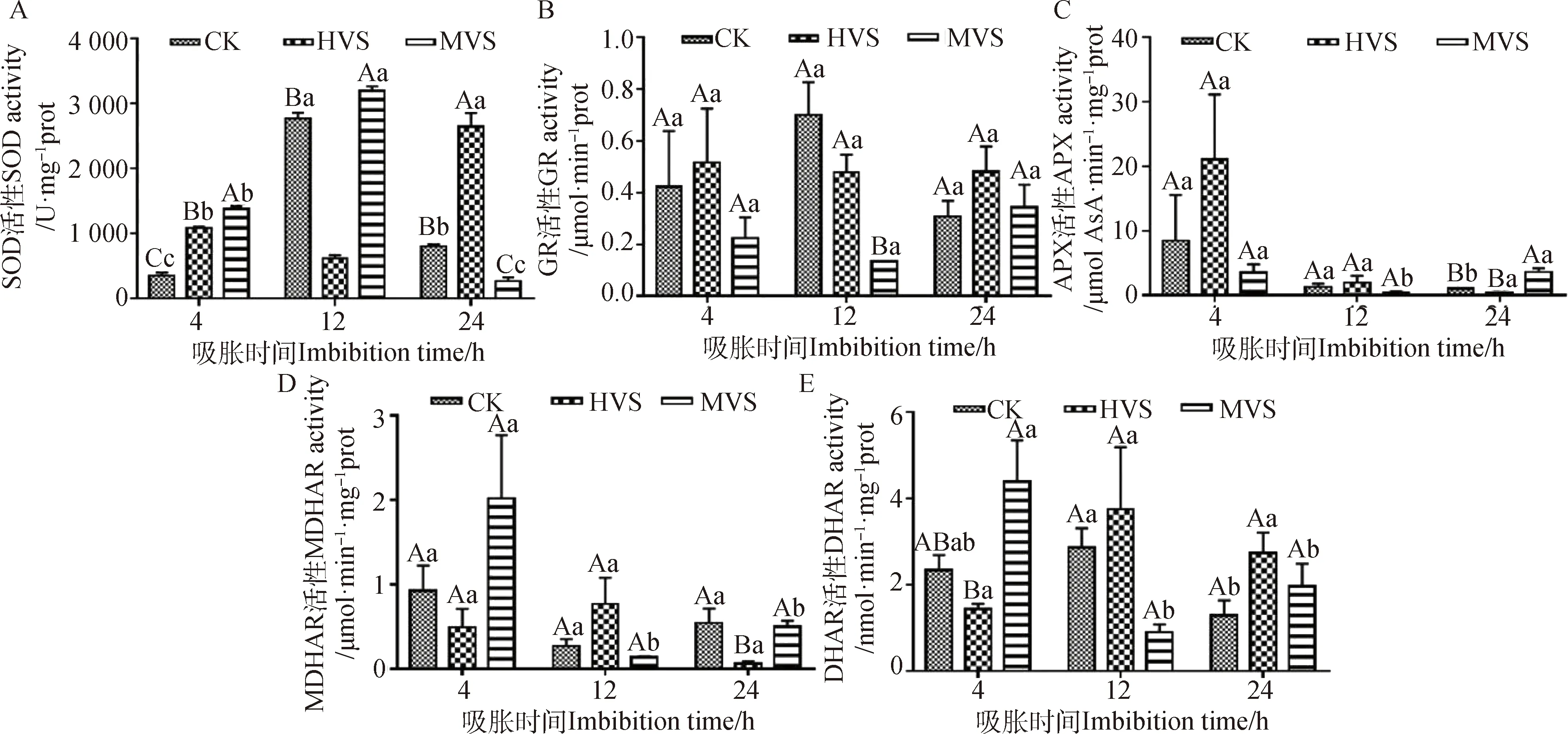
图3 燕麦劣变种子吸胀过程中种胚线粒体抗氧化酶活性变化
随着吸胀时间的增加,SOD活性在CK,MVS内呈现先上升后下降的趋势,在HVS内随吸胀时间的增加先下降后上升(图3A);APX活性在CK,HVS内逐渐下降,但均无显著差异,在MVS内APX活性呈现先下降后上升的趋势(图3C);MDHAR活性在CK,HVS内无显著差异,在MVS内MDHAR活性呈现下降的趋势(图3D);DHAR活性在CK内显现先上升后下降,在MVS内呈现下降的趋势,在HVS内DHAR活性随吸胀时间的延长差异不显著(图3E);GR活性在吸胀期间无显著差异(图3B)。
2.4 不同活力燕麦种子吸胀过程中种胚线粒体抗氧化物质含量变化规律
燕麦种胚线粒体AsA,DHA,GSH,GSSG含量和AsA/DHA,GSH/GSSG测定结果显示,在吸胀4 h时,GSSG含量在CK,HVS,MVS间无显著差异(图4E);AsA含量在MVS内显著低于CK和HVS(P<0.05),且CK和HVS之间差异不显著(图4A);DHA,GSH含量以及GSH/GSSG在HVS和MVS内均显著下降(P<0.05),AsA/DHA在MVS内显著高于CK和HVS(P<0.05),且CK和HVS之间差异不显著(图4B,4D,4F和4C)。
吸胀12 h时,AsA,DHA,GSH含量在HVS内显著低于CK和MVS(P<0.05),其中MVS内AsA含量显著高于CK(P<0.05),但DHA含量显著低于CK(P<0.05),GSH含量无显著差异(图4A,4B和4D);GSSG含量在CK内显著低于HVS(P<0.05),与MVS无显著差异,且HVS与MVS之间也无显著差异(图4E);AsA/DHA在MVS内显著高于CK和HVS(P<0.05),且CK和HVS之间差异不显著(图4C);GSH/GSSG在HVS内显著低于CK和MVS(P<0.05),且CK显著高于MVS(图4F)(P<0.05)。
吸胀24 h时,GSSG含量、GSH/GSSG在CK,HVS,MVS间无显著差异(图4E和4F);HVS内AsA,DHA含量显著低于CK和MVS(P<0.05),且CK和MVS内差异不显著,但在CK内AsA含量显著高于MVS(P<0.05),变化规律与吸胀12 h时相反,CK处理AsA/DHA显著高于HVS和MVS(P<0.05),且HVS和MVS之间差异均不显著(图4A-D)。
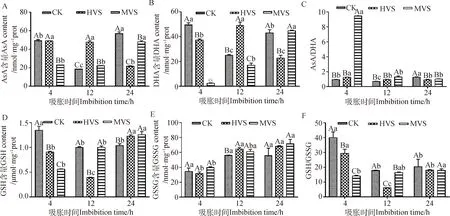
图4 燕麦劣变种子吸胀过程中种胚线粒体抗氧化物质含量变化
随着吸胀时间的增加,AsA,DHA含量以及AsA/DHA在CK内均呈现先下降后上升的趋势,在HVS内AsA含量呈现下降的趋势,在MVS内AsA含量呈现上升的趋势(图4A);在HVS内DHA含量呈现先上升后下降的趋势,在MVS内DHA含量呈现显著上升的趋势(图4B)(P<0.05);在HVS和MVS内AsA/DHA随吸胀时间的延长呈现下降的趋势(图4C);GSH含量、GSH/GSSG在CK内均呈现下降的趋势(图4D和4E);在HVS内GSH含量、GSH/GSSG均呈现先下降后上升的趋势(图4D和4F);在MVS内GSH含量和GSH/GSSG均呈现显著上升的趋势(图4D和4F)(P<0.05);GSSG含量在CK内无显著差异,但在HVS和MVS内呈现上升的趋势(图4E)。
2.5 不同活力燕麦种子吸胀过程中种胚线粒体H2O2和MDA含量变化规律
燕麦种胚线粒体H2O2和MDA含量测定结果显示,在吸胀4 h时,H2O2,MDA含量在CK,HVS,MVS间均无显著差异(图5)。吸胀12 h时,MDA含量在CK,HVS,MVS间无显著差异(图5B);H2O2含量在CK内显著低于HVS(P<0.05),与MVS无显著差异,HVS与MVS之间也无显著差异(图5A)。吸胀24 h时,H2O2含量在CK,HVS,MVS间无显著差异(图5A);MDA含量在CK内显著低于HVS和MVS(P<0.05),且HVS和MVS之间无显著差异(图5B)。随着吸胀时间的增加,在CK和MVS内H2O2含量无显著差异,HVS内呈现先上升后下降的趋势(图5A);CK内MDA含量呈现先上升后下降的趋势,HVS内呈现上升的趋势,MVS内无显著差异(图5B)。
3 讨论
种子活力取决于其抵抗老化造成的有害影响的能力,种子的发芽势、发芽率、发芽指数和活力指数是反映种子活力的重要指标[26-27]。本试验发现,随着燕麦种子活力的降低,发芽率、活力指数、和发芽指数均降低,这与糯玉米(Zeamays)在人工老化过程中种子活力变化的结果相似[28];而平均发芽时间有所上升,这与盐酸处理对白羊草种子活力的影响中的结果一致[29]。以上结果说明控制劣变处理导致的种子活力下降主要表现为种子发芽特性和萌发能力的降低。
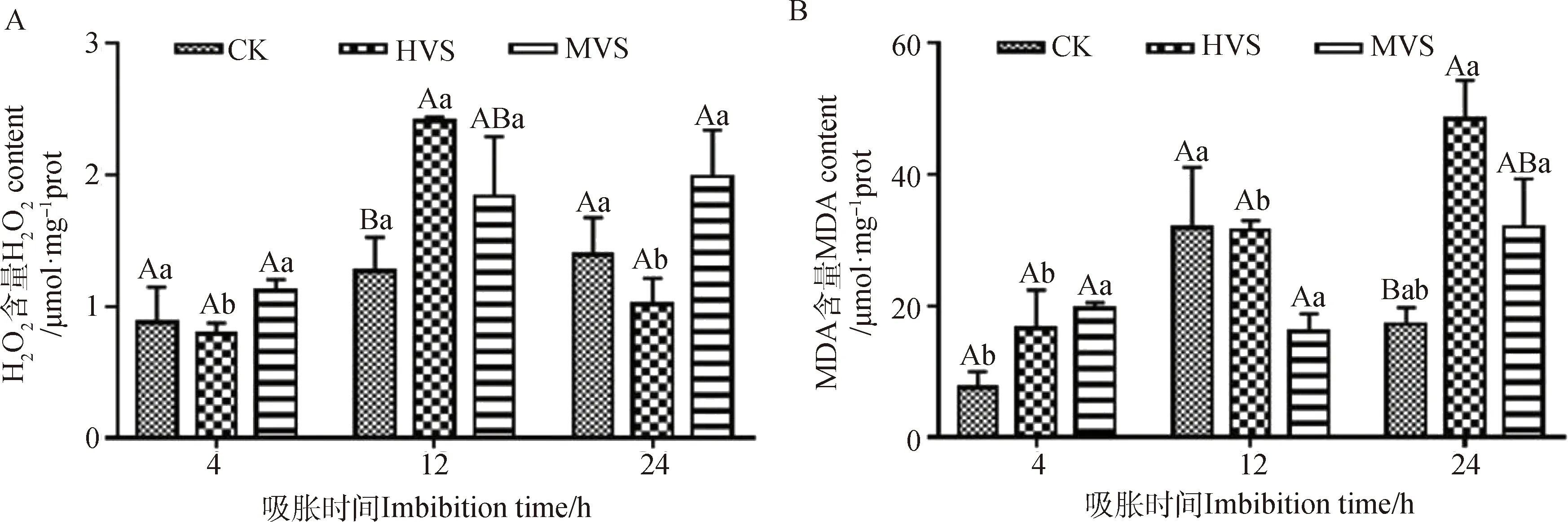
图5 燕麦劣变种子吸胀过程中种胚线粒体H2O2和MDA含量变化
本试验研究发现在吸胀初期(4 h),H2O2和MDA含量在CK,HVS,MVS内均维持在一个较低的水平,说明此时劣变处理对燕麦种胚线粒体的影响不大。高含水量(16%)老化燕麦种子在吸胀4 h时种胚线粒体内MDA含量变化的测定也得出了同样的结论[13]。SOD活性在老化种子内显著提高,APX,GR活性在CK,HVS,MVS内呈现先上升后下降的趋势,MDHAR,DHAR活性呈现先下降后上升的趋势,但都没有明显差异,DHA,GSH含量显著下降,H2O2含量没有显著变化,AsA含量在HVS较CK内变化不显著,AsA含量在MVS内显著下降。这表明此时老化种胚线粒体SOD具有清除ROS的功能,HVS内依赖AsA的APX起清除H2O2的主要作用,而MVS内则是由依赖MDHAR和DHAR的AsA再生进行清除。在缓慢吸水阶段(12 h),H2O2含量在HVS和MVS内升高,说明此时线粒体内正逐渐产生氧化损伤[30]。另外结果显示MDA含量有所下降,但变化不明显,推测可能和测定部位相关。SOD活性和GSH含量在CK,HVS,MVS内呈现先下降后上升的趋势,APX,MDHAR,DHAR活性呈现先上升后下降的趋势,AsA和DHA含量呈现先上升后下降的趋势,GR活性在HVS和CK内变化不明显,在MVS内则显著下降,GSSG,H2O2含量在HVS,MVS内显著高于CK。这表明缓慢吸水阶段HVS内种胚线粒体中通过依赖AsA的APX和依赖MDHAR,DHAR的AsA再生部分清除H2O2,MVS内种胚线粒体抗氧化系统功能大大减弱,这也可能是造成MDA含量降低的原因。老化燕麦种子吸胀12 h时种胚内抗氧化酶系统变化结果与本试验中MVS结果一致[31]。在生长吸水阶段(24 h),H2O2含量在MVS中达到最大,同时MDA含量在HVS和MVS内均发生升高,说明此时线粒体内氧化损伤进一步加剧。SOD,GR和DHAR活性在CK,HVS,MVS内呈现先上升后下降的趋势,MDHAR活性、AsA和DHA含量呈现先下降后上升的趋势,GSSG含量升高;APX活性在MVS内显著高于CK,HVS,GSH含量在HVS,MVS内显著高于CK。SOD,APX,DR等酶的活性敏感于MDA含量的变化[32-33]。这表明生长吸水阶段HVS内APX和依赖MDHAR再生的AsA清除H2O2的作用减弱,主要靠SOD清除ROS;MVS内种胚线粒体通过依赖AsA的APX和依赖MDHAR的AsA再生清除H2O2,缓解劣变处理对其造成的氧化损伤。人工老化大豆种子吸胀24 h时胚轴线粒体内AsA-GSH循环的研究结果与本试验HVS吸胀24 h时种胚线粒体的变化一致[34]。随着吸胀时间的延长,MVS内SOD活性呈先升高后下降的变化趋势,GR活性呈先降低后升高的趋势,与刺槐(Robiniapseudoacacia)种子中的结果一致[35]。APX,MDHAR,DHAR活性也呈现先降低后升高的趋势,AsA/DHA比值下降。这表明在MVS内SOD在吸胀前期发挥清除ROS的作用,而随着吸胀缓慢吸水阶段代谢活动的恢复,抗氧化酶活性逐渐被激活,逐渐起到抵御氧化损伤的作用。
基于本研究的结果,按照种子样品内抗氧化酶活性和抗氧化物质的比值,即HVS/CK,MVS/CK,MVS/HVS变化制作了示意图(图6),用以说明燕麦老化种子吸胀过程中AsA-GSH循环抗氧化酶和抗氧化物质的变化规律。同CK相比,HVS在种子吸胀初期,H2O2含量下降,SOD活性增强,在AsA-GSH循环中APX,GR活性增强,MDHAR,DHAR活性减弱,DHA,GSH和GSSH含量下降,AsA含量保持不变;在种子缓慢吸水阶段时,H2O2含量上升,SOD活性减弱,在AsA-GSH循环中APX,MDHAR和DHAR活性增强,GR活性减弱,DHA和GSSH含量上升,GSH含量下降,AsA含量增加;在种子生长吸水阶段时,H2O2含量下降,SOD活性增强,GR和DHAR活性增强,APX和MDHAR活性减弱,GSH和GSSH含量上升,DHA和AsA含量下降。以上结果说明,与未老化种子相比,高活力种子在AsA-GSH循环主要是在缓慢吸水阶段发挥了清除H2O2的作用。同CK相比,MVS在种子吸胀吸水阶段时,H2O2含量上升,SOD活性增强,在AsA-GSH循环中MDHAR和DHAR活性增强,APX和GR活性减弱,DHA和GSH含量下降,GSSH含量上升,AsA含量下降;在种子缓慢吸水阶段时,H2O2含量上升,SOD活性增强,在AsA-GSH循环中APX,GR,MDHAR和DHAR活性减弱,DHA含量下降,GSSH含量上升,GSH含量不变,AsA含量上升;在种子生长吸水阶段时,H2O2含量上升,SOD活性减弱,在AsA-GSH循环中APX,GR,和DHAR活性减弱,MDHAR活性不变,DHA,GSH和GSSH含量上升,AsA含量下降。以上结果说明,与未老化种子相比,中活力种子在快速和缓慢吸水阶段AsA-GSH循环发挥了部分清除H2O2的作用,在生长吸水阶段主要是AsA-GSH循环发挥清除H2O2的作用。同HVS相比,MVS在种子吸胀吸水阶段时,劣变种胚内H2O2含量增加,相应地SOD活性增强,但在AsA-GSH循环中APX,GR活性下降,仅MDHAR,DHAR活性增强,尽管AsA含量增加,也无法通过AsA-GSH循环来清除H2O2的增加。种子缓慢吸水阶段时,老化种胚内H2O2含量下降,相应地SOD活性仍然在增强,但在AsA-GSH循环中APX,GR,MDHAR,DHAR活性均下降,此时AsA-GSH循环处于相对静止状态。种子生长吸水阶段时进入胚根伸长生长阶段后,劣变种胚内H2O2含量又增加,SOD活性却下降,但在AsA-GSH循环中APX,MDHAR活性增强,DHAR,GR活性下降,AsA含量增加,通过AsA-GSH循环来清除H2O2的增加。以上结果说明,与高活力种子相比,中活力种子只有在进入生长吸水阶段后AsA-GSH循环才发挥清除H2O2的作用,另外中活力种子H2O2含量在吸胀4 h和24 h的增加是导致种子萌发抑制的重要因素。

图6 老化种子吸胀过程中AsA-GSH循环抗氧化酶和抗氧化物的变化示意图
4 结论
随着燕麦种子活力的下降,种子的发芽率、活力指数、发芽指数、根长、苗长下降以及平均发芽时间增加。在劣变燕麦种子吸胀的不同阶段,AsA-GSH循环抗氧化酶活性和抗氧化物质的变化不同。不同活力水平老化种子AsA-GSH循环抗氧化酶和抗氧化物质呈现不同的变化规律,与未老化种子(CK)和高活力种子(HVS)相比,中活力种子(MVS)线粒体AsA-GSH循环只有进入生长吸水阶段才发挥清除H2O2的作用,H2O2含量在吸胀4 h和24 h的增加是导致种子萌发抑制的重要因素。因此,燕麦种子劣变主要是通过降低AsA-GSH循环中APX,GR活性以及GSH/GSSG比值,使种胚线粒体内ROS积累,产生氧化损伤,继而抑制种子萌发和幼苗生长。

