慢性心力衰竭患者血清miR-30a、miR-101a表达及其与心肌重构和心功能的相关性*
高 敏,吴 艺,高守君,郝丽琴
(1.四川省雅安市人民医院急诊科 625000;2.四川省雅安市第四人民医院老年科 625000)
慢性心力衰竭(chronic heart failure,CHF)是一种临床常见疾病,是各种心脏疾病的终末阶段[1]。据报道显示,全球CHF发病率为1.5%~2.0%,病死率为5.6%~15.4%,近年随着我国人口老龄化加速,CHF发病率呈逐年增加趋势,严重影响患者生命健康,给社会及患者家庭带来沉重负担[2]。目前CHF发病机制尚不完全清楚,临床多采用对症治疗,这对患者预后改善效果不佳。有研究报道,神经内分泌过度激活和心肌重构是CHF发生的重要机制,早期发现并逆转心肌重构是CHF疗效的关键[3-4]。微RNA(microRNA,miRNA)是一种高度保守的单链非编码小RNA,参与机体和细胞的多种生物学功能,且其表达具有组织和细胞特异性。越来越多研究表明,miRNA在心力衰竭、心肌梗死、心律失常等心血管疾病发生发展过程中发挥重要作用[5-8]。研究报道,血清miR-30a水平与先天性心脏病心功能变化有关,miR-101a下调与房颤电重构机制有关[9-10],miR-101a和miR-30b有助于减轻β-细胞炎症因子引起的机体功能障碍[11],但关于血清miR-30a、miR-101a与CHF的关系鲜有文献报道。因此,本研究通过观察血清miR-30a、miR-101a表达水平变化,探究其与CHF患者心肌重构及心功能的关系,以期为临床CHF患者治疗提供一定理论指导。现报道如下。
1 资料与方法
1.1 一般资料
选取2017年3月至2019年6月四川省雅安市人民医院收治的住院治疗的CHF患者128例为CHF组,其中男74例,女54例,年龄39~76岁,平均(68.19±8.28)岁。CHF诊断参照《中国心力衰竭诊断和治疗指南(2014)》[12]:(1)有心脏病史、症状及体征;(2)水肿、乏力、呼吸困难等症状持续时间超过半年;(3)左室射血分数(left ventricular ejection fraction,LEVF)保留;(4)运动耐力明显下降。纳入标准:(1)符合CHF诊断标准;(2)年龄35~80岁;(3)男性左室舒张末期内径(left ventricular end-diastolic diameter,LVEDD)>55 mm,女性LVEDD>50 mm;(4)临床检查资料完整且自愿配合调查研究。排除标准:(1)入院前1个月接受经皮冠状动脉介入术治疗者;(2)有急性心肌梗死、不稳定性心绞痛、急性心肌炎等其他心脏疾病者;(3)合并肝、肾、甲状腺等重要脏器功能障碍者;(4)合并心脏瓣膜性、慢性阻塞性肺疾病及肺动脉栓塞者。进一步参照纽约心脏病协会(New York Heart Association,NYHA)心功能分级标准及6 min步行试验结果,由两名内科主治医师评定分为:日常活动无或有轻微症状,休息时症状无且6 min步行距离大于450 m的患者为NYHA心功能分级Ⅰ+Ⅱ级,共41例;日常活动明显受限,休息时无症状且6 min步行距离150~450 m的患者为NYHA心功能分级Ⅲ级,共50例;活动严重受限,休息状态下可出现心力衰竭(HF)症状且6 min步行距离小于150 m的患者为NYHA心功能分级Ⅳ级,共37例。另取同期门诊体检健康者50例为对照组,其中男28例,女22例,年龄39~79岁,平均(67.23±8.16)岁。CHF各分级患者与对照组年龄、性别比较差异无统计学意义(P>0.05),具有可比性。本研究经过四川省雅安市人民医院伦理委员会批准通过,收集受试者所有临床检查资料,所有样品采集及资料调查均取得患者及其家属知情同意并签字确认,符合《世界医学协会赫尔辛基宣言》。
1.2 试剂及主要仪器
TRIzol试剂(货号R0016,购自上海碧云天生物技术有限公司),实时荧光定量PCR(RT-PCR)试剂盒(货号638316)、PrimeScriptTMRT reagent Kit (Perfect Real Time,货号RR037A)购自日本TaKaRa公司,引物由上海吉玛生物科技有限公司合成;紫外分光光度计购自美国Thermo Fisher公司、RT-PCR仪7500型购自美国Bio-Rad公司。
1.3 方法
1.3.1血清miR-30a、miR-101a mRNA水平检测
采集患者入院第2天清晨空腹肘静脉外周血4 mL,3 500 r/min离心10 min,分离血清置于-80 ℃冰箱待检。采用TRIzol提取血清总RNA,用紫外分光光度计检测总 RNA 浓度及纯度,当260 nm与280 nm处理吸光度值比值(A260/A280)为1.8~2.0时为样品合格。逆转录获得模板cDNA,置于-20 ℃保存备用。RT-PCR检测miR-30a、miR-101a mRNA相对表达水平,采用20 μL反应体系:SYBR Premix Ex Taq Ⅱ(2×) 10.0 μL,ROX Ⅱ(50×) 0.4 μL,cDNA(50 ng/ μL) 2.0 μL,上、下游引物(10 μmol/L)各0.8 μL,ddH2O 6.0 μL。反应条件设置为:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 34 s,40个循环;添加溶解曲线。miR-30a上游引物序列5′-GTC GTA TCC AGT GCA GGG TCC GAG-3′,下游引物序列5′-CAC AGC TCG TAG AAC AGG AGG-3;miR-101a上游引物序列5′-TAC AGT ACT GTG AUA ACT GAA-3′,下游引物序列5′-CAG TTA TCA GTA CTG TAT T-3′;内参U6上游引物序列5′-GCT TCG GCA GCA CAT ATA CTA AAA T-3′,下游引物序列5′-CGC TTC ACG AAT TTG CGT GTC AT-3′。采用2-ΔΔCt法对血清miR-30a、miR-101a mRNA相对水平进行定量分析。
1.3.2超声心动图检查
由同一名指定超声医师采用Philips IE33超声仪,参照美国超声心动图学会推荐的方法检测心肌重构及心功能相关指标[13],主要包括心输出量(cardiac output,CO)、LVEF、左室后壁厚度(left ventricular posterior wall thickness,LVPW)、LVEDD、左房内径(left atrial diameter,LAD)、左室质量指数(left ventricular mass index,LVMI)、左室重构指数(left ventricular reconsitution index,LVRI)。
1.4 统计学处理
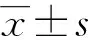
2 结 果
2.1 CHF患者与对照组血清miR-30a、miR-101a mRNA相对表达水平比较
与对照组比较,CHF组各分级患者miR-30a、miR-101a mRNA水平均升高,miR-101a mRNA水平均降低,且随心功能分级增加血清miR-30a mRNA水平逐级升高,miR-101a mRNA水平逐级降低,差异均有统计学意义(P<0.05)。见表1。
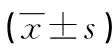
表1 CHF患者与对照组血清miR-30a、miR-101a mRNA水平比较
2.2 CHF患者与对照组心肌重构和心功能指标比较
与对照组比较,CHF组患者CO、LVEF、LVRI均降低,且随心功能分级增加而逐级降低,LVPW、LVEDD、LAD、LVMI均升高,且随心功能分级增加而逐级升高,差异均有统计学意义(P<0.05)。见表2。
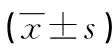
表2 CHF组患者与对照组心肌重构和心功能指标比较
2.3 CHF患者血清miR-30a、miR-101a mRNA水平相关性分析
CHF组患者血清miR-30a水平与miR-101a水平呈负相关(r=-0.864,P<0.05),见图1。

图1 CHF患者血清miR-30a、miR-101a mRN水平相关性分析
2.4 CHF患者血清miR-30a、miR-101a mRNA水平与心肌重构和心功能指标的相关性分析
CHF组患者血清miR-30a mRNA水平与CO、LVEF、LVRI呈负相关,与LVPW、LAD、LVMI呈正相关(均P<0.05);CHF患者血清miR-101a mRNA水平与CO、LVEF、LVRI呈正相关,与LVPW、LAD、LVMI呈负相关(均P<0.05),血清miR-30a、miR-101a mRNA水平与LVEDD无相关性(P>0.05)。见表3。

表3 CHF患者血清miR-30a、miR-101a mRNA相对表达水平与心肌重构和心功能指标的相关性
3 讨 论
CHF作为各种心脏疾病的终末期,临床表现极为复杂,其中多表现为心脏收缩或(和)舒张功能障碍,患者心功能逐渐恶化,左心室排血障碍,引起神经、内分泌等多系统代偿性变化,心肌细胞外心包信号异常、胶原异常沉积、炎症细胞浸润等,最终引起心肌重构,心肌重构是机体对损伤的一种适应性反应,其严重程度与心功能分级密切相关[2,14]。CO、LVEF、左室收缩末期直径(LVESD)、左室收缩末期容积(LVESV)等可反映CHF患者左心室收缩功能,LVEDD、LVPW可反映左心室、左心房壁厚度,LAD、LVMI、LVRI可反映患者心肌重构整体情况[2-3]。丁玫等[15]研究发现,与健康对照组比较,CHF患者LVPW、LAD、LVEDD显著升高。龚进坤等[16]研究报道,CHF患者LVESD、LVD、RVD均高于健康对照组,且与CHF失代偿组比较,CHF代偿组患者LVEF升高,LVESD、LVESV降低。本研究结果发现,与对照组比较,CHF组患者CO、LVEF、LVRI均降低,且随心功能分级增加而逐级降低,LVPW、LVEDD、LAD、LVMI均升高,且随心功能分级增加而逐级升高,提示CO、LVEF、LVPW、LVEDD、LAD、LVMI、LVRI可作为反映心功能及心肌重构的指标。
miRNA是一类长度18~25个核苷酸的内源性单链非编码RNA,在机体各组织中广泛表达,通过与mRNA 3′端非编码区靶向结合调节基因转录后的表达。徐振宇等[2]研究报道,血清miR-133a、miR-133b水平随CHF患者心功能分级增加而升高,与CHF患者心肌重构及心功能有关。刘雪贞等[9]研究报道,先天性心脏病合并CHF患儿血清miR-30a水平显著高于单纯先天性心脏病患儿及健康对照组儿童。李艳茹等[10]研究报道,与健康对照组比较,房颤组乳鼠心房细胞miR-101a、miR-101b水平显著下调,与房颤电重构机制有关。ROUX等[11]研究报道,miR-30a、miR-101a水平在炎症因子介导的Ⅰ型糖尿病胰岛β-细胞功能失调过程中起重要作用,白细胞介素(IL)-1β可增加MIN6细胞中miR-30a、miR-101a水平,二者水平与胰岛-β细胞凋亡有关。本研究结果发现,与对照组比较,CHF患者血清miR-30a mRNA水平升高,且随CHF患者心功能分级增加逐级升高,血清miR-101a mRNA水平降低,且随心功能分级增加逐级降低,提示血清miR-30a mRNA水平上调,miR-101a mRNA水平下调可能与CHF发生有关。本研究还发现,CHF患者血清miR-30a mRNA水平与miR-101a mRNA水平呈负相关,miR-30a mRNA水平与CO、LVEF、LVRI呈负相关,与LVPW、LAD、LVMI呈正相关;miR-101a mRNA水平与CO、LVEF、LVRI呈正相关,与LVPW、LAD、LVMI呈负相关,提示miR-30a、miR-101a可能与CHF患者心肌重构和心功能有关,监测血清miR-30a、miR-101a mRNA水平可能对CHF患者病情严重程度及预后评估有一定指导意义。
综上所述,血清miR-30a、miR-101a mRNA水平随CHF患者心功能分级增加分别升高和降低,与心肌重构和心功能密切相关,可能对CHF患者病情严重程度及预后评估有一定指导意义。但由于本研究样本量小且关于miR-30a、miR-101a在CHF心肌重构过程的具体调控机制仍未知,后期仍需加大样本量进一步深入探讨。

