间质上皮细胞转化因子扩增非小细胞肺癌患者的临床病理特征与预后分析
赵晓光,李慧,程瑞瑞,陈会会,张国俊
(郑州大学第一附属医院 呼吸与危重症医学科,河南 郑州 450052)
在我国,发病率及死亡率居高不下的肺癌得到了越来越多的关注。目前表皮生长因子受体(epidermal growth factor receptor,EGFR)和间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)等基因中的驱动程序致癌突变被认为是非小细胞肺癌(non-small cell lung cancer,NSCLC)的重要治疗靶标[1-2]。随着EGFR和ALK靶向药物的应用,非小细胞肺癌患者生存时间得到了延长,但几乎不可避免的是肿瘤通常会产生耐药性[3]。但是,免疫治疗中针对程序性死亡蛋白1(programmed death 1,PD-1)及其配体(PD-L1)单抗的出现又给后续治疗提供了新的选择[4]。c-MET基因即间质上皮细胞转化因子(mesenchymal epithelial transition factor,MET),是一种原癌基因,位于7号染色体长臂。MET扩增在NSCLC中发生率较低,且被认为是EGFR酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)的耐药机制之一[5]。本研究回顾性分析郑州大学第一附属医院病理确诊为NSCLC的MET扩增患者的临床病理特征及PD-L1、甲状腺转录因子-1(thyroid transcription factor-1,TTF-1)的表达及预后情况,为MET扩增NSCLC患者临床治疗提供数据参考。
1 资料与方法
1.1 研究对象收集2016年1月至2018年1月在郑州大学第一附属医院诊治的350例NSCLC患者。(1)纳入标准:①经病理诊断为NSCLC且初次治疗; ②进行二代基因测序(next generation sequencing,NGS);③NGS结果显示为MET拷贝数扩增患者行荧光原位杂交检测(fluorescenceinsituhybridization,FISH)验证,且结果以FISH法为准。(2)排除标准:①相关临床及影像资料不完善;②合并其他肿瘤。
MET扩增诊断标准:采用FISH法计数至少30个肿瘤细胞,当MET/染色体着丝粒探针7(centromeric probe7,CEP7)比值≥1.8时,诊断为MET基因扩增,否则为未扩增。收集入组患者的一般临床资料(包括性别、年龄、吸烟史、肿瘤家族史)、病理类型 、是否淋巴结转移、骨和脑转移情况、TNM分期、PD-L1、TTF-1、基因表达情况以及治疗所采取的化疗和(或)靶向治疗等治疗措施。根据联系电话或者门诊进行随访,截止日期为2020年1月31日。吸烟标准定义为:一生中连续吸烟达6个月或以上。
1.2 统计方法采用SPSS 23.0软件进行统计分析。计数资料以频数和率(%)表示,组间比较采用χ2检验。采用Kaplan-Meier法绘制生存函数曲线,生存分析比较采用 log-rank检验,检验水准α=0.05。
2 结果
2.1 MET扩增NSCLC患者的临床病理特征350例NSCLC患者中,MET扩增患者共有30例,发生率为8.57%。MET扩增患者中合并MET14外显子突变者2例,合并TP53基因突变者7例,合并KRAS基因突变者1例。MET扩增NSCLC患者的年龄为19~86岁,平均(59.20±13.28)岁,MET未扩增患者的年龄为32~89岁,平均(62.53±10.18)岁。对于伴有淋巴结转移、TTF-1阳性、PD-L1阳性、Ⅲ~Ⅳ期的NSCLC患者MET扩增率高于不伴淋巴结转移、TTF-1阴性、PD-L1阴性、Ⅰ~Ⅱ期者(P<0.05)。而MET扩增组较未扩增组在性别、年龄、肿瘤家族史、吸烟史、病理类型、骨转移、脑转移方面比较,差异无统计学意义(P>0.05)。见表1。
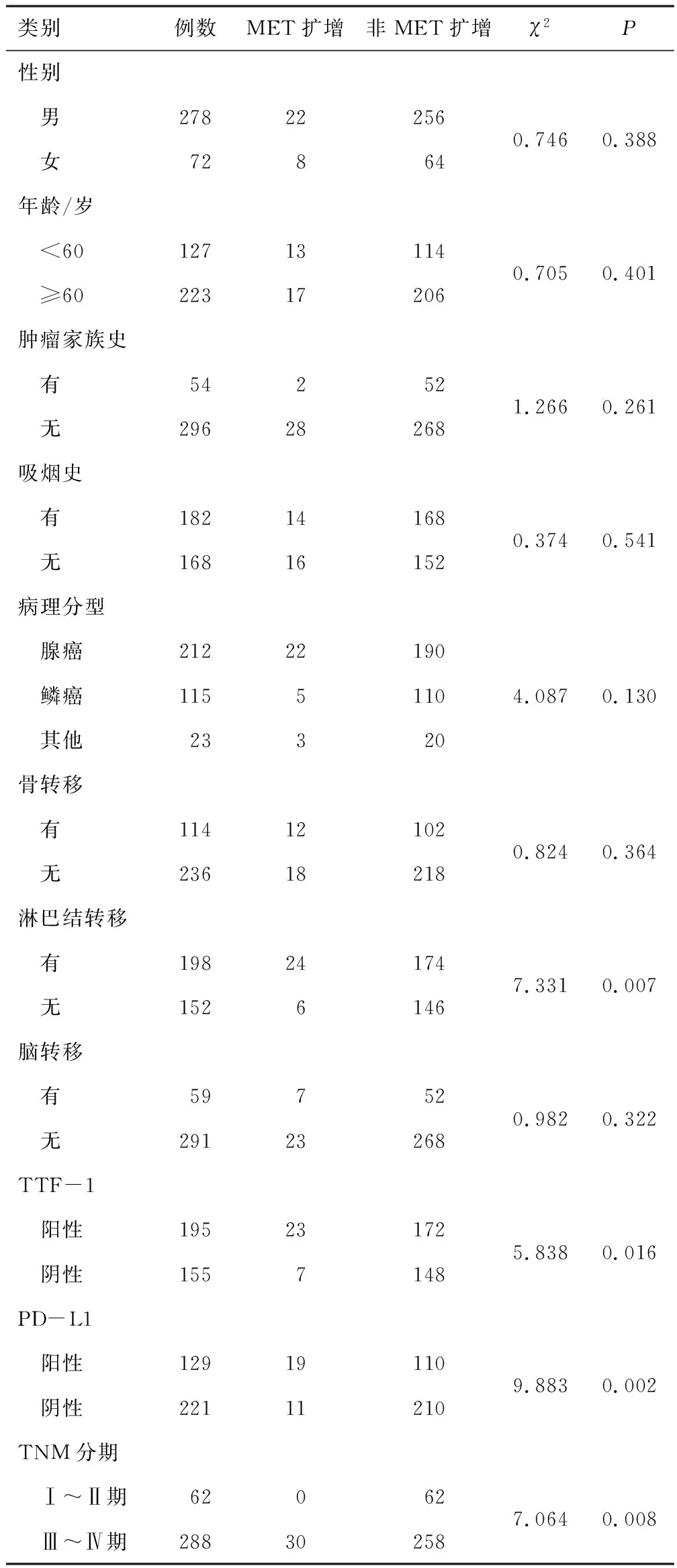
表1 NSCLC患者MET扩增与临床病理特征的关系(n)
2.2 MET扩增NSCLC患者的生存时间分析30例MET扩增NSCLC患者均处于Ⅲ~Ⅳ期,其中位总生存时间为12.0个月(95% CI:8.183~15.817个月),低于320例MET扩增阴性患者的20.8个月(95% CI:18.303~23.297个月),差异具有统计学意义(χ2=10.917,P=0.001)。MET扩增患者中接受化疗和(或)克唑替尼靶向治疗者26人,未治疗者4人,同时MET扩增患者中接受治疗的中位总生存时间(13.0个月)长于未治疗的(2.5个月),差异有统计学意义(χ2=31.933,P<0.05)。见图1、2。
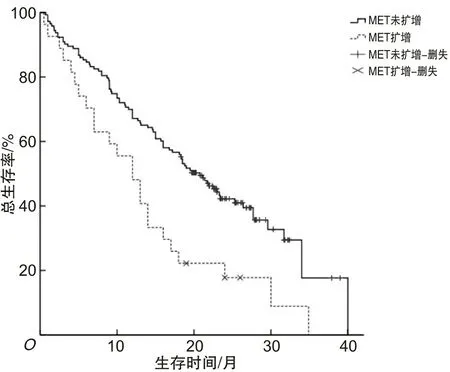
MET为间质上皮细胞转化因子;NSCLC为非小细胞肺癌。
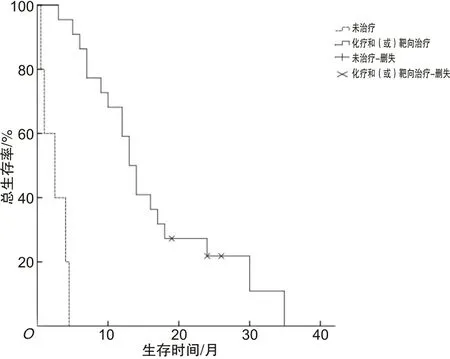
图2 MET扩增NSCLC患者治疗组与未治疗组的总生存曲线比较
3 讨论
根据2018年《GLOBOCAN全球癌症发病率和死亡率估计》报道,肺癌已成为世界上发病率及死亡率最高的肿瘤,且5 a生存率仍较低,约3/4的患者发现时已经是中晚期[6]。肺癌中最常见的病理类型是非小细胞肺癌,目前化疗仍是肺癌的基础治疗方案,但随着基因检测的逐渐普及,靶向治疗的重要性越来越突出,各种指南越来越强调个体化精准治疗。NGS相较传统检测方法,除可评估TMB、微卫星不稳定性等免疫治疗相关分子标志物外,还可同时检测达数百个基因的位点突变、基因融合、拷贝数变异等多种变异,故深受临床医生的欢迎[7]。本研究为减小误差,所有NGS结果显示为MET扩增患者进行FISH法再次验证的结果。
EGFR-TKI现在已被广泛用于EGFR突变的NSCLC患者,但是肿瘤耐药的情况几乎不可避免。已有研究表明MET扩增是EGFR-TKI耐药的主因之一[8],现MET扩增成为了新的研究热点。c-MET原癌基因存在于人类7号染色体的长臂,MET基因编码的c-Met蛋白是肝细胞生长因子(hepatocyte growth factor,HGF)的酪氨酸激酶受体,HGF与c-Met结合激活下游信号通路,促进细胞增殖、生长、迁移、血管生成[9]。MET基因出现异常,就会持续激活相关信号通路,使癌细胞不断增殖和转移,而MET扩增就是MET基因异常形式之一。MET扩增可与其他致癌驱动因子共存,例如EGFR、TP53和KRAS,EGFR突变的NSCLC患者使用EGFR-TKI产生原发性耐药就是这个原因[5]。本研究发现MET扩增可同时合并MET14外显子的突变及TP53、KRAS等基因的异常,与既往研究[10]相符。
本研究入组的350例NSCLC患者中,MET扩增者有30例,扩增率为8.57%,与来自Nature的一项研究报道[11]基本一致。本研究发现MET扩增NSCLC患者在初次确诊时较MET未扩增者临床分期往往更靠后,且更容易出现淋巴结转移,同时MET扩增患者的总生存期更短,提示对于NSCLC患者MET扩增可能是其预后较差的危险因素之一,故对此类患者应注意行MET基因检测。日本滨松医科大学的一项研究发现MET扩增率在TTF-1阳性NSCLC患者中高于TTF-1阴性患者[12],与本研究结果一致。这可能是由于MET通路异常激活后可导致肿瘤侵袭、转移,机体为对抗肿瘤的生长而提高了TTF-1的表达,TTF-1表达后通过降低Ki-67表达使肿瘤细胞凋亡。同时,本研究发现MET扩增NSCLC患者的PD-L1阳性表达率更高。原因可能是MET信号可与位于γ干扰素下游的Janus激酶2/信号转导及转录活化因子3(JAK2/STAT3)相互作用,从而诱导MET扩增肿瘤中PD-L1的表达[13]。而MET扩增导致的通路异常是否可增加免疫治疗的效果,目前尚缺少此方面的临床数据,需进一步的研究与临床试验进行疗效观察。
在MET扩增的靶向治疗方面,最新的NCCN指南仅指出高水平MET扩增NSCLC患者可应用克唑替尼治疗,关于克唑替尼对MET扩增NSCLC患者治疗效果的更多研究正在进行中。本研究发现化疗和(或)克唑替尼靶向治疗可延长MET扩增NSCLC患者的生存时间。我国的一项多中心研究表明,15名MET基因扩增阳性的非小细胞肺癌患者入组接受克唑替尼治疗,接受克唑替尼治疗的患者总生存期明显长于未接受克唑替尼治疗组[14],结果与本研究相同。同时来自Targeted oncology的meta分析也证实了克唑替尼在具有c-ros致癌基因1(ROS1)融合或MET基因扩增NSCLC患者中的疗效[15]。
综上,NSCLC患者MET扩增与非MET扩增者相比,MET扩增多见于临床分期处于中晚期伴淋巴结转移的患者,且TTF-1、PD-L1的表达率更高,提示预后不佳,在临床工作中建议对此类患者行MET基因检测。

