头孢噻肟所致药品不良反应文献分析*
赵,张东梅,姜,宗黎琼,郭 澄,张剑萍
(上海交通大学附属第六人民医院药剂科,上海 200233)
头孢菌素类为经典杀菌剂,作用机制为结合青霉素结合蛋白,抑制细菌细胞膜的细胞壁合成,破坏膜结构。第3 代头孢菌素类及其复方制剂占临床治疗的主导地位[1]。头孢噻肟属第3 代头孢菌素类,随着临床的广泛应用,其引发的药品不良反应(ADR)也较多。为此,将相关ADR 文献进行统计分析,供临床合理用药参考。
1 资料与方法
以“头孢噻肟”为检索词,检索万方数据库1998 年至2019 年有关头孢噻肟致ADR 的文献资料,纳入无重要信息缺失、可进行因果评价的病例报道,排除重复报道、超量用药、药物配伍不当或非病例报道。共得有效文献144 篇、病例169 例。将患者的年龄、性别、原患疾病、给药途径、ADR 发生时间、预后等相关信息录入Excel表格,并归纳分析。
2 结果
2.1 病例及ADR 基本情况
结果见表1 至表3。呼吸系统感染为主要原患疾病,居前三位的为肺炎(25 例,14.79% ),气管炎、支气管炎(24 例,14.20%),呼吸道感染、上呼吸道感染(22 例,13.02% );静脉滴注(155 例,91.72% )为主要给药途径,其次为静脉注射(13 例,7.69% )、皮下注射(1 例,0.59%)。
2.2 过敏史、预后与转归
56 例(33.14%)无过敏史;9 例(5.33% )有过敏史,其中6 例对青霉素过敏,3 例对其他头孢菌素类过敏,含对多种药物过敏者1 例;其余患者过敏史不详。行皮肤过敏试验(简称皮试)者 59 例(34.91% ),其中,头孢菌素类皮试阴性42 例,含1 例青霉素皮试阳性;青霉素皮试阴性 13 例、阳性 2 例。15 例(8.88% )有头孢菌素类用药史,包括2 例有头孢噻肟用药史,5 例有青霉素用药史;另有7 例(4.14%)有青霉素用药史。经停药并对症治疗后,164 例缓解或痊愈,其中132 例(80.49%)于 1 min 至 24 h 内缓解或痊愈,14 例(8.54% )于 3 d 内痊愈,其余 18 例(10.98% )均于 90 d 内痊愈。5 例(2.96% ,男 3 例、女 2 例)死亡,包括过敏性休克 4 例和急性喉头水肿1 例;发生于用药首日5 min 内及用药次日各2 例,均于ADR 发生当日即死亡。
2.3 因果关系评价
依据国家药品不良反应监测中心的ADR 报告表中有关ADR 分析的5 个问题,对收集汇总的病例进行关联性评价。在169 例病例中,评价结果为“肯定有关”的有 10 例 (5.92% ),“很 可 能 有 关 ”的 有 155 例(91.72%),“可能有关”的有 4 例(2.37% )。
3 讨论
3.1 ADR 发生的基本特点
由表1 至表3 可见,头孢噻肟所致ADR 多见于11 岁以内患儿;发生时间以用药后第1 天最多,尤其是用药后30 min 内,发生于用药5 min 内的有41 例,其中用药后即刻发生的有10 例;静脉滴注是主要用药途径。建议临床对患者用药前后的症状及体征进行观察,尤其是静脉滴注用药患者,应适当调节其初始用药的滴速;11 岁以内的少年儿童为重点关注人群,首次用药前30 min为重点关注时段。
3.2 ADR 的临床类型
过敏性休克:是头孢噻肟所致ADR 的主要表现形式,也是抗菌药物致药源性死亡的首要原因[2]。本调查中 72 例过敏性休克患者中,男 38 例、女 34 例;25 例(34.72% )无过敏史,1 例(1.39% )有头孢菌素类过敏史,5 例(6.94% )有青霉素过敏史,其中 2 例同时对至少1 种头孢菌素类过敏;10 例(13.89%)有头孢菌素类用药史,5 例(6.94% )有青霉素用药史;21 例头孢菌素类皮试阴性,7 例青霉素皮试阴性;静脉滴注(64 例,88.89%)是主要用药途径。60 例(83.33% )发生于用药首日,其中,用药 5,10 min 内发生的分别为 36 例(50.00% )、20 例(27.78% );其余病例均于用药 6 d 内发生。经停药并对症治疗后,于当日好转或痊愈的67 例(93.06% ),其中 40 例(55.56% )为 120 min 内即好转或痊愈;1 例于第 3 天痊愈。另有 4 例(5.56% )死亡。提示除有药物过敏史的患者外,过敏性休克的重点关注人群还应包括无用药史、无过敏史的首次静脉滴注用药患者;重点关注时段为用药的前10 min。
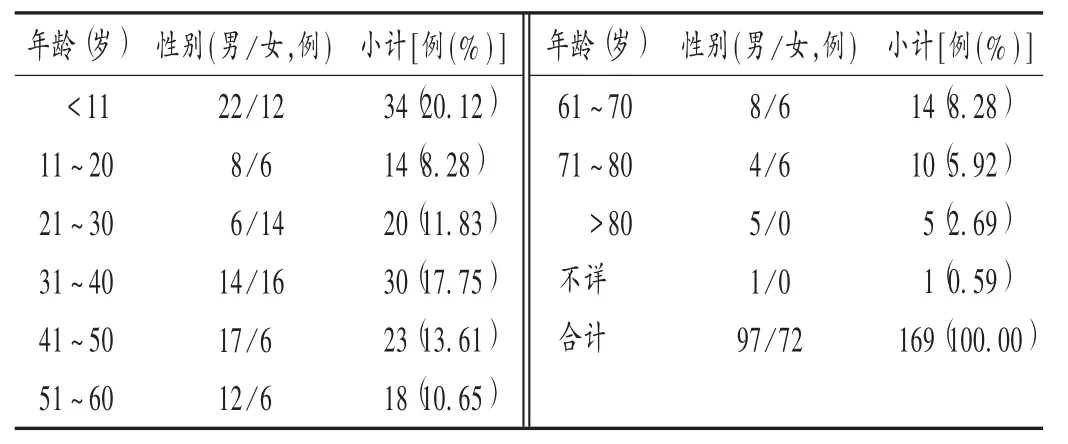
表1 ADR 患者性别与年龄分布(n =169)Tab.1 Distribution of the gender and age of patients with ADRs(n =169)
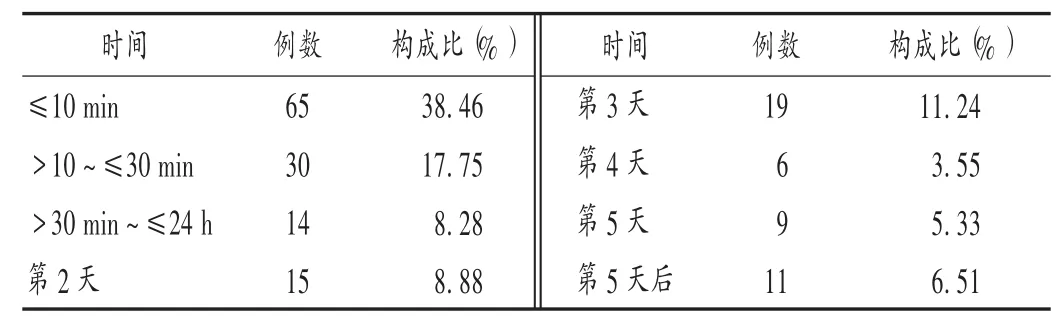
表 2 ADR 发生时间分布(n =169)Tab.2 Distribution of the onset time of ADRs(n = 169)
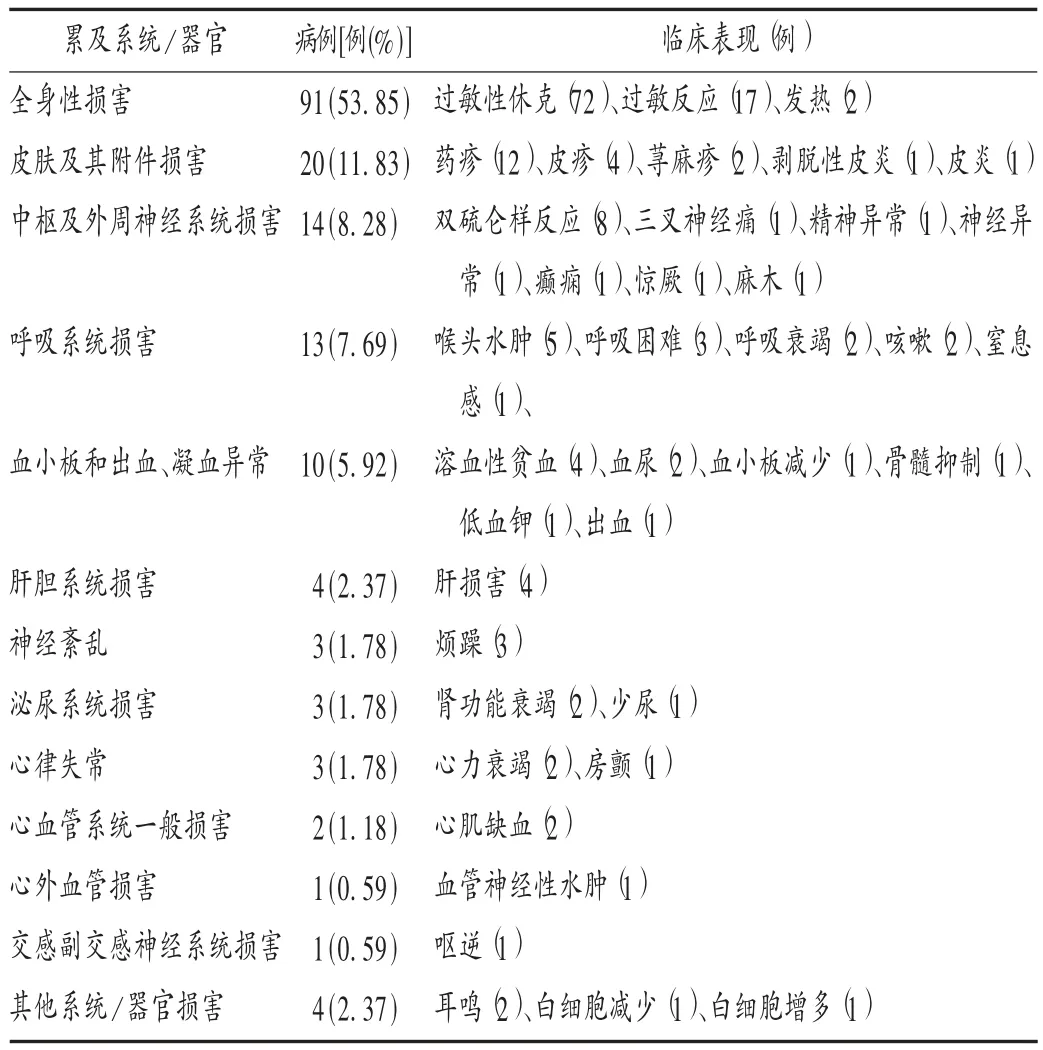
表 3 ADR 累及系统 /器官(n =169)Tab.3 Systems/organs involved in ADRs(n = 169)
血小板和出血、凝血异常:药物引起的血液学改变约占全部药源性疾病的10% ,而据世界卫生组织(WHO)药物不良反应监测中心的估计,药源性溶血性贫血(DHA)约占药源性血液学反应的 10%[3]。头孢菌素类在引起溶血性贫血的抗菌药物中居首位[3]。本调查中,发生溶血性贫血的为静脉滴注用药的4 例患者(男、女各2 例),且其中3 例发生于用药后的5 d 内;停药并对症治疗后,均于1 个月内痊愈。药源性免疫性贫血、药物氧化性溶血性贫血、三重复合物学说,是DHA 发生的3 种可能机制[3]。免疫复合物型是头孢菌素引起的溶血性贫血的可能机制。在反复使用头孢菌素类药物后,机体受刺激产生抗体(药物依赖性),其与头孢菌素(或其代谢产物)形成可与红细胞膜上的特异性靶蛋白相结合的免疫复合物,激活补体,发生抗体抗原免疫反应,导致红细胞破裂,引起溶血反应,常在血管内发生溶血[4-5]。提示若需长期使用头孢菌素类药物,应定期监测血常规、尿常规、凝血功能等指标。16 岁以下青少年儿童包括血液系统在内的各项机体功能尚未发育完全,是重点关注对象。
肝肾系统ADR:出现肝肾损害的有7 例(男6 例、女1 例),均发生于用药后的5 d 内,经停药并对症支持治疗后,于半个月内好转或痊愈,未出现死亡病例。药物引起肾脏ADR 主要是由于药物的直接肾毒性(与药物浓度及剂量相关)影响肾脏代谢过程或造成尿路梗阻所致[6]。头孢菌素类药物导致的肾毒性不表现为过敏性损伤,而是表现为药物浓度过高导致的肝肾损害,近曲小管细胞是发生肾损伤的主要部位[7]。可能的因素有大多数头孢菌素类药物经肾排泄,抑制、干扰肾小管细胞酶活性,引起急性肾小管坏死而致血尿[5],而头孢噻肟约有80%的给药量经肾脏排泄;头孢噻肟要求快速静脉滴注,短时间内流经肝脏和肾脏的血流中血药浓度较高,更易结晶,刺激或损害肝肾细胞。1% ~11% 的患者在使用注射用头孢菌素类药物后,其转氨酶、碱性磷酸酶水平均会轻度升高,但停药后大多数患者可自行恢复[7]。因此,头孢菌素类药物用药前后有必要监测患者的肝肾功能,一旦发现异常,及时停药是关键。
呼吸系统ADR:血管神经性水肿属Ⅰ型变态反应,是由于血管扩张和体液外渗导致的真皮、结缔组织或黏膜的水肿,发生于咽喉部的血管神经性水肿为喉头水肿。喉头水肿是呼吸系统ADR 的主要表现形式,本研究中共发现 5 例(38.46% ),其中男 4 例、女 1 例;均为静脉滴注用药,与周正东[8]的研究结果相符;头孢菌素类皮试阴性4 例(含1 例青霉素皮试阳性者),青霉素皮试阴性1 例;均发生于用药2 d 内,其中发生于用药首日15 min 内的有3 例;除1 例于当日死亡外,其余均于当日痊愈。抗菌药物是引起药源性水肿最多的药物(31.21% )[8-9],β - 内酰胺类药物(以第 3 代头孢菌素类居多)是主要药物[8-10]。鉴于喉头水肿会导致严重后果,对于静脉滴注患者,若在用药过程中或用药后30 min出现呼吸窘迫及哮鸣音,临床应注意鉴别是否为喉头水肿所致。保持患者的呼吸道通畅、及时改善通气是防治喉头水肿的关键。
3.3 头孢菌素类药物的皮试
头孢菌素类药物为β-内酰胺酶药物,其有共同的结构基础,发生过敏反应的抗原决定簇结构主要和各自的侧链结构有关,用某种头孢菌素类药物代替所有品种的皮试,易导致临床误判;青霉素的6 位侧链和头孢菌素类药物的7 位侧链是二者交叉过敏的基础,二者侧链结构的相似性,决定了交叉过敏反应发生的概率,用青霉素代替,不仅假阳性多,且阴性结果也不完全可靠[11];用同种头孢菌素类皮试,鉴于不同厂家(尤其是进口的与国产的)的生产工艺的差异与质量控制的波动性,难以避免假阳性或假阴性结果。提示为保障医疗安全需进行皮试时,皮试液应以同厂家同批号的新鲜配制原药为宜,以确保皮试结果的准确性。
3.4 合理用药要点
建议临床使用头孢噻肟前,应严格把握使用指征,详细询问过敏史、用药史;使用时注意观察患者的体征变化;使用后,注意监测血常规、尿常规、凝血指标的变化,对于需长期使用者,应定期监测各项指标的变化。重点关注人群为青少年儿童(尤其是11 岁以下者)和静脉用药患者,重点关注首次用药后的前30 min(过敏性休克为用药后的前10 min),防止严重ADR 发生。

