基于网络药理学研究黄连解毒汤调控巨噬细胞极化的作用机制
李弼仁 莫雨晴 黄英杰 朱泳 罗川晋

摘 要 目的:研究黃连解毒汤调控巨噬细胞极化的作用机制,以期挖掘其抗炎机制。方法:通过中药系统药理学数据库(TCMSP)、Swiss Target Prediction数据库筛选出黄连解毒汤的活性成分及预测靶点;通过 GeneCards、OMIM数据库获取巨噬细胞极化的相关靶点,利用Cytoscape 3.6.0软件绘制黄连解毒汤活性成分-巨噬细胞极化靶点网络图;通过String数据库构建蛋白互作网络并提取核心靶点;通过Cytoscape 3.6.0软件及DAVID网站进行基因本体(GO)富集分析和京都基因与基因组百科全书(KEGG)通路富集分析。结合网络药理学分析结果,将小鼠巨噬细胞RAW264.7细胞分为空白对照组、模型组、辛伐他汀组(10 μmol/L)和黄连解毒汤含药血清组(将黄连解毒汤以10 g/kg灌胃大鼠并取血制得),除空白对照组和模型组加入培养基外,其余各组均加入相应药液或含药血清100 μL,培养2 h;然后除空白对照组外,其余各组均加入脂多糖溶液(100 μg/L)培养24 h以诱导炎症。采用Western blot法检测细胞中腺苷酸活化蛋白激酶(AMPK)的表达水平,采用实时荧光定量聚合酶链式反应(PCR)法检测细胞中M1型极化因子[白细胞介素1β(IL-1β)、一氧化氮合酶(iNOS)]和M2型极化因子[IL-10、缺氧诱导分化因子1(Fizz1)]mRNA的表达水平。结果:共筛选到黄连解毒汤的50种活性成分(如刺槐黄素、汉黄芩素、槲皮素、β-谷甾醇等),其可通过失巢凋亡负调节、星形胶质细胞活化等12个GO条目,以及雌激素信号通路、膀胱癌通路、AMPK信号通路等20条KEGG通路调控巨噬细胞极化。细胞试验结果显示,与空白对照组比较,模型组细胞中AMPK蛋白以及Fizz1、IL-10 mRNA的表达水平均显著降低(P<0.01),IL-1β、iNOS mRNA的表达水平均显著升高(P<0.01);与模型组比较,黄连解毒汤含药血清组和辛伐他汀组细胞中AMPK蛋白以及Fizz1、IL-10 mRNA的表达水平均显著升高(P<0.05或P<0.01),IL-1β、iNOS mRNA的表达水平均显著降低(P<0.01)。结论:黄连解毒汤可通过多个靶点、多个通路调控巨噬细胞极化;其可通过AMPK信号通路上调M2型极化因子的表达、下调M1型极化因子的表达,调控巨噬细胞极化,发挥抗炎作用。
关键词 黄连解毒汤;巨噬细胞极化;AMPK信号通路;网络药理学;抗炎作用
中图分类号 R285.5 文献标志码 A 文章编号 1001-0408(2021)05-0552-07
ABSTRACT OBJECTIVE: To study the mechanism of Huanglian jiedu decoction (HJD) regulating macrophage polarization in order to explore its anti-inflammatory mechanism. METHODS: The active components and predicted targets of HJD were screened through TCMSP and Swiss Target Prediction database; the related targets of macrophage polarization were obtained by GeneCards and OMIM database, and the network diagram of active ingredient-macrophage polarization target of HJD was drawn by using Cytoscape 3.6.0 software;protein interaction network was constructed by String database and core targets were extracted. Gene ontology (GO) enrichment analysis and Kyoto Encyclopedia of genes and genomes (KEGG) pathway enrichment analysis were carried out by using Cytoscape 3.6.0 software and DAVID website. Combined with the results of network pharmacology analysis, RAW264.7 macrophage cells were divided into blank control group, model group, simvastatin group (10 μmol/L) and serum containing HJD group (obtained from the blood after the rats were given HJD at the dose of 10 g/kg). Except the blank control group and model group were added culture medium, the other groups were added with 100 μL of relevant drug solution or serum containing drug. After 2 h of culture, except for the blank control group, LPS solution (100 μg/L) was added to the other groups for 24 h to induce inflammation. Western blot assay was used to detect the expression of AMPK. mRNA expression of M1 type polarization factor (IL-1 β, iNOS) and M2 type polarization factor (IL-10, Fizz1) were detected by RT-PCR. RESULTS: A total of 50 active components of HJD (such as acacetin, wogonin, quercetin, β-sitosterol) were screened, which could regulate macrophage polarization through 12 GO items (such as anoikis, astrocyte activation), and 20 KEGG pathways (such as estrogen signaling pathway, bladder cancer pathway, AMPK signaling pathway). The results of cell test showed that compared with blank control group, the expression of AMPK protein, Fizz1 and IL-10 mRNA in model group were significantly decreased (P<0.01), while the expression of IL-1β and iNOS mRNA were significantly increased (P<0.01); compared with model group, the expression of AMPK protein, Fizz1 and IL-10 mRNA in serum containing HJD group and simvastatin group were significantly increased (P<0.05 or P<0.01), while the expression of IL-1β and iNOS mRNA were significantly decreased (P<0.01). CONCLUSIONS: HJD can regulate macrophage polarization through multiple targets and pathways; it can up regulate the expression of M2-type polarization factors and down-regulate the expression of M1-type polarization factors through AMPK signaling pathway, regulate macrophage polarization and play an anti-inflammatory role.
KEYWORDS Huanglian jiedu decoction; Macrophage polarization; AMPK signaling pathway; Network pharmacology; Anti-inflammatory effect
作为单核吞噬细胞系统晚期分化细胞,巨噬细胞在不同微环境中的功能特性不同,故能在体内外各种因素诱导下出现不同表型、形态及功能分化,即巨噬细胞的极化[1]。根据其表型和分泌的细胞因子,巨噬细胞可分为经典活化型巨噬细胞(M1型)及替代活化型巨噬细胞(M2型)两大类,其中M1型巨噬细胞在疾病的发展中分泌白细胞介素1β(IL-1β)、一氧化氮合酶(iNOS)等多种促炎介质,而M2型巨噬细胞则主要分泌IL-10、缺氧诱导分化因子1(Fizz1)等抗炎细胞因子,两者极化功能几乎相互拮抗[2-4]。研究表明,巨噬细胞极化在感染、代谢、免疫及肿瘤的发生发展等过程中均发挥着重要作用[5]。
黄连解毒汤来源于《外台秘要》,由黄连、黄芩、黄柏、栀子组成,具有清热、解毒、泻火的功效,且具有明显的抗炎作用[6]。现有研究表明,黄连解毒汤能抑制巨噬细胞源性泡沫细胞的炎症因子IL-1β的表达,并上调IL-10的表达,促进巨噬细胞向M2表型转化[7-9],但具体作用机制尚未明确。基于此,本研究拟通过网络药理学方法及相关细胞试验,探讨黄连解毒汤对巨噬细胞M1、M2型极化的影响及可能机制,以挖掘其抗炎机制,为指导巨噬细胞极化相关疾病的临床治疗提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器有:PIDRed 96型聚合酶链式反应(PCR)仪(德国Biometra公司)、AX-Ⅱ型凝胶成像仪(上海恒勤仪器设备有限公司)、JS-Power300型电泳仪(上海迪奥生物科技有限公司)、DHP-9032B型电热恒温培养箱(上海一恒科学仪器有限公司)。
1.2 主要药品和试剂
本研究所用主要药品与试剂有:黄连、黄芩、黄柏、栀子药材(广东省康美药业有限公司),辛伐他汀片(荷兰Merck Sharp & Dohme B.V.公司,批号B14221902065,规格20 mg),DMEM 高糖培养基、RIPA蛋白裂解液(美国Hyclone公司,批号分别为428025132、417014156),胎牛血清(浙江天杭生物科技有限公司,批号17060403),磷酸盐缓冲液(PBS)、脂多糖(LPS)、RPMI 1640培养基、TRIzol试剂、ECL化学发光试剂盒、十二烷基磺酸钠-聚丙烯酰胺电泳(SDS-PAGE)试剂盒、二喹啉甲酸(BCA)蛋白定量试剂盒(美国PeproTech公司,批号分别为011779、031837、022848、021937、011645、224899、235768),山羊抗小鼠AMPK单克隆抗体、HPR山羊抗小鼠免疫球蛋白G(IgG)二抗、鼠源甘油醛-3-磷酸脱氢酶(GAPDH)抗体(美国Thermo Fisher Scientific公司,批号分别为26053441、23148673、23264128),实时荧光定量PCR试剂盒(美国AB-clonal公司,批号A12043),PCR引物(广州晶欣生物科技有限公司);其余试剂均为分析纯或实验室常用规格,水为纯净水。
1.3 动物
本研究所用动物为SPF级6周龄雄性SD大鼠,体质量250~300 g,购自海南省药物安全性评价研究中心,动物生产许可证号为SCXK(琼)2020-0007,动物使用许可证号为SYXK(琼)2017-0013。饲养环境温度为22~24 ℃,12 h昼夜光照循环。本研究的动物实验获得海南省中医院伦理委员会批准。
1.4 细胞
本研究所用细胞为小鼠巨噬细胞RAW264.7细胞株,由中国科学院上海生命科学院细胞资源中心提供。
2 方法
2.1 黄连解毒汤中活性成分的筛选
采用中药系统药理学分析平台(TCMSP,http://lsp.nwu.edu.cn/tcmsp.php),分别以“黄连”“黄芩”“黄柏”“栀子”为检索词,以口服生物利用度(OB)≥30%[10]、类药性(DL)≥0.18[11]为条件对活性成分进行筛选,并保存活性成分的2D结构文件,再通过TCMSP平台找出各活性成分对应的“Smile”号,保存为“SDF”格式文件(本文选择有对应“Smile”号的活性成分进行后续研究)。
2.2 黄连解毒汤中活性成分相关靶点的预测
将“2.1”项下的“SDF”格式文件上传至SwissTargetPrediction数据库(http://www.swisstargetprediction.ch/)中,基于反向分子對接原理[12],进行靶点预测,获取黄连解毒汤活性成分的预测靶点。
2.3 巨噬细胞极化相关靶点的获取及黄连解毒汤活性成分-巨噬细胞极化靶点网络的构建
将“Macrophage polarization”作为检索词,通过Gene Cards(https://www.genecards.org/)、OMIM(https://omim.org/)数据库获取巨噬细胞极化的相关靶点;利用Microsoft Excel 2019软件将黄连解毒汤中活性成分的预测靶点与巨噬细胞极化相关靶点进行映射,获取黄连解毒汤作用于巨噬细胞极化的靶点;然后将黄连解毒汤的活性成分和上述靶点导入Cytoscape 3.6.0软件中,构建黄连解毒汤活性成分-巨噬细胞极化靶点网络图。
2.4 PPI网格构建和核心靶点筛选
将黄连解毒汤中活性成分的预测靶点导入String数据库(https://string-db.org/),设定物种为“Homo sapiens”,获取所有蛋白-蛋白相关作用(PPI)关系,再导入Cytoscape 3.6.0软件中,生成背景网络。在背景数据库选取“2.3”项下映射得到的黄连解毒汤作用于巨噬细胞极化的靶点,并找到与其直接相连的节点,生成黄连解毒汤活性成分调控巨噬细胞极化的PPI网络图。然后通过Cytoscape 3.6.0软件“Tools”模块中的“Network analyzer- network analysis-analyze network”选项进行网络分析,获取相关拓扑参数,以节点连接度(Degree)的2倍中位数以及节点介度(Betweenness)和节点紧密度(Closeness)的中位数作为筛选依据[13],提取出核心靶点。
2.5 GO富集分析与KEGG通路分析
利用Cytoscape 3.6.0软件中的“ClueGO”插件,选择“Biological Process(生物进程)”,对“2.4”项下所得的核心靶点进行基因本体(GO)富集分析,以P<0.05筛选显著富集的GO。通过DAVID网站(http://david.ncifcrf.gov/)对核心靶点进行京都基因与基因组百科全书(KEGG)通路分析,以P<0.01筛选显著富集的KEGG通路,并按照核心靶点相关的基因数进行排序,结合文献检索的方法,筛选出黄连解毒汤活性成分调控巨噬细胞极化的可能通路和该通路上的相关靶点;再结合黄连解毒汤的活性成分,构建“黄连解毒汤活性成分-巨噬细胞极化靶点-KEGG通路”网络图,并选取基因数排名前20位的通路,使用在线绘图OmicShare工具(http://www.omicshare.com/tools/)绘制通路气泡图。
2.6 细胞试验
基于KEGG通路分析结果,笔者选择腺苷酸活化蛋白激酶(AMPK)信号通路中的AMPK蛋白进行细胞试验,探讨黄连解毒汤是否通过作用于该通路调控巨噬细胞极化;同时,根据M1型巨噬细胞的极化因子有IL-1β、iNOS,M2型巨噬细胞极化因子有IL-10、Fizz1,故亦选择上述极化相关因子进行mRNA表达的检测,以探讨黄连解毒汤的抗炎作用机制研究。
2.6.1 黄连解毒汤的制备 取黄连9 g、黄芩6 g、黄柏6 g、栀子9 g,加水200 mL煎煮45 min,过滤,取续滤液加热浓缩至1 g/mL(以生药量计,下同),于4 ℃保存。药液于大鼠灌胃前0.5 h加热,备用。
2.6.2 黄连解毒汤含药血清的制备 取10只大鼠适应性喂养3天后,灌胃给予黄连解毒汤(10 g/kg,根据临床等效剂量换算而得),灌胃体积为1.5 mL,每天灌胃1次,连续1周。末次给药2 h后,于大鼠股动脉取血,室温静置4 h后,以3 000 r/min离心10 min,取上清液,即得黄连解毒汤含药血清,于-80 ℃保存,备用。
2.6.3 分组、造模及给药 将RAW264.7细胞接种于含10%胎牛血清的DMEM高糖培养基中,于37 ℃、5%CO2条件下(下同)培养48 h后,以1 000 r/min离心5 min,弃上清液,沉淀中加入PBS和RPMI 1640培养基适量,制成密度为1×106 个/mL的细胞悬液。将细胞悬液按100 μL/孔接种于96孔板中,并随机分为空白对照组、模型组、辛伐他汀组(10 μmol/L,剂量设置参考文献[14-15])和黄连解毒汤含药血清组,除空白对照组和模型组不加药液外(以等体积培养基代替),其余均加入相应药液或含药血清100 μL,于37 ℃、5%CO2条件下恒温培养2 h;然后除空白对照组外,其余各组均加入100 μg/L的LPS溶液(临用时用RPMI 1640培养基溶解配制),培养24 h以诱导炎症。每组设置6个复孔。
2.6.4 细胞中AMPK蛋白表达水平的检测 采用Wes- tern blot法进行检测。取“2.6.3”项下各组给药、建模后的细胞适量,加入蛋白裂解液裂解0.5 h后,于4 ℃条件下以12 000 r/min离心10 min,取上清液,采用BCA试剂盒测定蛋白浓度。将蛋白变性后,取50 μg行SDS- PAGE电泳,结束后转移至PVDF膜上,以5%脫脂奶粉室温封闭2 h;加入AMPK抗体(稀释度为1 ∶ 1 000)、GAPDH抗体(稀释度为1 ∶ 500)孵育过夜;以PBST溶液清洗3次,加入二抗(稀释度为1 ∶ 200),于37 ℃条件下孵育1 h;以PBST溶液清洗3次,经ECL化学发光试剂盒显色后,置于凝胶成像仪上成像。采用Image J v 1.5.1软件分析,以目的蛋白条带与内参GAPDH条带的灰度值比值表示AMPK蛋白的表达水平。上述试验重复6次。
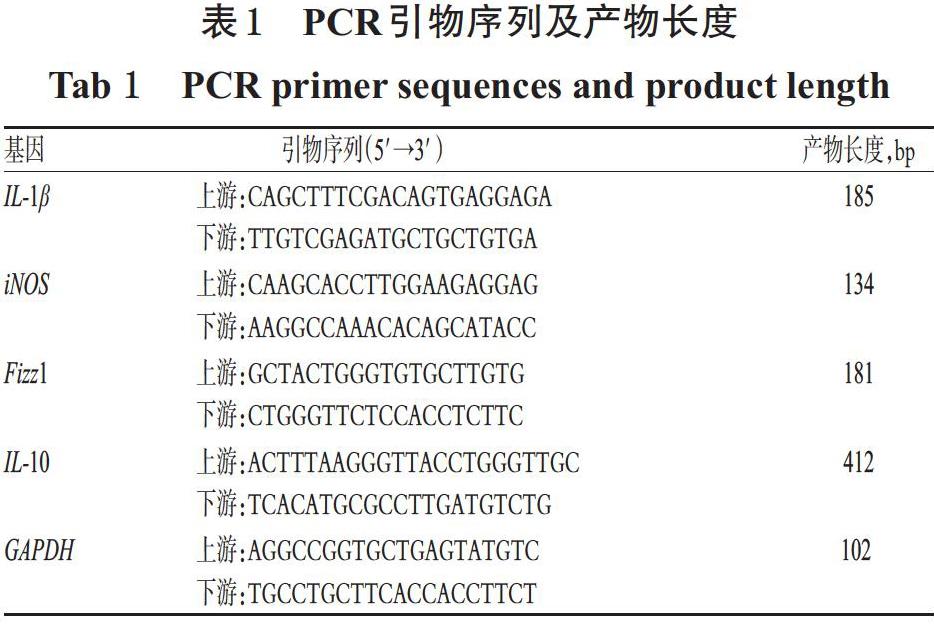
2.6.5 细胞中极化相关因子的mRNA表达水平检测 采用实时荧光定量PCR法进行检测。取“2.6.3”项下各组给药、建模后的细胞适量,根据相应试剂盒说明书方法操作,提取RNA,然后反转录成cDNA;再以cDNA为模板,进行实时荧光定量PCR反应(引物序列及产物长度见表1)。PCR反应体系(20 μL)包括:无核酸酶水7.2 μL,上下游引物各0.4 μL,染料10 μL,cDNA模板2 μL。PCR反应条件为:95 ℃预变性30 s;95 ℃变性5 s,55 ℃退火10 s,40个循环。以GAPDH为内参,按2-ΔΔCt法[15]计算目的基因mRNA的表达水平。上述试验重复6次。
2.6.6 统计学方法 采用SPSS 22.0软件对数据进行分析。符合正态分布的计量资料以x±s表示,采用单因素方差分析进行多组间比较,采用LSD-t检验进行组间两两比较;若数据不符合正态分布,则采用非参数检验进行组间比较。P<0.05表示差异有统计学意义。
3 结果
3.1 黄连解毒汤中活性成分的筛选结果
本研究共筛选得到黄连解毒汤活性成分共50个,其活性成分的基本信息见表2。
3.2 黄连解毒汤活性成分-巨噬细胞极化靶点网络筛选结果
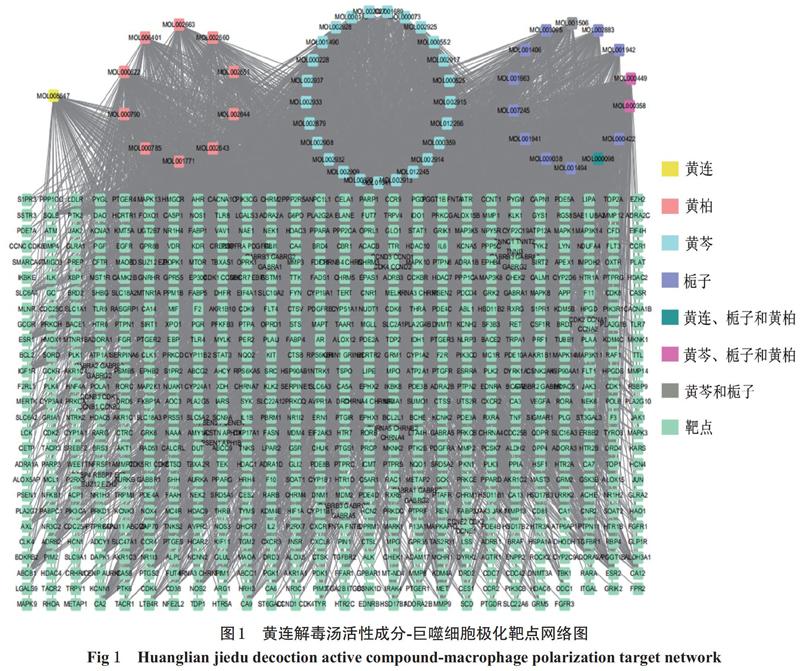
在SwissTargetPrediction数据库中共筛选得具有“Smile”号的活性成分共50个;依据活性成分的2D结构进行靶点预测,共筛选出700个预测靶点;经映射后,共筛选出黄连解毒汤可能调控巨噬细胞极化的相关靶点532个。在Cytoscape 3.6.0软件中导入黄连解毒汤的活性成分与巨噬细胞极化相关的靶点,构建出黄连解毒汤活性成分-巨噬细胞极化靶点网络图,详见图1。
3.3 PPI网络构建和核心靶点筛选结果
将黄连解毒汤可能调控巨噬细胞极化的532个相关靶点导入String数据库,形成PPI网络,详见图2。经筛选后,共得核心靶点12个,根据Degree值从小到大排序为AMPK、EGFR、PTGS2、APP、AR、MMP9、PIK3R、MCL1、ACHE、MPO、MAPT、NTRK2。
3.4 GO富集分析和KEGG通路分析結果
通过GO富集分析,共筛选得到GO条目12个,主要涉及失巢凋亡负调节、星形胶质细胞活化等,详见图3。通过KEGG通路分析,共筛选得到KEGG通路20条,主要涉及雌激素信号通路、膀胱癌通路、AMPK信号通路等,详见图4。
3.5 细胞试验结果
3.5.1 黄连解毒汤对细胞中AMPK蛋白表达的影响 与空白对照组比较,模型组细胞中AMPK蛋白的表达水平显著降低(P<0.01);与模型组比较,黄连解毒汤含药血清组和辛伐他汀组细胞中AMPK蛋白的表达水平均显著升高(P<0.05),详见图5、表3。
3.5.2 黄连解毒汤对极化相关因子的mRNA表达的影响 与空白对照组比较,模型组细胞中IL-1β、iNOS mRNA的表达水平均显著升高,Fizz1、IL-10 mRNA的表达水平均显著降低(P<0.01);与模型组比较,黄连解毒汤含药血清组和辛伐他汀组细胞的IL-1β、iNOS mRNA的表达水平均显著降低,Fizz1、IL-10 mRNA的表达水平均显著升高(P<0.01),详见表4。
4 讨论
本研究共筛选得到黄连解毒汤活性成分50种(包括刺槐黄素、汉黄芩素、槲皮素、β-谷甾醇等),核心靶点12个(包括AMPK、EGFR、PTGS2等);经GO富集分析和KEGG通路分析发现,黄连解毒汤调控巨噬细胞极化主要涉及失巢凋亡负调节、星形胶质细胞活化等12个GO条目,主要涉及雌激素信号通路、膀胱癌通路、AMPK信号通路等。其中,AMPK信号通路上核心靶点AMPK是细胞内的能量感受器,可保持细胞内的能量平衡[16];AMPK的活化能促使巨噬细胞从M1型极化为M2型[17-19]。另外,相关研究发现,雌激素也能显著促进巨噬细胞向M2型极化[20],与本研究通路分析结果一致。
iNOS作为M1型巨噬细胞主要的生物标志物,能够生成大量一氧化氮,从而诱导炎症的发生[3];IL-1β可激发其它炎症细胞因子的合成、分泌,协同导致组织损伤与血管内膜增生[21];IL-10作为M2型巨噬细胞主要的生物标志物,当其大量分泌时,可通过参与B细胞与T细胞的反应来调控免疫进程[22]。
本研究基于网络药理学研究结果,选择AMPK信号通路中的AMPK蛋白以及巨噬细胞极化相关因子mRNA,来探讨黄连解毒汤是否通过该通路调控巨噬细胞极化,并研究其抗炎作用机制。结果发现,黄连解毒汤可上调细胞中AMPK蛋白和Fizz1、IL-10 mRNA的表达水平,下调细胞中IL-1β、iNOS mRNA的表达水平。由此推测,黄连解毒汤可能通过AMPK通路调控巨噬细胞的极化,从而发挥抗炎作用。此研究结果与相关文献结果一致[23-24]。
综上所述,本研究预测了黄连解毒汤调控巨噬细胞极化的活性成分、靶点以及信号通路;经细胞试验初步验证黄连解毒汤可能通过AMPK通路上调M2型极化因子的表达、下调M1型极化因子的表达,从而调控巨噬细胞的极化,进而发挥抗炎作用。后续本课题组将进一步深入研究黄连解毒汤活性成分调控巨噬细胞极化的作用机制,以期为指导巨噬细胞极化相关疾病的临床治疗提供参考。
参考文献
[ 1 ] 吴秀华,郑文洁.巨噬细胞极化[J].中华临床免疫和变态反应杂志,2017,11(2):161-165.
[ 2 ] 陈方圆,袁祖贻,周娟,等.姜黄素促进 RAW264.7源性 M1型巨噬细胞向替代激活的 M2 表型极化[J].西安交通大学学报(医学版),2015,36(2):257-262.
[ 3 ] SCHULTZE JL,SCHMIDT SV,MOLECULAR.Features of macrophage activation[J]. Semin Immunol,2015,27(6):416-423.
[ 4 ] 阮静瑶,陈必成,张喜乐,等.巨噬细胞M1/M2极化的信号通路研究进展[J].免疫学杂志,2015,31(10):911-917.
[ 5 ] 周宪宾,姚成芳.巨噬细胞M1/M2极化分型的研究进展[J].中国免疫学杂志,2012,28(10):957-960.
[ 6 ] 王宸罡,齐新,王丽,等.简述黄连解毒汤的药理作用及临床应用[J].天津中医药大学学报,2018,37(5):433-436.
[ 7 ] 盛蒙,许滔,于红红,等.黄连解毒汤含药血清激活PPARγ诱导RAW264.7源性泡沫细胞向M2表型极化[J].中国免疫学杂志,2020,36(3):277-281、288.
[ 8 ] 张茹兰,黄秀芳,陶彦谷,等.黄连解毒汤对 Aβ25-35诱导的 HT22 细胞 NF-κB 活化及炎症因子水平的影响[J].中国实验方剂学杂志,2018,13(5):167-173.
[ 9 ] 李彤,韩俊燕,王蓓蓓,等.黄连解毒汤调控单核、巨噬细胞及泡沫细胞分化的实验研究[J].中国中西医结合杂志,2014,34(9):73-79.
[10] YU G,LUO Z,ZHOU Y,et al. Uncovering the pharmacological mechanism of Carthamus tinctorius L. on cardiovascular disease by a systems pharmacology approach[J].Biomed Pharmacother,2019. DOI:10.1016/j.biopha.2019. 109094.
[11] WANG W,LIU T,YANG L,et al. Study on the multi-targets mechanism of triphala on cardio-cerebral vascular di- seases based on network pharmacology[J]. Biomed Pharmacother,2019. DOI:10.1016/j.biopha.2019.108994.
[12] 范胜军,李学军.反向分子对接-药物靶点发现和确认的新途径[J].生理科学进展,2012,43(5):367-370.
[13] 詹群璋,黄英杰,林树红,等.基于网络药理学和分子对接的玉屏风散预防新型冠状病毒肺炎(COVID-19)活性化合物的研究[J].中草药,2020,51(7):1731-1740.
[14] 张选明,安冬青,张华,等.芳香新塔花总黄酮对脂多糖诱导的RAW264.7细胞分泌炎症因子的影响及机制[J].辽宁中医杂志,2020,47(2):158-161、221.
[15] 孙治中,江艳君,纪树亮,等.黄芩苷治疗小鼠AS模型的作用与机制[J].中国组织工程研究,2019,23(19):91-97.
[16] LI Y,CHEN Y. AMPK and Autophagy[J]. Adv Exp Med Biol,2019. DOI:10.1007/978-981-15-0602-4_4.
[17] WANG Y,VIOLLET B,TERKELTAUB R,et al. AMP-activated protein kinase suppresses urate crystal-induced inflammation and transduces colchicine effects in macrophages[J]. Ann Rheum Dis,2016,75(1):286-294.
[18] DAY EA,FORD RJ,STEINBERG GR. AMPK as a therapeutic target for treating metabolic diseases[J]. Trends Endocrinol Metab,2017,28(8):545-560.
[19] MOUNIER R,THERTET M,ARNOLD L,et al. AMPKα1 regulates macrophage skewing at the time of resolution of inflammation during skeletal muscle regeneration[J]. Cell Metab,2013,18(2):251-264.
[20] 刘黎,胡静平,岳艳.雌激素通过调节IRF4促进巨噬细胞向M2型极化[J].现代免疫学,2013,33(4):285-289.
[21] 唐澜,王丽,付度关,等.瘦素对巨噬细胞白细胞介素1β表达的影响[J].中国动脉硬化杂志,2006,14(9):747- 749.
[22] 黄小会,赵欣,董晓惠,等. IL-10参与调控巨噬细胞的极化[J].军事医学,2018,42(9):673-677.
[23] ZHANG L,ZHANG J,YOU Z. Switching of the microglial activation phenotype is a possible treatment for depression disorder[J]. Front Cell Neurosci,2018. DOI:10.3389/fncel.2018.00306.
[24] SUENAGA J,HU X,PU H,et al. White matter injury and microglia/macrophage polarization are strongly linked with age-related long-term deficits in neurological function after stroke[J]. Exp Neurol,2015. DOI:10.1016/j.expneurol.2015.03.021.
(收稿日期:2020-09-16 修回日期:2020-12-27)
(編辑:唐晓莲)

