饲料可消化蛋白和脂肪水平对吉富罗非鱼鱼种生长、物质代谢和抗氧化功能的影响*
王秋梅,李 英,张新党,陈路斯,林贝贝,李光彬,邓君明
(云南农业大学 动物科学技术学院,云南 昆明 650201)
蛋白质和脂肪是鱼类生长所必需的营养物质,对鱼类的生长发育有着重要的影响。蛋白质作为生命的物质基础,是鱼体组成成分,具有维持生命活动的作用[1]。脂肪既是动物的能量来源,也是参与机体免疫调节的重要营养物质[2]。饲料中蛋白质和脂肪含量不足[1,3-5]或过量[5-7]都会对养殖鱼类有负面影响。因此,研究水产动物饲料蛋白质和脂肪的适宜添加量对水产饲料开发和水产养殖至关重要。目前,学者对蛋白质研究主要集中在常规粗蛋白体系营养需求上,未考虑蛋白质的可消化利用效率,导致蛋白质营养需求不精准[8-11]。采用常规粗蛋白体系营养需求配制饲料,会导致饲料利用率不高,氮排放量较多,从而造成环境污染,这成为制约中国水产养殖业可持续发展的瓶颈。因此,在可消化模式下研究精准蛋白质营养需求是水产养殖业健康可持续发展的必经之路。
罗非鱼又称非洲鲫鱼,是以植物性为主的杂食性鱼类,具有很高的经济价值,是全世界水产业重点培养的淡水养殖鱼类[12]。吉富罗非鱼[genetic improvement of farmed tilapia (GIFT),Oreochromis niloticus]是由几种尼罗罗非鱼品系经过混合选育得到,具有许多优良性状[13],如生长发育快、出肉率高和遗传稳定等[14]。迄今为止,学者广泛研究其蛋白质和脂肪的营养需求[15-16],但未见饲料可消化蛋白(DCP)和脂肪(DL)水平对吉富罗非鱼影响的报道。研究表明:在鱼类正常生长的前提下,适当降低饲料的蛋白质含量并相应升高脂肪含量,不仅能降低饲料成本、提高蛋白质利用率,还能降低鱼体的氨氮排放量,减少污染[17]。本研究在可消化模式下,配制不同氮能比饲料,分析饲料DCP 和DL 水平对吉富罗非鱼鱼种生长性能、消化酶活性、物质代谢和抗氧化功能的影响,以期得出吉富罗非鱼鱼种对DCP和DL 的最适需要量,从而为配制科学经济的吉富罗非鱼鱼种配合饲料提供理论依据。
1 材料与方法
1.1 试验饲料配制
以鱼粉、豆粕、菜籽粕和棉籽粕作为蛋白源,鱼油和大豆卵磷脂作为脂肪源,配制成4 种不同DCP 水平(20%、22%、24%和26%)和3 种不同DL 水平(3%、5%和7%)组成的不同氮能比试验饲料,分别记为DCP20DL3、DCP20DL5、DCP20DL7、DCP22DL3、DCP22DL5、DCP22DL7、DCP24DL3、DCP24DL5、DCP24DL7、DCP26DL3、DCP26DL5 和DCP26DL7。试验饲料组成及其营养水平见表1。
配制饲料前,所有原料必须经过粉碎机(SFSP 系列,昆明华明粮油设备厂生产)粉碎,且全部过60 目筛。将所有粉碎好的饲料原料按配方混匀后加入鱼油和大豆卵磷脂(先溶于鱼油中),手工将油脂微小颗粒搓散、混匀,最后再加入适宜蒸馏水使粉状饲料成团,于颗粒饲料机(KS-180,江苏晶谷米机有限公司生产)中将饲料挤压成直径1.5 mm 的颗粒条状,用恒温烘箱在40 ℃恒温下干燥12 h,置于-20 ℃冰箱保存备用。
1.2 试验动物饲养管理
试验用吉富罗非鱼鱼种为当年人工培育的同一批苗种,由云南省西双版纳州水产技术推广站提供。试验开始前禁食24 h,选择大小均匀(初始平均体质量50 g)、体格健壮的罗非鱼鱼种900 尾,随机分为12 个组,每组3 个重复,每个重复25 尾鱼。试验期10 周,于云南农业大学动物科学技术学院水产养殖学实验室室内控温循环水池网箱(单个网箱体积0.375 m3,水池水体体积10 m3)中进行。试验前,试验鱼种暂养2 周适应环境。每天7:00 和17:00 各投饵1 次,达饱食水平。每次投喂结束后30 min,吸出残饵及粪便。养殖用水为曝气自来水,采用循环流水系统,循环系统采用机械和生物介质过滤,每个水池循环水量为6 L/min。养殖期间不间断充氧,自然光照,水温28~30 ℃。
1.3 样品采集
1.4 分析测定方法
鱼体和饲料常规成分分析均参考文献[18]的方法。其中,水分含量的测定采用105 ℃烘干恒重法(24 h);粗蛋白的测定采用凯氏定氮法(JK9830,济南精密科学仪器仪表有限公司);粗脂肪的测定采用索氏抽提法(以石油醚为溶剂);粗灰分的测定采用箱式电阻炉550 ℃灼烧法(16 h,箱式电阻炉SX-410,北京市永光明医疗仪器有限公司);总能的测定采用氧弹式能量仪(ZDHW-6,鹤壁市华泰仪器仪表有限公司)。
以下生化指标均采用南京建成生物工程研究所生产的试剂盒测定[19],按照使用说明书进行操作:肠道淀粉酶(AMS)、肠道和肝脏脂肪酶(LPS)以及胰蛋白酶(TPS);血浆总蛋白(TP)、谷草转氨酶(AST)、谷丙转氨酶(ALT)、尿素氮(BUN)、钙(Ca)和磷(P);血清总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C);血清超氧化物歧化酶(SOD)、总抗氧化能力(T-AOC)、丙二醛(MDA)、过氧化氢酶(CAT)和谷胱甘肽还原酶(GR);肝脏SOD、GR、过氧化物酶(POD)、谷胱甘肽过氧化物酶(GSH-Px)和MDA;低密度脂蛋白胆固醇(LDL-C)采用FRIEDEWALD 等[20]公式计算得到。此外,肝脏碳水化合物代谢指标己糖激酶(HK)、果糖-6-磷酸激酶(PFK)、丙酮酸激酶(PK)、果糖二磷酸酶(FBP)、磷酸烯醇式丙酮酸羧基酶(PEPCK)和葡萄糖-6-磷酸酶(G6P)采用苏州科铭生物技术有限公司提供的试剂盒进行测定;血浆谷氨酸脱氢酶(GDH)和腺苷单磷酸脱氨酶(AMPD)活性采用固相夹心酶联免疫吸附法(ELISA 试剂盒)测定,购自R&D 公司。

表1 吉富罗非鱼鱼种饲料配方及营养成分组成Tab.1 Test diets formulas and nutrients content of GIFT fingerlings
1.5 数据计算与分析
体增质量(WG)=(Wt-W0)/W0;
特定生长率(SGR,%/d)=(lnWt-lnW0)×100%/T;
饲料系数(FCR)=F/ (Wt-W0);
蛋白质效率(PER)=(Wt-W0)/ (F×CPf);
完善的中国商法体系并不能止于商事通则的制定,法典化的系统编纂是商法最高形态的形式理性,商事法律汇编仅是将我国的商事单行法模式过渡到商法典模式的中间路径,一旦我国通过商事法律汇编形成较为系统的商事法律框架体系,社会商业伦理秩序趋于稳定,我国仍然应当制定商法典。通过保障基本权利的民法典和规范商业秩序的商法典的相互作用,实现社会关系和经济活动的长远发展。
存活率(SR,%)=试验末网箱中鱼的尾数/放养鱼的尾数×100;
蛋白质沉积率(PDR,%)=(Wt×CPt-W0×CP0)/(W0×CP0)×100;
平均代谢体质量(MBW,kg)=[(W0/ 1 000)0.75+(Wt/1 000)0.75]/2;
总摄食率(FI,g/fish)=F/[(放养鱼的尾数+试验末网箱中鱼的尾数)/2];
摄食率[FR,g/(kg·d)(MBW)]=总摄食率/(平均代谢体质量×T)。
式中,W0为鱼体初质量,g;Wt为鱼体末质量,g;F为鱼摄食饲料干质量,g;CP0为试验初鱼体粗蛋白含量,%;CPt为试验终鱼体粗蛋白含量,%;CPf为饲料粗蛋白含量,%;T为饲养时间,d。
试验数据采用双因素方差分析(two-way ANOVA),若各处理组间存在显著差异(P<0.05)时,采用Duncan 氏法多重比较进行分析,试验结果以平均值±标准误(n=3)表示。所有统计分析均在SPSS 17.0 统计软件中进行。
2 结果与分析
2.1 饲料DCP 和DL 水平对吉富罗非鱼鱼种生长性能的影响
由表2 可知:各组罗非鱼鱼种成活率为96.67%~100%,各组间成活率差异不显著。DCP-22DL7 与DCP24DL7 组各生长参数最佳。随着饲料DCP 和DL 水平的提高,WG、SGR 和PER呈上升趋势,20% DCP 组WG 和SGR 显著低于其他蛋白处理组,PER 显著低于24% DCP 组;3% DL 组WG 和SGR 显著低于其他脂肪处理组,5%和7% DL 组WG 和SGR 无显著差异。随着饲料DCP 水平的提高,FCR 呈下降趋势,24%和26% DCP 组显著低于20%和22% DCP 组;PDR 则呈先上升后下降趋势,24% DCP 组最高。24%和26% DCP 组FR 显著低于20%和22% DCP 组。随着饲料DL 水平的提高,PDR 呈上升趋势,7% DL 组显著高于3% DL 组;FCR则呈下升趋势,7% DL 组显著低于3% DL 组。DCP 和DL 水平对PER、PDR 和SR 有显著交互效应。
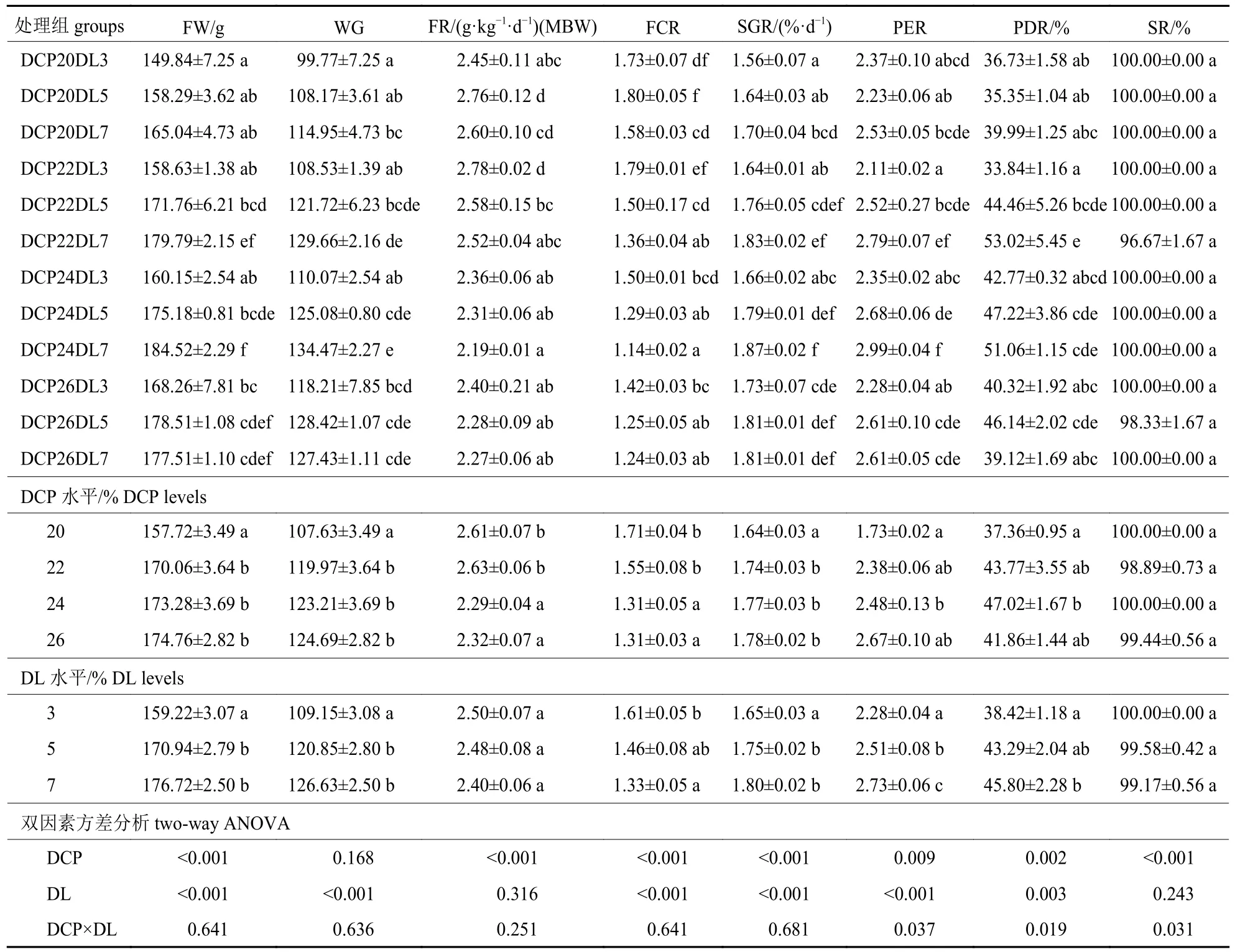
表2 饲料DCP 和DL 水平对吉富罗非鱼鱼种生长性能的影响Tab.2 Effects of DCP and DL levels on the growth performance of GIFT fingerlings
2.2 饲料DCP 和DL 水平对吉富罗非鱼鱼种胃、肠道及肝脏消化酶活性的影响
由表3 可知:DCP24DL5 组各消化酶参数最佳,DCP22DL7 组肠道AMS 和肝脏AMS、LPS活性最佳。22% DCP 组肝脏AMS 活性显著高于20%和24% DCP 组,肝脏LPS 活性则显著低于24% DCP 组。此外,各DCP 组间以及各DL 组间罗非鱼消化酶活性差异均不显著。随着饲料中脂肪水平的提高,肠道胰蛋白酶活性呈下降趋势,7% DL 组显著低于3% DL 组。DCP 和DL 水平对肠道LPS 和肝脏AMS 活性有显著交互效应。
2.3 饲料DCP 和DL 水平对吉富罗非鱼鱼种血浆蛋白质代谢相关指标的影响
由表4 可知:DCP20DL7 组和DCP22DL7 组各蛋白质代谢相关指标参数最佳。饲料DCP 水平对Ca、P、BUN 含量和ALT、GDH 活性无显著性影响。随着饲料DCP 水平的提高,TP 含量呈先上升后下降趋势,24% DCP 组最高;AST活性则呈下降趋势,20%和22% DCP 组显著高于26% DCP 组;AMPD 活性呈上升趋势,20%DCP 组显著低于26%和24% DCP 组。随着饲料DL 水平的提高,GDH 活性呈先上升后下降趋势,5% DL 组最高。饲料DL 水平仅对血浆GDH活性有显著影响。DCP 和DL 水平对TP 含量以及AMPD 和GDH 活性有显著交互效应。

表3 饲料DCP 和DL 水平对吉富罗非鱼鱼种胃、肠道及肝脏消化酶活性的影响Tab.3 Effects of DCP and DL levels on the digestive enzymes activities in stomach,intestine and liver of GIFT fingerlings

表4 饲料DCP 和DL 水平对吉富罗非鱼鱼种血浆蛋白质代谢相关指标的影响Tab.4 Effects of DCP and DL levels on the protein metabolism-related indexes in plasma of GIFT fingerlings
2.4 饲料DCP 和DL 水平对吉富罗非鱼鱼种血清脂肪代谢相关指标的影响
由表5 可知:DCP22DL3 组、DCP22DL7 组和DCP24DL5 组各脂肪代谢相关指标参数最佳。随着饲料DCP 的提高,TG 含量呈上升趋势,20%和22% DCP 组显著低于26% DCP 组;HDLC 含量则呈先上升后下降趋势,22% DCP 组最高;LDL-C 含量和LDL-C/HDL-C 呈先下降后上升趋势,22% DCP 组最低。随着饲料DL 水平的升高,TG 和HDL-C 含量呈现先上升后下降趋势,5% DL 组最高;LDL-C 含量和LDL-C/HDLC 则呈先下降后上升趋势,5% DL 组最低。饲料DCP 水平和DL 水平均对血清TC 含量无显著影响。DCP 和DL 水平对血清脂肪代谢相关指标无显著交互效应。
2.5 饲料DCP 和DL 水平对吉富罗非鱼鱼种血清、肝脏碳水化合物代谢相关指标的影响
由表6 可知:DCP22DL7 组和DCP24DL3 组糖酵解和糖异生途径相关酶活性均最强。饲料DCP 水平对血清GLU 以及肝脏PFK、HK 和FBP活性无显著影响。随着饲料DCP 的提高,肝脏PK 活性呈下降趋势,24%和26% DCP 组显著低于20%和22% DCP 组;肝脏G6P 活性则呈先上升后下降趋势,22% DCP 组最高。20% DCP 组PEPCK 活性显著低于其他蛋白处理组。饲料DL 水平对肝脏PK、HK、PEPCK、FBP 和G6P活性的影响均不显著。随着DL 水平的提高,血清GLU 含量呈先上升后下降趋势,5% DL 组最高;肝脏PFK 活性则呈先下降后上升趋势,5%DL 组最低。DCP 和DL 水平对肝脏G6P 活性有显著交互效应。

表5 饲料DCP 和DL 水平对吉富罗非鱼鱼种血清脂肪代谢相关指标的影响Tab.5 Effects of DCP and DL levels on the lipid metabolism-related indexes in serum of GIFT fingerlings
2.6 饲料DCP 和DL 水平对吉富罗非鱼鱼种血清、肝脏抗氧化指标的影响
由表7 可知:DCP22DL7 组血清SOD 和GR活性最佳。饲料DCP 水平对血清SOD 活性和MDA 含量无显著影响。随着DCP 水平的提高,血清T-AOC 呈上升趋势,26% DCP 组显著高于20% DCP 组;血清GR 活性则呈下降趋势,20%DCP 组显著高于26% DCP 组。20%和24% DCP组血清CAT 活性显著高于26% DCP 组。饲料DL 水平对血清T-AOC 和CAT 活性以及MDA含量无显著影响。随着DL 水平的提高,血清SOD 活性呈上升趋势,7% DL 组显著高于3%DL 组;血清GR 活性则呈先上升后下降趋势,3% DL 组显著低于5% DL 组。DCP 和DL 水平对血清抗氧化指标无显著交互效应。
由表8 可知:DCP22DL7 组肝脏各抗氧化能力指标参数最佳。各DCP 组间肝脏GR 和POD活性无显著差异。随着DCP 水平的提高,肝脏MAD 含量呈下降趋势,20% DCP 组显著高于24%和26% DCP 组。22% DCP 组SOD 活性显著高于24% DCP 组。22% DCP 组GSH-Px 活性显著高于20% DCP 组。各DL 组间肝脏SOD、GR、POD 和GSH-Px 活性以及MAD 含量无显著差异。DCP 和DL 水平对肝脏SOD、POD 活性和MAD 含量有显著交互效应。

表6 饲料DCP 和DL 水平对吉富罗非鱼鱼种血清、肝脏碳水化合物代谢相关指标的影响Tab.6 Effects of DCP and DL levels on the carbohydrate metabolism-related indexes in serum and liver of GIFT fingerlings
2.7 饲料DCP 和DL 水平对吉富罗非鱼鱼种肌肉常规成分的影响
由表9 可知:DCP22DL7 组各罗非鱼肌肉常规成分含量最佳。饲料DCP 水平对罗非鱼肌肉水分和粗灰分含量的影响不显著。随着DCP 水平的提高,罗非鱼肌肉粗蛋白含量呈先上升后下降趋势,24% DCP 组最高;肌肉能量和粗脂肪含量则呈下降趋势,20% DCP 组肌肉能量含量显著高于26% DCP 组,20%和22% DCP 组肌肉粗脂肪含量显著高于26% DCP 组。饲料DL 水平对罗非鱼肌肉粗蛋白、粗脂肪和粗灰分含量的影响不显著。随着饲料DL 水平的提高,罗非鱼肌肉水分含量呈下降趋势,3% DL 组显著高于7% DL组;肌肉能量则呈上升趋势,5%和7% DL 组显著高于3% DL 组。DCP 和DL 水平对罗非鱼鱼种肌肉常规成分含量无显著交互效应。
3 讨论
3.1 饲料DCP 和DL 水平对吉富罗非鱼鱼种生长性能的影响
蛋白质作为生物进行生命活动的物质基础,具有构成鱼体组成、促进鱼类生长发育和维持生命的作用,占据着饲料原料成本中最高的位置[1]。饲料中蛋白质的缺乏会造成鱼类生长缓慢和免疫力下降等[1,3];而蛋白质含量过高不仅会增加饲料成本,还会增加鱼类氮的排泄量,造成环境污染[5]。本试验中吉富罗非鱼鱼种WG 和SGR受饲料DCP 水平影响。随着饲料DCP 水平的提高,WG 和SGR 呈上升趋势;其中,20% DCP组显著低于其他蛋白处理组,而22%、24%和26% DCP 组间无明显差异,即22% DCP 满足了罗非鱼蛋白质需要。许多研究表明:随着饲料蛋白质水平的提高,PER 呈下降趋势[21-23]。本试验与此不同,随着DCP 水平的提高,PER 呈现上升趋势;其中,24% DCP 组显著高于20% DCP组,但与22%和26% DCP 组无显著性差异。可见,在一定范围内增加DCP 水平有利于鱼类生长,提高饲料利用率;但超出一定范围,提高DCP 的促生长效果不明显[24-26]。由此可知,罗非鱼鱼种适宜DCP 水平为22%,低于前人研究结果[8-10],这可能与养殖环境、饲料脂肪源、饲料能量和氮能比以及生长发育阶段不同有关。

表7 饲料DCP 和DL 水平对吉富罗非鱼鱼种血清抗氧化指标的影响Tab.7 Effects of DCP and DL levels on the antioxidant indexes in serum of GIFT fingerlings
脂肪作为主要的能源物质,具有为鱼类提供能量与脂肪酸和促进脂溶性的功能,同时也是脂溶性维生素的载体[27]。饲料脂肪水平过低时,会造成作为能源物质的蛋白质消耗过多,鱼体对必需脂肪酸的需求得不到满足,可能导致代谢紊乱和生长性能降低。脂肪水平过高时,不仅不利于饲料的制粒和保存,还会造成鱼体脂肪的过度沉积,影响鱼肉的品质,并引发多种营养性疾病。由本研究可知:饲料DL 水平显著影响吉富罗非鱼鱼种WG 和SGR。随着DL 水平的提高,WG 和SGR 呈上升趋势;其中,3% DL 组显著低于其他脂肪处理组,而5%和7% DL 组WG和SGR 无显著差异。PDR 随着DL 水平的提高而呈上升趋势,饵料系数的变化趋势则与此相反。可见,当饲料DL 水平由3%上升到7%时,体现出脂肪节约蛋白质效应,这与其他鱼类的研究[5,28]类似。根据以上分析,可以得出罗非鱼鱼种适宜DL 水平约为7%,这一结果与前人的研究[11]基本相似。

表8 饲料DCP 和DL 水平对吉富罗非鱼鱼种肝脏抗氧化指标的影响Tab.8 Effects of DCP and DL levels on the antioxidant indexes in liver of GIFT fingerlings
DCP 和DL 间的交互作用显著影响PER,对其进行单因素方差分析可知:DCP24DL7 组与DCP22DL7 组的PER 最高,考虑到蛋白质节约效应,对吉富罗非鱼鱼种生长的适宜处理组为DCP-22DL7 组。
3.2 饲料DCP 和DL 水平对吉富罗非鱼鱼种消化酶活性的影响
鱼类由于其特殊的生理结构,对食物的机械消化能力较弱,故消化酶对鱼类营养物质消化和吸收能力起关键作用,其活性高低决定机体对营养物质的消化吸收能力,消化酶活性升高对营养物质的消化和吸收是有利的[29]。ANANICHEV[30]和COWEY 等[31]发现:鱼类的饲料营养条件会影响消化酶活性,从而影响消化能力。本试验中,饲料DCP 和DL 水平对胃蛋白酶活性没有显著影响,而肝脏AMS 和LPS 活性随DCP 水平的提高呈先升高后下降趋势,转折点出现在22%或24% DCP 水平,说明在一定范围内,饲料DCP 水平的增加,肝脏AMS 和LPS 与底物接触的面积增加,提高了活性[32],进而提高了罗非鱼的消化能力,有助于其对营养物质的吸收消化,这与对建鲤(Cyprinus carpiovar.jian)[33]和翘嘴红鲌(Erythroculter ilishaeformis bleeker)[34]的研究结果一致。吉富罗非鱼鱼种胰蛋白酶随饲料DL 水平的升高而降低,相同的结果见于对七彩神仙鱼(Symphysodon aequifasciata)[35]、胭脂鱼(Myxocyprinus asiaticus)[36]和塞内加尔鳎(Solea senegalensis)[37]的研究,说明DL 水平对罗非鱼鱼种肠道蛋白酶活性有抑制作用。

表9 饲料DCP 和DL 水平对吉富罗非鱼鱼种肌肉常规成分的影响Tab.9 Effects of DCP and DL levels on the body composition of muscle of GIFT tilapia fingerlings
DCP 和DL 间的交互作用显著影响肠道LPS和肝脏AMS 活性;其中,肠道AMS 活性DCP24-DL3 组最高,肝脏AMS 活性DCP22DL7 组最高。考虑到蛋白质节约效应,对吉富罗非鱼鱼种消化酶活性的适宜处理组为DCP22DL7 组。
3.3 饲料DCP 和DL 水平对吉富罗非鱼鱼种蛋白质代谢的影响
饲料中的蛋白质通过摄食进入鱼体后,可以进入肝脏进行分解代谢,AST 和ALT 是催化氨基酸氧化分解过程的活性酶。所以,正常情况下转氨酶主要存在于肝脏细胞中,而在组织和血液的含量很低。当肝脏组织病变或受到损害时,导致肝细胞坏死或者生物膜通透性增加,肝细胞内的转氨酶释放到组织和血液中,引起血液或肝脏组织中转氨酶活性增强或持续变化[38]。本试验中,饲料DCP 水平对血浆ALT 水平无显著差异。血浆AST 活性随着饲料DCP 水平的提高呈现下降趋势,说明饲料DCP 水平在20%~26%范围内不会影响血浆蛋白质代谢,对大黄鱼(Pseudosciaena croceaR.)[39]和红鳍东方鲀(Takifugu rubripes)[40]的研究也得到相似的结果。DCP 水平超过24%后,TP 含量下降;但随着DL 水平的提高,GDH 呈先升高后下降趋势。GDH 是一种含锌的线粒体酶,通过催化体内的氨基酸氧化脱氨基作用参与蛋白质的分解,主要分布于肝脏、心肌和肾细胞线粒体的基质和内膜,而以肝脏组织活性最高,故肝细胞损伤时,血液GDH 含量才升高[41]。因此,过低的饲料DCP 和DL 水平会对肝脏有所损害。AMPD 活性随饲料DCP 水平的提高呈升高趋势。AMPD 是动物肝、肾、肌肉和脑等组织中参与嘌呤核苷酸循环和能量代谢的重要酶类[42]。因此,在一定范围内,随着饲料DCP水平的提高,会促进对体内蛋白质的分解代谢。
3.4 饲料DCP 和DL 水平对吉富罗非鱼鱼种脂肪代谢的影响
血液生化指标的变化可以反映出鱼类的健康状况、营养状况以及机体的代谢机制[43]。LDLC 和HDL-C 是脂肪在血液中转运的主要形式,TC 在血液中与脂蛋白结合成HDL-C 并转运到肝脏中分解,减少TC 在血管壁的沉积,而LDLC 过量易引发动脉硬化[44]。因此,LDL-C/HDLC 反映了胆固醇的转运,是判断患动脉粥样硬化的指标。本试验中,TG 含量随着饲料DCP 和DL 水平的提高呈上升趋势,这与王爱民等[43]的研究相似。但TC 水平无显著变化,可能是因为饲料DL 水平在3%~7%范围内,并未对吉富罗非鱼鱼种的脂质代谢造成影响,这与黄金凤等[45]的研究一致。随着饲料DCP 和DL 含量的升高,HDL-C 含量呈现先上升后下降趋势,而LDLC 含量和LDL-C/HDL-C 均呈先降低后升高的趋势,说明DCP 与DL 水平超出一定范围后,可能会引发吉富罗非鱼鱼种动脉硬化,这与叶坤等[46]的研究一致。
3.5 饲料DCP 和DL 水平对吉富罗非鱼鱼种碳水化合物代谢的影响
鱼类碳水化合物代谢包括3 个重要途径:糖酵解、糖异生和三羧酸循环,它们在维持体内血糖的动态平衡有重要作用[47]。其中,糖酵解途径是指葡萄糖在分解后供能的过程,而糖异生途径则是由非糖物质转化为葡萄糖或糖原的过程。本试验中,随着饲料DCP 水平的提高,肝脏PEPCK 活性呈上升趋势,而G6P 活性呈现出先升高后下降趋势。肝脏PEPCK 和G6P 是糖异生过程的关键限速酶,说明糖异生过程随着DCP 水平的提高而增强,这与对斜带石斑鱼(Epinephelus coioides)的研究结果[48]类似。饲料DL 水平显著影响肝脏PK 活性和血清GLU 水平,PK 活性随饲料DL 水平的提高而呈下降趋势,而血清GLU水平则呈先升高后下降趋势,7% DL 水平可有效降低罗非鱼鱼种血清GLU 浓度。PK 是糖酵解过程的关键限速酶,这说明超出一定范围的DL 水平会抑制鱼类糖酵解过程,即抑制碳水化合物分解供能,这与对大黄鱼[49]的研究不一致,可能是试验鱼种类、阶段和脂肪水平等不同造成的。
DCP 和DL 的交互作用显著影响肝脏G6P 活性,DCP22DL7 组最高,故对吉富罗非鱼鱼种碳水化合物代谢的适宜处理组为DCP22DL7 组。
3.6 饲料DCP 和DL 水平对吉富罗非鱼鱼种抗氧化功能的影响
动物机体抗氧化能力的强弱与其健康程度密切相关,体内抗氧化能力降低会导致机体各种疾病的产生。鱼类正常的新陈代谢过程会不断产生自由基,但是机体同时也存在清除自由基的防御系统。清除自由基的一些物质主要有SOD、CAT 和GR 等,这些酶在机体内及时清除体内自由基,起到保护机体的作用[50]。在本试验中,饲料DCP 水平显著影响血清T-AOC 以及CAT 和GR活性,血清T-AOC 随DCP 水平的提高而呈上升趋势,CAT 活性在一定范围内增强,GR 活性则呈下降趋势。综合来说,DCP 水平在一定范围有利于鱼体健康,这与孙金辉等[51]的研究一致。饲料DL 水平显著影响吉富罗非鱼鱼种血清SOD和GR 活性,随饲料DL 水平的提高,两者呈上升趋势,说明3%~7% DL 水平并未降低成鱼血清抗氧化能力。以此同时,饲料DCP 水平也影响吉富罗非鱼肝脏抗氧化能力,随DCP 水平的升高,成鱼肝脏SOD 和GSH-Px 活性均呈先升高后下降趋势。MDA 作为过氧化脂质经降解后得到的产物,对细胞组织有损害作用,其含量反应机体细胞遭受自由基攻击的程度[52]。随饲料DCP 水平的提高,肝脏MDA 含量呈下降趋势,其中20% DCP 组最高。可能是因为过低的饲料DCP 水平对鱼体健康有所影响,这与张晨捷等[53]对云纹石斑鱼(Epinehelus moara)的研究结果相一致。
DCP 和DL 间的交互作用显著影响肝脏SOD和POD 活性以及MAD 含量;其中,肝脏SOD和POD 活性以DCP22DL7 组最高,肝脏MAD含量以DCP22DL7 组最低。因此,吉富罗非鱼鱼种抗氧化功能的适宜处理组为DCP22DL7 组。
4 结论
DCP22DL7 组各项生长性能、物质能量代谢和抗氧化功能指标最佳,即吉富罗非鱼鱼种适宜DCP 水平为22%,DL 水平为7%,最适氮能比为13.08 mg/kJ。

