儿茶素对野油菜黄单胞菌的抑菌作用*
李 峰,邓江丽,陈雯雯,余永红,毛雅慧
(1.湖北工程学院 生命科学技术学院,特色果蔬质量安全控制湖北省重点实验室,湖北 孝感 432000;2.广东食品药品职业学院,广东 广州 510520)
野油菜黄单胞菌野油菜致病变种(Xanthomonas campestrispv.campestris,Xcc)又称甘蓝黑腐病菌,属于变形菌纲γ-亚纲黄单胞菌科(Xanthomonadaceae)黄单胞杆菌属(Xanthomonas)[1],为革兰氏阴性细菌。Xcc几乎能侵染所有十字花科植物,引起黑腐病,该病害在全球广泛分布,在中国各地均有发生,其中以甘蓝、花椰菜[2]和萝卜发病最为普遍。近年来,随着中国菜田复种指数的普遍提高,细菌性黑腐病的发病程度和发病率呈现上升趋势,严重危害中国十字花科蔬菜的生产,造成巨大的经济损失[3-4]。Xcc侵染寄主植物是一个复杂的、动态的多因子相互作用过程,在这一过程中,Xcc会产生多种致病因子,如毒素、菌黄素、胞外多糖和降解植物细胞的胞外酶等[5]。经过多年的研究,人们对Xcc发病规律和致病机理虽有一定的了解,但是目前防治Xcc侵染的主要措施依然是化学防治和抗性品种利用。化学防治带来的农药残留、环境污染和食品安全等问题严重影响农业可持续发展。同时,由于病原菌在环境压力下极易发生自发突变,使得抗性品种的推广速度远远低于病原菌变异的速度,造成抗性品种的应用只是暂时和局部的。因此,为了满足中国农业可持续性发展,迫切需要研发绿色环保的新型防控药剂与防治方法。
儿茶素(catechin)又称茶单宁、儿茶酚,是茶叶中黄烷醇类物质的总称,是茶叶多酚类(tea polyphenols,TPs)物质中的主要成分,约占茶多酚含量的75%~80%,也是茶叶苦涩味的重要来源之一[6]。茶多酚具有广谱抗菌性,对革兰氏阳性和革兰氏阴性菌均有抑制作用[7-8]。曹进[9]通过研究儿茶素对引起龋齿的变异链球菌的影响,表明其对痢疾杆菌等致病菌都有不同程度的抑菌效果。此外,酯型儿茶素(ester type catechins,EGCG)不仅可以有效抑制龋齿致病菌的生长繁殖甚至杀死致病菌,并且对牙周炎有良好的治疗作用[10]。为了解决化学防腐剂在食品储藏过程中存在的安全隐患问题,儿茶素及其衍生物被广泛用于食品防腐包装中[11],其主要对肉制品中常见的致病菌金黄色葡萄球菌、大肠杆菌[12]和沙门氏菌有抑制作用[13];引起水产品腐败变质的主要细菌是假单胞类腐败菌,研究者发现茶多酚有利于海产品的保鲜,同时也不会对食品本身造成污染[14]。另外,茶多酚还可以抑制痢疾志贺氏菌、单增李斯特菌[15]和荧光假单胞菌[16]等多种细菌[17]。ZHANG等[18]用加工废料生产出超细绿茶粉,鉴定了其化学成分,并探索了其对茄科劳尔氏菌(引起茄科植物青枯病)的抗菌潜力。然而,目前茶多酚的抑菌研究多集中在人畜病原菌及相关疾病的治疗方面,关于其对植物致病菌抑制效果的研究甚少,尚未将其应用到农业病害防治领域。随着人类生活水平的不断提高,对食品安全问题也愈发重视,因此,不论将儿茶素开发成为食品保鲜剂还是代替化学农药的天然抑菌剂,都具有环境友好、天然健康、对人畜无毒无害的优点,并能极大满足人们对物质生活的追求,而儿茶素是否对植物病害具有良好防治效果,并最终成为农药替代品还需要更多的基础研究提供理论支撑。
本研究是茶多酚类物质对植物病原菌抑制作用的初探。研究确定从大叶红茶中提取纯化的儿茶素对野油菜黄单胞菌野油菜致病变种的抑制效果,测定适宜质量浓度下,儿茶素对Xcc致病因子(包括生物膜形成、胞外酶的分泌和运动性)的影响,并检测儿茶素对萝卜黑腐病的防治效果,旨在丰富儿茶素的抗菌谱,拓展其应用领域,为人工合成与开发新型环保药剂提供化学模型,以期达到以绿色防控技术防治黑腐病的目的。
1 材料与方法
1.1 试验材料
1.1.1 供试材料
供试菌种:野油菜黄单胞菌野油菜致病变种(Xanthomonas campestrispv.campestris,Xcc)Xcc-8004,保藏于湖北工程学院特色果蔬质量安全控制湖北省重点实验室。
供试植物:萝卜(Raphanus sativusL.),购于当地菜市场。
1.1.2 培养基
NYG 培养基(g/L):蛋白胨5 g,酵母粉3 g,甘油20 g,琼脂15.0 g,pH 7.0;胞外蛋白酶检测培养基:NYG 中含0.01 g/mL 的脱脂奶粉;胞外淀粉酶检测培养基:NYG 中含0.001 g/mL 的可溶性淀粉;胞外纤维素酶检测培养基:NYG 中含有0.005 g/mL 的羧甲基纤维素(CMC);运动性检测培养基(swarming 平板):NYG 中含0.5%琼脂。
1.1.3 试验试剂
试验选用从大叶红茶中提取的儿茶素,纯度≥98%,由国家植物功能成分利用工程技术研究中心惠赠;100 μg/mL 利福平(Rif)用于培养野油菜黄单胞菌;其他化学试剂均为分析纯。
1.2 方法
1.2.1 儿茶素抑菌作用测定
利用滤纸片法检测大叶儿茶素对Xcc8004 的抑菌效果。将儿茶素溶解于无菌水中,经0.22 μm微孔滤膜过滤除菌,配制成质量浓度为30 mg/mL的母液备用。准备好Xcc菌悬液(约1×108CFU/mL),用无菌棉签蘸取菌液均匀涂布于NYG 固体平板上,将已灭菌并干燥好的直径为5 mm 圆形滤纸片放置于涂布有菌液的培养基表面,再取儿茶素母液3 μL 滴加于滤纸片上,同时以无菌水做对照,将平板晾干后置于28 ℃培养箱培养2 d,观察结果并记录。试验设置3 个重复。
1.2.2 最小抑菌质量浓度(MIC)和最低杀菌质量浓度(MBC)的测定
接种Xcc于NYG 液体培养基中,28 ℃震荡培养至平台期(OD600为1.2),再取10 μL 菌液接种至新鲜的NYG 液体培养基中,并加入不同质量浓度的儿茶素溶液,使其终质量浓度分别为:5、10、15、20、30、40、50、60、70、80、90、100 和110 μg/mL,以无菌水作阴性对照。28 ℃震荡培养2 d 后,再分别将上述菌液进行10 倍稀释至10-8,取500 μL 滴加入到空培养皿中,再倾注适量约50 ℃溶解状态的固体NYG培养基,轻轻摇匀使培养基和菌液混合均匀,静置待培养基凝固,28 ℃培养2 d,分别计数平板中细菌总数,再换算为每1 mL 菌液中细菌数;MIC 即为儿茶素能够抑制Xcc生长的最低质量浓度值,培养基上无细菌生长的最低质量浓度为其MBC。每个试验设置3 个重复。
1.2.3 生物膜形成能力检测
用结晶紫染色法检测儿茶素对Xcc生物膜形成的影响。接种Xcc于5 mL NYG 液体培养基中,28 ℃震荡培养至对数期,离心收集菌体,用1 mL NYG 培养基重悬菌体,获得1×106CFU/mL的菌悬液,将此菌悬液接种至装有4 mL NYG 培养基的玻璃指形管中,并加入终质量浓度为15 μg/mL 的儿茶素,无菌水作为阴性对照,置于28 ℃培养箱中静置培养5 d 后,倒掉培养液,无菌水洗管壁3 次,烘干后加入6 mL 1%的结晶紫染色30 min。倒掉染色液,用无菌水冲洗管壁,烘干指形管,观察管壁上是否有1 圈紫色物质,拍照记录;用1 mL 无水乙醇溶解管壁结晶紫,测定630 nm 处吸收值并记录。试验设置3 个重复。
1.2.4 胞外酶分泌能力的检测
本研究采用平板检测法分别检测了儿茶素对Xcc分泌胞外蛋白酶、胞外淀粉酶及胞外纤维素酶能力的影响。
(1)胞外蛋白酶。接种Xcc于NYG 液体培养基中,28 ℃震荡培养至平台期,用移液器分别吸取2 μL 菌液接种于含0.01 g/mL 脱脂奶粉和终质量浓度为15 μg/mL 的儿茶素的NYG 平板上,无菌水作为阴性对照,静止10 min。28 ℃培养2 d,通过比较菌落周围水解透明圈的有无或大小判断菌株产胞外蛋白酶的活性。试验设置3 个重复。
(2)胞外淀粉酶。接种Xcc于NYG 液体培养基中,28 ℃震荡培养至平台期,用移液器分别吸取2 μL 菌液接种于含0.001 g/mL 可溶性淀粉和终质量浓度为15 μg/mL 的儿茶素的NYG 平板上,无菌水作为阴性对照,静止10 min。28 ℃培养2 d 后,用体积比为1∶100 的I2/KI (0.08 mol/L I2,3.2 mol/L KI)溶液染色10 min,然后用70%的酒精洗平板,能产生胞外淀粉酶的菌株其菌落生长处及周围可形成无色透明圈,观察并测量透明圈的大小。试验设置3 个重复。
(3)胞外纤维素酶。接种Xcc于NYG 液体培养基中,28 ℃震荡培养至平台期,用移液器吸取2 μL 菌液接种于含有0.005 g/mL 的羧甲基纤维素(CMC)和终质量浓度为15 μg/mL 的儿茶素的NYG 平板上,无菌水作为阴性对照,静置10 min。28 ℃培养2 d 后,在平板上加入约20 mL 0.1%的刚果红染色30 min,水洗2 次,再用20 mL 1 mol/L 的NaCl 脱色2 次,每次约20 min,能产生纤维素酶的菌株其菌落生长处及周围形成一透明圈,观察并测量透明圈的大小。试验设置3 个重复。
试验中测得的透明圈的直径大小代表不同胞外酶活性或产量的高低,由此来比较菌株在不同环境下所产胞外酶的差异。
1.2.5 运动性检测
接种Xcc于NYG 液体培养基中,28 ℃震荡培养至平台期,用移液器吸取2 μL 菌液点接于含有0.5%琼脂和终质量浓度为15 μg/mL 的儿茶素的半固体培养基平板上(平板使用前在超净台晾5~10 min),无菌水作为阴性对照,正置于超净台中待晾干,转置28 ℃培养箱正置培养2 d,观察菌苔的扩散情况并测量菌苔直径。试验设置3 个重复。
1.2.6 儿茶素对萝卜黑腐病的防治试验
试验参照文献[19]进行,具体步骤如下:接种Xcc于NYG 液体培养基中,28 ℃震荡培养至平台期备用;将新鲜白萝卜先用自来水清洗干净,晾干后再用75%的酒精涂抹在萝卜表面进行消毒,将萝卜放置在超净工作台晾干,重复消毒3 次;再用消毒的刀具将萝卜切成厚约5 mm 的薄片,分别放置在9 cm 无菌培养皿中。设置3 组试验,每组6 块萝卜切片,向其中2 组萝卜切片上分别滴加100 μLXcc菌液,菌液会自动扩散,另一组为对照组不滴加菌液;稍微晾干后,将1 组滴加菌液的萝卜片上涂抹100 μg/mL(MBC)的儿茶素溶液,另一组涂抹无菌水,对照组涂抹100 μg/mL 儿茶素溶液,放置于28 ℃培养箱中培养12 h 后再分别涂抹1 次儿茶素溶液或无菌水,12 h 后再重复1 次,总共培养时间为2 d,2 d 后取出观察并记录试验结果。
1.2.7 数据处理方法
采用Excel 2010 进行数据处理,并采用t检验进行显著性分析。
2 结果与分析
2.1 儿茶素对Xcc 的抑菌活性分析
由图1a 可知:在滴加有儿茶素的滤纸片周围形成了明显透明圈,而滴加有无菌水的对照组滤纸片周围无透明圈,说明儿茶素能有效抑制Xcc的生长。随后采用浓度梯度稀释法测定儿茶素对Xcc的最低抑菌质量浓度(MIC)及最低杀菌质量浓度(MBC),结果(图1b)表明:儿茶素质量浓度在20 μg/mL 时能够显著抑制Xcc的生长(P<0.05);因此,儿茶素对Xcc的最低抑菌质量浓度(MIC)为20 μg/mL。随着儿茶素质量浓度的升高,抑制活性越强,当儿茶素质量浓度达到100 μg/mL 时,能够完全抑制Xcc的生长,即最低杀菌质量浓度(MBC)为100 μg/mL。在亚抑菌质量浓度(5、10 和15 μg/mL)下,儿茶素均不能显著抑制Xcc的生长(P>0.05)。
2.2 儿茶素对Xcc 生物被膜形成的影响
由图2a 可知:在15 μg/mL 儿茶素作用下,指性管壁上几乎没有紫色圈的形成,而阴性对照组的管壁上有非常明显的紫色圈。用无水乙醇溶解管壁结晶紫,比较试验组与对照组生物被膜的形成量,发现添加15 μg/mL 儿茶素情况下,Xcc形成生物被膜量仅为对照组的16%左右(图2b),表明在亚抑菌质量浓度下,儿茶素能够极显著抑制Xcc生物被膜的形成 (P<0.001)。

图1 儿茶素对Xcc 的抑菌活性检测Fig.1 Detection of the antibacterial activity of catechin against Xcc
2.3 儿茶素对Xcc 分泌胞外酶的影响
研究结果显示:添加15 μg/mL 儿茶素时,仅能够极显著抑制Xcc的蛋白酶的分泌(图3),此时Xcc所产胞外蛋白酶的量仅为对照组的18%,而对淀粉酶(图4)和纤维素酶(图5)的分泌均无影响。
2.4 儿茶素对Xcc 运动性的影响
由图6 可知:在15 μg/mL 儿茶素作用后,Xcc运动能力减弱,与对照组相比,运动直径从1.2 cm 降至0.8 cm,为对照组的73%,表明儿茶素对Xcc的运动性有极显著的抑制效果。
2.5 儿茶素对萝卜黑腐病的防治效果检测
接种黑腐病病原菌Xcc8 004 后,未使用儿茶素、仅添加无菌水的对照组的萝卜切片从心部开始发生腐烂,病害严重(图7a);涂抹了质量浓度为100 μg/mL 儿茶素的萝卜切片仅有轻微腐黑(图7b);在添加了儿茶素不接种病原菌的自然条件下,萝卜切片保存完好,未感染黑腐病(图7c)。以上结果表明儿茶素对Xcc具有较强的抑制作用,能有效防治萝卜黑腐病的发生。

图2 儿茶素对Xcc 生物被膜形成的影响Fig.2 Effect of catechin on Xcc biofilm formation
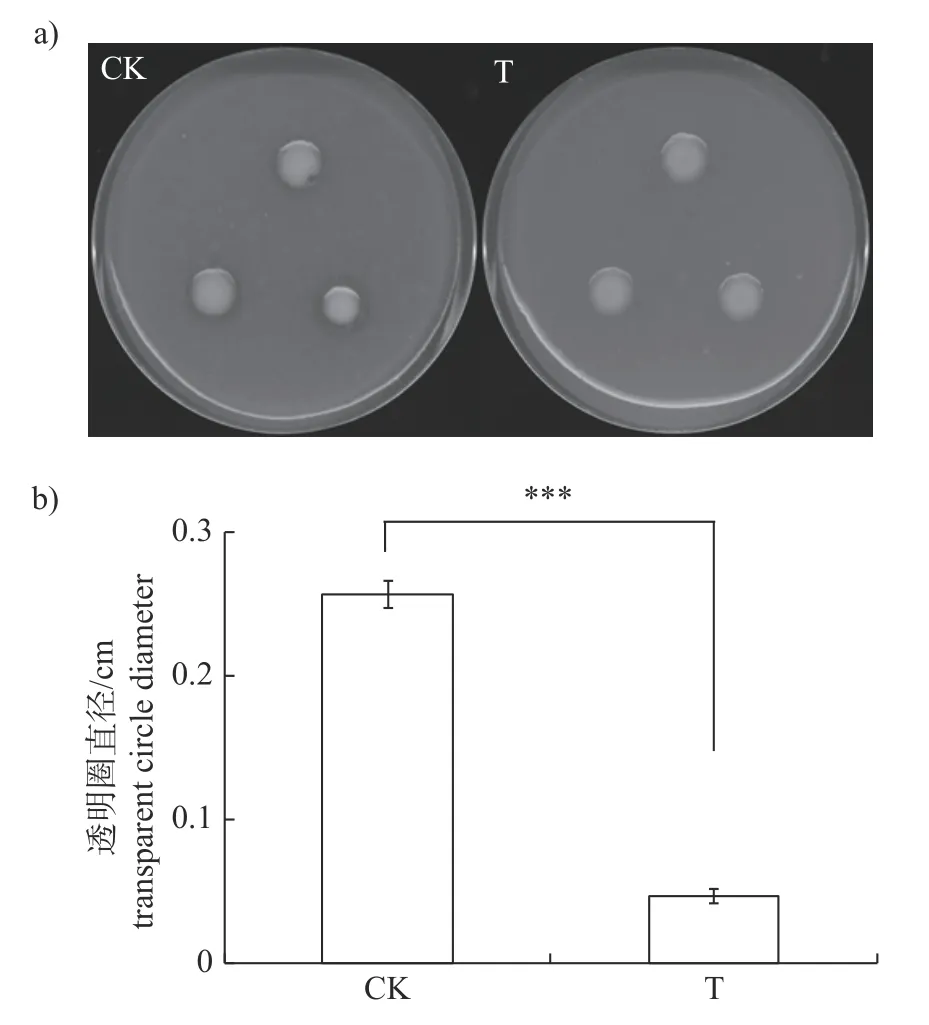
图3 儿茶素对Xcc 分泌胞外蛋白酶的影响Fig.3 Effect of catechin on extracellular protease secreted by Xcc

图4 儿茶素对Xcc 分泌胞外淀粉酶的影响Fig.4 Effect of catechin on extracellular amylase secreted by Xcc
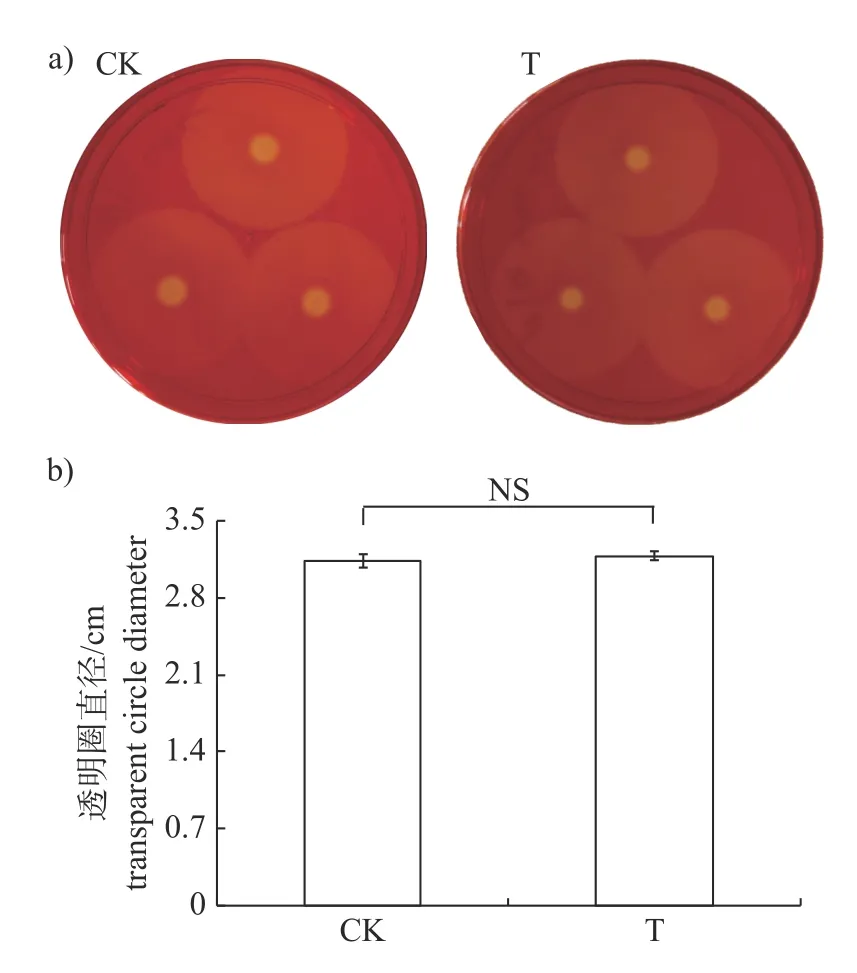
图5 儿茶素对Xcc 分泌胞外纤维素酶的影响Fig.5 Effect of catechin on extracellular cellulase secreted by Xcc
3 讨论

图6 儿茶素对Xcc 运动性的影响Fig.6 Effect of catechin on Xcc motility
国内外针对野油菜黄单胞菌野油菜致病变种的致病机理的研究较多,如对其毒力基因功能进行深入研究,揭示这些基因在致病性中的作用等,但是目前仍未找到有效的黑腐病治疗方法与药剂。现有的防控措施如化学防治使用的是传统农药及抗生素类,存在环境污染和引起病菌抗性等诸多隐患,抑制该病原菌的天然抑菌剂还未见报道,尚未被开发。有研究报道壳聚糖能抑制黄单胞菌属细菌[20-21],但壳聚糖的抑菌作用是否具有种属特异性,以及它对Xcc是否有显著抑制效果均暂未得到研究证实。生防菌的开发应用已成为当下植物保护领域的研究热点,它是一种植物病害生物防治的绿色药剂,具有良好的环境兼容性、抗性发生频率低、安全性良好和来源丰富等特点,但生防菌需要经过复杂的筛选过程,其应用效果也需进行评定,导致开发周期长,且从已搜集的文献看,目前拮抗Xcc的生防菌暂未被开发。另外,生防菌如果能与相关植物源抑菌剂复配使用,则能较好保证病害的防治效果。因此,针对黑腐病病原菌Xcc的植物源抑菌剂的开发十分必要。
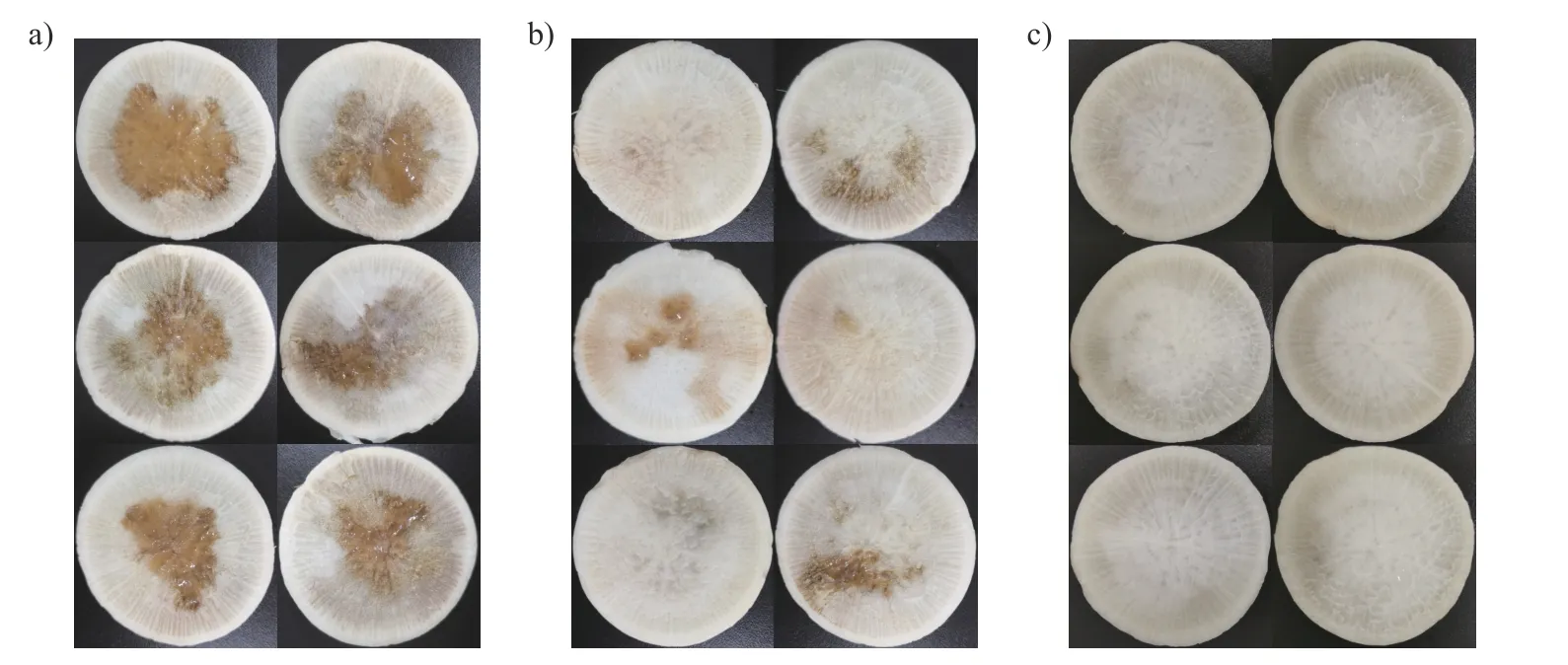
图7 儿茶素对萝卜黑腐病的防治效果Fig.7 The control effect of catechin against black rot disease on radish
细菌生物膜是一个重要的致病因子,在植物—病原物互作中具有毒性作用,因此对生物膜形成的测定十分必要,本研究已证明儿茶素能有效抑制Xcc生物膜的形成。儿茶素对Xcc运动能力的抑制,能减弱病原菌在宿主植物内的定殖能力。本研究已证明儿茶素能引起Xcc胞外蛋白酶产量的降低,病原菌正是通过分泌的胞外酶来降解植物细胞壁,从而使其顺利入侵植物体内。研究结果均表明:在儿茶素的作用下,病原菌的毒力在一定程度上被抑制,这为儿茶素开发成为黑腐病防控药剂提供了理论依据。本研究已经证明儿茶素能抑制Xcc8004 产生的相关致病因子,但具体作用机制尚不清楚,儿茶素等茶叶中多酚类化合物对Xcc的抑制作用机理还有待从分子层面进行研究。从已有研究总结的儿茶素主要抑菌机理包括:对微生物细胞膜、蛋白质和酶以及金属离子的影响[22]。在病原菌与寄主植物的互作过程中,细菌的蛋白分泌系统起着非常重要的作用,其中Ⅲ型分泌系统(type Ⅲ secretion system,TTSS)是病原细菌致病所依赖的最重要的分泌系统[23]。Ⅲ型分泌系统在植物和动物病原菌中高度保守,而且对Xanthomonas的致病性非常重要,Xcc通过Ⅲ型分泌系统将效应蛋白分泌到植物体内,从而完成Xcc在植物体内的侵染过程[24]。后期课题组将搜集Xcc中可能的效应蛋白,并通过构建相应基因的缺失菌株,在儿茶素作用下检测这些基因缺失突变株的生长情况,从而寻找出儿茶素作用的靶基因。在运动性试验中,由于儿茶素为15 μg/mL 的亚抑菌质量浓度,在此条件下儿茶素对Xcc8004 的生长有一定抑制作用,因此细菌运动性降低也可能是因为细菌生长受限导致菌落直径变小,对于“儿茶素使细菌运动性降低”的结论还需提供更多佐证,后期将在添加儿茶素情况下对Xcc进行转录组测序分析,重点关注运动性相关基因转录水平,或通过扫描电镜观察细菌鞭毛的形成情况,进一步验证儿茶素对运动性的影响效果。
细菌对多酚的耐受力取决于细菌的种类和多酚的结构,因此,从不同茶叶品种中提取出的茶多酚的抑菌效果是否存在差异同样值得关注。然而由于儿茶素的提取工艺复杂以及成本颇高,将其应用于大田试验或进行大面积喷施的措施并非科学合理的方案,可考虑人工合成其衍生物,本研究可供实践应用参考。
4 结论
从大叶红茶中提取纯化的儿茶素对野油菜黄单胞菌野油菜致病变种(Xcc)具有一定的抑制作用,儿茶素对Xcc抑制的MIC 值为20 μg/mL,MBC 值为100 μg/mL。在儿茶素亚抑菌质量浓度(15 μg/mL)条件下,其对Xcc的生物膜形成、胞外蛋白酶分泌和运动性均有极显著抑制作用(P<0.001),但对Xcc产生的胞外纤维素酶和胞外淀粉酶没有影响。在活体检测试验中,发现儿茶素对白萝卜黑腐病的发生具有良好的防治作用。本研究可为十字花科黑腐病的防治提供天然杀菌剂模型与理论依据。

