猪流行性腹泻病毒S 蛋白间接ELISA抗体检测方法的建立*
姜睿姣,蒋子睿,王 印 ,姚学萍,杨泽晓,罗 燕
(1.四川农业大学 动物医学院,四川 成都 611130;2.动物疫病与人类健康四川省重点实验室,四川 成都 611130)
猪流行性腹泻(porcine epidemic diarrhea,PED)是由猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)引起的一种具有高度传播性的消化系统疾病,临床上主要表现有急性肠炎、呕吐和水样腹泻等症状[1]。该病可感染各年龄的猪,秋冬季节为疾病的高发期[2-3],常引起仔猪高病死率[4]。临床上,PEDV 可与猪轮状病毒(Porcine rotavirus,PRV)、猪圆环病毒(Porcine circovirus,PCV)等其他病毒混合感染[5],流行范围极广。猪在潜伏期与发病期排泄的粪便、乳汁中都携带大量病毒,对周围环境造成严重污染,给各国养猪业造成了巨大的经济损失[6-8]。
S基因是PEDV 主要的抗原决定基因,由4 152 nt 构成。编码形成的S 蛋白属于Ⅰ型糖蛋白,由1 383 个氨基酸组成[9][S1 区(1~789 aa)和S2 区(790~1 383 aa)],是PEDV 主要致病蛋白。具有促进病毒膜融合、与细胞受体互作、信号传导、固定支撑、诱导自然宿主产生中和抗体等作用[10-11]。S1 区含多个抗原表位和受体结合域,是S 蛋白主要的功能区;S2 区为跨膜区域,该区域促进病毒与宿主细胞膜融合且相对较保守,影响了病毒的侵染能力[12]。本研究前期已对PEDV 分离株做了全基因组测序(GenBank 登录号:MK 702008),发现S1 区碱基发生了多次插入与缺失,这可能会大大影响与受体结合的效率。通过对S 蛋白进行分析,截取S 蛋白抗原决定簇和免疫优势区2 个抗原性较高的片段进行蛋白表达,并以之为包被抗原,建立特异性强、重复性高、结果准确的间接ELISA 抗体检测方法,成功解决了抗原制备的问题同时丰富了PEDV 诊断方法。
1 材料与方法
1.1 毒株、质粒及血清
PEDV 毒株、克隆载体pMD-19T (simple)、表达载体pET-32a (+)、大肠杆菌DH5α 和BL21(DE3)均由四川农业大学动检实验室保存;猪传染性胃肠炎病毒(TGEV)、猪细小病毒(PPV)、猪圆环病毒(PCV)、猪瘟病毒(CSFV)、猪繁殖与呼吸障碍综合征病毒(PRRSV)、猪伪狂犬病毒(PRV)和PEDV 阳性血清均由四川农业大学动检实验室保存。
1.2 主要试剂
质粒提取试剂盒Plasmid Mini Kit 购自Omega公司;DNA Marker、反转录试剂盒、蛋白质Marker(20~120 ku)、T4 DNA 连接酶和IPTG 均购自大连宝生物工程有限公司;ECL 发光试剂盒购自美国Thermo 公司;Ni-Agarose His 标签蛋白纯化试剂盒购自北京康为世纪生物科技有限公司;BCA 蛋白定量检测试剂盒均购自上海生工生物工程有限公司;HRP (辣根过氧化物酶)标记的羊抗猪IgG 和小牛血清购自上海生工生物工程有限公司;猪流行性腹泻快速检测试剂盒购自深圳市绿诗源生物技术有限公司。
1.3 引物设计及合成
截取 S1 与S2 区之间抗原决定簇区域进行载体构建。设计1 对分别插入限制性内切酶BamHⅠ和Hind Ⅲ酶切位点的引物并引入保护碱基,送至上海生工生物工程有限公司合成,引物信息见表1。
1.4 目的基因SJ 的扩增鉴定及重组质粒pET-32a (+)-SJ 的构建
提取分离株SNJ-P 的RNA,转录为cDNA,以cDNA 为模板使用引物(SNJ-F 和SNJ-R)进行PCR 扩增,获得SJ基因。反应条件为:94 ℃ 5 min;94 ℃ 30 s、57 ℃ 30 s、72 ℃ 45 s,34 个循环;72 ℃ 10 min。PCR 产物回收纯化后与pMD-19T(simple)载体16 ℃连接过夜,转化到大肠杆菌DH5α 中。提取质粒经BamH I 和Hind Ⅲ酶切鉴定后,取50 μL 酶切产物添加至0.8%琼脂糖凝胶进行电泳分离,纯化得到SJ目的基因片段,克隆至表达载体pET-32a (+),构建重组质粒pET-32a (+)-SJ。

表1 引物序列Tab.1 The primer sequences
1.5 重组蛋白的表达、纯化及鉴定
将鉴定正确的重组表达质粒pET-32a (+)-SJ与pET-32a (+)空载分别转化至大肠杆菌BL21(DE3)中,培养至菌液OD600nm值在0.6~0.8 左右时,添加终浓度为0.4~1.2 mmol/L 的IPTG,继续诱导表达2~7 h (所有变量按棋盘法进行优化)。目的蛋白SJ 用Ni-Agarose-Resin 层析柱纯化,经SDS-PAGE 电泳后,转印至NC 膜,以猪PEDV 阳性血清为一抗,辣根过氧化酶(HRP)标记的羊抗猪抗体为二抗,进行Western-blot 分析鉴定。使用BCA 蛋白定量检测试剂盒测定纯化的重组蛋白质量浓度。
1.6 间接ELISA 抗体检测方法的建立及反应条件的优化
采用棋盘法进行测定。将纯化的PEDV SJ 蛋白、阴阳性血清按梯度倍比稀释,确定最佳抗原包被质量浓度、最佳血清稀释度和最佳酶标抗体稀释度。纯化的PEDV SJ 蛋白分别作1∶1 000、1∶500、1∶250、1∶125 和1∶62.5 稀释;PEDV阳性血清和阴性血清分别作 1∶100、1∶80、1∶40、1∶20 和1∶10 稀释,酶标抗体按1∶4 000、1∶3 000、1∶2000 和1∶1 000 稀释。按常规ELISA 方法操作,测定记录OD450nm值,计算P/N值,选定最佳稀释度,并且对包被条件、封闭液及时间、显色时间进行逐一优化,确定最优反应条件。
1.7 标准临界值的确定
按已建立的ELISA 方法检测20 份PEDV 阴性血清,计算出平均值与标准方差(SD)。根据统计学原理分析,OD450nm值≥+3SD 时,在99.9%的统计学水平上即可判定为阳性;反之,当OD450nm值<+3SD 时,可判定为阴性。
1.8 特异性试验、重复性试验和符合率试验
用已建立的间接ELISA 抗体检测方法,检测实验室保存的PPV、PRV、TGEV、PRRSV、PCV 和CSFV 阳性血清。每份血清做3 个重复,并设立PEDV 阴性血清和阳性血清作为对照。测定OD450nm值,计算平均值,判定血清阴阳性用以确定方法的特异性。
批内重复:选取3 份PEDV 不同抗体水平的猪血清,在同一时间进行间接ELISA 抗体检测试验,每份血清重复3 次,测定OD450nm值,分别计算3 份血清OD450nm值的平均值、标准方差及变异系数;批间重复:选取3 个不同时间包被的酶标板,3 份PEDV 不同抗体水平的猪血清,在不同时间测定OD450nm值,分别计算3 份血清平均值、标准方差及变异系数。
随机选取30 份血清,分别用建立的ELISA方法与绿诗源猪流行性腹泻快速检测试剂盒同时进行检测,比较两者符合率。
1.9 临床应用
为评价该方法在临床上的应用价值,采集四川6 个猪场120 份血清进行检测,测定OD450nm值,统计阳性检出率。
大多数微生物的含氮量比例较一致,根据含氮量再乘以一定的数值即可测得其粗蛋白的含量,从而大致可以得到活菌的生长情况,传统方法常用凯氏定氮法进行测定,该方法具有广泛的适应性、操作简单易行、试剂消耗少等优点,但是其只能测得有机氮的含量,所以其测定结果不太准确。
2 结果与分析
2.1 SJ 基因的扩增及重组表达质粒的鉴定
以分离株SNJ-P 的cDNA 作为模板扩增获得目的基因SJ,片段大小为315 bp (图1a)。回收目的条带,构建重组质粒pMD-19T-SJ,使用快切酶BamH I 和Hind Ⅲ进行酶切鉴定(图1b)得到2 692 与315 bp 2 条片段,与预期相符。将酶切产物克隆至表达载体构建重组质粒pET-32a(+)-SJ,用相同2 种快切酶鉴定得到6 196 和315 bp 2 条条带与预期结果相符。重组质粒送上海生工生物工程股份有限公司测序,测序结果分析表明重组质粒成功构建。
2.2 重组蛋白的鉴定及表达纯化
pMD-19T-SJ和空载菌经IPTG 诱导表达后,用SDS-PAGE 进行鉴定,结果显示:重组菌和空载菌分别在35 和24.8 ku 出现了特异性蛋白条带(图2a),与预期相符,表明成功表达SJ基因。采用Ni-Agarose-Resin 层析柱纯化蛋白,Westernblot 结果显示:诱导表达的重组蛋白可以与PEDV阳性血清发生特异性反应,表明重组蛋白具有良好的反应原性(图2b),并测得重组蛋白质量浓度为1.145 mg/mL。

图1 SJ 基因片段扩增及pMD-19T-SJ 双酶切鉴定电泳图Fig.1 Amplification of SJ gene fragment and pMD-19T-SJ double enzyme digestion identification
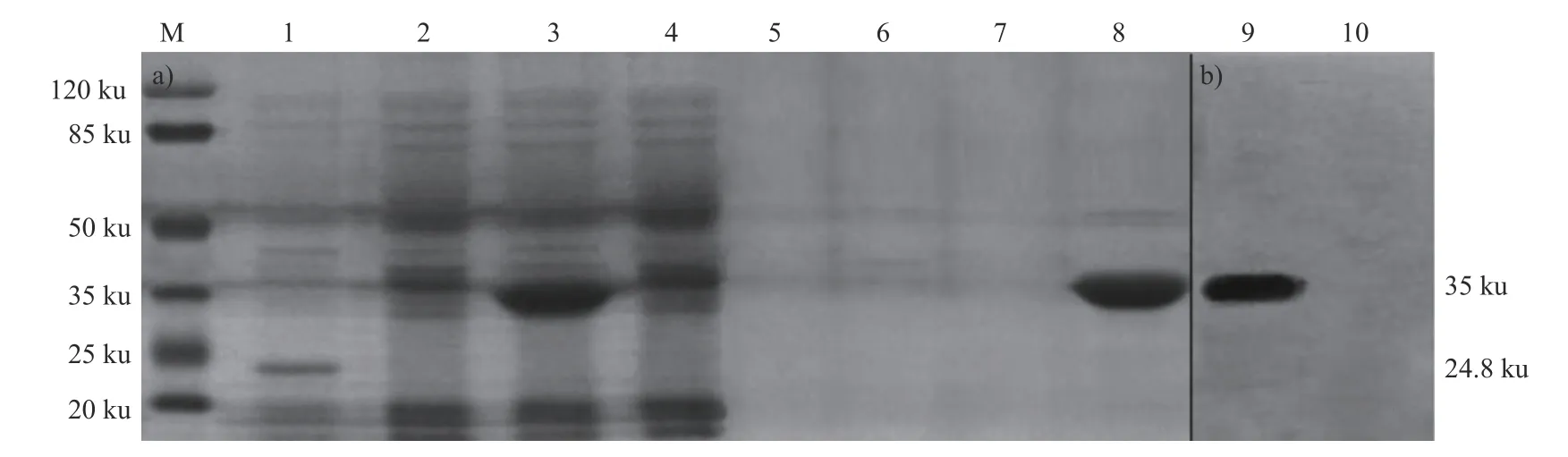
图2 重组SJ 蛋白SDS-PAGE 检测及Western-blot 分析Fig.2 Expression of the target protein and Western-blot
2.3 PEDV S 蛋白间接ELISA 抗体检测方法的建立
2.3.1 最佳反应条件确定
采用棋盘法优化各参数后,确定了最佳反应条件:抗原稀释倍数为1∶125 (9.16 μg/mL),每孔100 μL 4 ℃过夜37 ℃孵育1 h 进行包被,用5% BSA 加0.1%的吐温-20 37 ℃封闭75 min,最佳血清稀释倍数为1∶40,1∶1 000 酶标抗体孵育45 min,底物显色时间为10 min,能有最优反应结果。
2.3.2 间接ELISA 抗体检测方法临界值的确定
按已建立的间接ELISA 抗体检测方法检测20份阴性血清,计算其OD450nm平均值为0.201 1,标准方差(SD)为0.041。根据+3SD 计算出临界值为0.324 1,记为0.324。当样本OD450nm≥0.324时判定为阳性,否则判为阴性。
2.3.3 特异性试验
用建立的间接ELISA 抗体检测方法,检测试验室保存的PPV、PRV、TGEV、PRRSV、PCV和CSFV 阳性血清,并设立PEDV 阴性血清和阳性血清作为对照。试验结果如表2 所示:除PEDV阳性血清外,OD450nm值均小于0.324,判定为阴性。试验证明建立的间接ELISA 抗体检测方法特异性良好。
2.3.4 重复性试验
选取3 份PEDV 不同抗体水平的猪血清,进行重复试验,批内与批间重复试验变异系数在1.23%~5.84%之间(表3)。试验证明建立的间接ELISA 抗体检测方法重复性良好。

表2 特异性试验结果Tab.2 Specificity of indirect ELISA
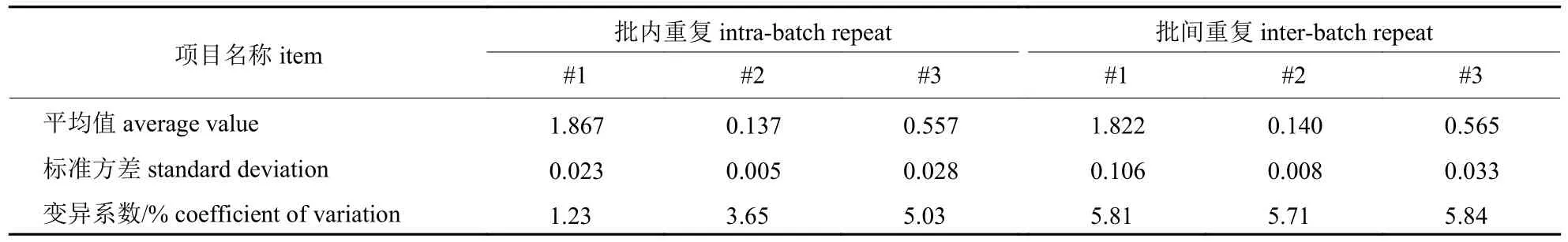
表3 批内重复性试验结果Tab.3 The results of intra-assay repeat tests
2.3.5 符合性试验
随机选取30 份血清,分别用建立的ELISA方法与市售PEDV 抗体检测试剂盒同时进行检测,计算符合率为96.67%,试验证明建立的间接ELISA 抗体检测方法结果可靠。
2.3.6 临床血清检测结果
采集四川6 个猪场120 份血清进行检测,测定OD450nm值,结果显示哺乳仔猪血清阳性率为72% (36/50),妊娠母猪血清阳性率为87.14% (61/70),试验证明有较好的利用范围和检测效率。
3 讨论
PED 主要在欧洲和亚洲大规模暴发[13-15],给全球养猪业造成了巨大的损失。国内外研发了许多预防该病的疫苗,大多以灭活苗与活疫苗为主[16],如马思奇等[17-18]首先报道了氢氧化铝组织灭活苗,使用后免疫效果达85%以上;中国农业科学院哈尔滨兽医研究所研发的“猪传染性胃肠炎—猪流行性腹泻—猪轮状病毒”三联活疫苗[19],虽然使用后能在一定时间内降低猪群PED 的感染率,但预防效果都在疫苗接种一段时间后降低,这可能是由PEDV 变异导致疫苗无法起到很好的保护作用,使得疫情难以控制[20]。对免疫猪群抗体水平的检测是PED 有效防控的关键,建立一种快捷、方便和准确的PEDV 检测方法十分迫切。现已有很多关于PEDV 的ELISA检测方法,但大多以双抗夹心ELISA 为主[21-23],单克隆抗体制备花费时间长、效率低且对技术要求高,不是特别适用于规模化生产及检测。目前市场上只有少量PEDV 抗体检测试剂盒售卖,抗原大都包被的是全病毒[24-26],易出现假阳性,间接ELISA 抗体检测方法相比较而言,操作更简便、成本更低、特异性更强以及具有更高的利用价值。此外还有许多检测手段,RT-qPCR[27]虽然特异性好、灵敏性高,但依赖于仪器设备;胶体金[28]虽然成本低、检测快速,但只能对病毒定性不能定量;PEDV 相比于其他冠状病毒分离培养的难度大很多,且存在病毒传代的过程中丢失毒株的风险,导致很难大量制备抗原。以具有抗原性的重组蛋白作为ELISA 包被抗原,可以很好地解决这一难题。
早期,大多是以疫苗株CV777 序列为基础建立的PEDV 抗体检测方法[29-30]。但是由于PEDV不断变异,检测结果易受到影响。本研究通过分析分离得到的强毒株SNJ-P 的S基因,截取抗原性高的序列,成功构建重组质粒,表达纯化获得的SJ 蛋白。以该蛋白作为包被抗原,通过棋盘滴定法,优化各反应条件,建立PEDV S 蛋白的间接ELISA 抗体检测方法。通过对20 份阴性血清OD450nm值的测定,计算出阴阳性临界值+SD=0.324 1。该方法检测PPV、PRV、TGEV、PRRSV、PCV 和CSFV 阳性血清均为阴性,证明建立的间接ELISA 抗体检测方法具有良好的特异性。3 份抗体水平不同的血清进行批内与批间重复试验,计算变异系数在1.23%~5.84%之间,证明建立的间接ELISA 抗体检测方法具有良好的重复性。分别使用建立的间接ELISA 方法与市售PEDV 抗体检测试剂盒对30 份血清进行检测,计算符合率为96.67%,证明该方法结果可靠。再使用该方法对采自6 个猪场不同种类猪的120 份血清进行PED 抗体检测,最终的抗体阳性率为80.83%;其中,妊娠母猪血清阳性率为87.14%,哺乳仔猪的血清阳性率为72%。母猪在免疫之后机体能否产生抗体直接关系到哺乳仔猪能否通过乳汁获得抗体。该试验结果证明:哺乳仔猪可以通过乳汁获得一定的免疫保护。获得的免疫保护力大小可能与乳汁中抗体水平的高低有关系[31]。
4 结论
近年来,流行毒株的不断变异导致现有疫苗不能提供足够保护,加之更多的猪源性传染病可以与该病混合感染导致PED 疫情更加复杂,难以防控治疗。因此高效精确地诊断PEDV 对有效实施疾病的控制措施至关重要,这些措施有助于降低病毒进一步传播的风险[32],也为后续治疗争取宝贵的时间。本研究对PEDV 强度株SNJ-P 的部分S基因进行原核表达,初步建立了PEDV 抗体间接ELISA 抗体检测方法。该诊断方法具有快捷、方便、准确等优点,可以成为临床上对PEDV抗体水平的监控方法,为以后诊断试剂盒的研制提供理论指导。

